奥拉帕利治疗转移性去势抵抗性前列腺癌的疗效及安全性分析
2023-08-12王成宇符博周玉贺贾占奎杨锦建
王成宇 符博 周玉贺 贾占奎 杨锦建
郑州大学第一附属医院泌尿外科 郑州 450052
前列腺癌(PC)是男性最常见的实体恶性肿瘤之一,随着人口老龄化的加剧,PC的发病率也逐年上升,其预后因种族、年龄、进展阶段和遗传背景有很大差异[1-2]。雄激素剥夺治疗(androgen deprivation therapy,ADT)是转移性前列腺癌治疗的标准,虽初期多能控制疾病进展,但绝大多数可进展为转移性去势抵抗性PC (metastatic castration-resistant prostate cancer,mCRPC)[3],常规内分泌治疗的效果并不理想,生活质量低且预后较差[4]。随着高通量测序技术(next generation sequencing,NGS)在临床诊疗中的广泛应用,PC已进入靶向、精准及个体化治疗时代。二磷酸核糖聚合酶抑制剂[inhibitors of poly (ADP-ribose) polymerase,PARPi]是新型的靶向药物,其基于合成致死效应,能使同源重组修复(homologous recombination repair, HRR)相关基因突变的mCRPC患者受益[5]。奥拉帕利是首个用于治疗HRR功能缺陷的mCRPC的PARPi[6]。美国药品监督管理局(FDA)于2020年批准奥拉帕利可以用于经雄激素受体(AR)拮抗剂治疗后进展以及HRR相关基因突变的mCRPC[7]。国际上已有多个Ⅱ、Ⅲ期临床试验[7-9]证实了奥拉帕利在mCRPC患者中具有抗肿瘤活性,并在提升前列腺特异性抗原(prostate-specific antigen,PSA)应答率和延长无进展生存时间(progression-free-survival,PFS)方面取得了重大进展。本研究对比分析在不同用药方式和HRR相关基因突变状态不同的mCRPC患者中使用奥拉帕利的疗效及安全性,以期为进一步探索基因检测和早期联合治疗的必要性。
1 资料与方法
1.1临床资料回顾性分析2022-01—2022-11在我院使用奥拉帕利单药或奥拉帕利联合新型AR拮抗剂治疗先前已接受多西他赛或其他新型AR拮抗剂一线治疗后进展的mCRPC患者的临床资料。纳入标准:(1)均经病理检查确诊为PC。已接受多西他赛或某种新型AR拮抗剂治疗且耐药。(2)使用奥拉帕利时符合mCRPC诊断标准。使用时间>2个月。(3)未合并其他肿瘤,临床及随访资料完整。排除标准:(1)对奥拉帕利过敏。(2)擅自停药或院外购药。(3)一般状况差,或患有其他严重疾病,预期寿命<6个月。依据纳排标准共筛选出52例患者。记录患者的年龄、PSA值、首次用药时间、睾酮水平、盆腔影像学检查结果(增强MRI、PET-CT、骨扫描)、穿刺病理Gleason评分、肿瘤分期、既往治疗史、实验室资料(血、生化常规等)、ECGO评分、合并其他基础疾病情况,以及HRR相关基因检测的突变结果等。
1.2分组及治疗方法52例mCRPC患者的ADT治疗贯穿始终。根据不同治疗方案分为2组。(1)单药治疗组(17例):奥拉帕利口服,300 mg,2次/d。(2)联合治疗组(35例):奥拉帕利联合不同新型AR拮抗剂治疗。若患者已对某种新型AR拮抗剂耐药,则联合另一新型AR拮抗剂的序贯治疗。根据不同的新型AR拮抗剂分为3个亚组。(1)阿比特龙组(18例):阿比特龙口服,1 000 mg,1次/d。泼尼松口服,5 mg,2次/d。(2)阿帕他胺组(9例):阿帕他胺口服,240 mg,1次/d。(3)达罗他胺组(8例):达罗他胺口服,600 mg,2次/d。根据HRR相关基因突变状态不同分为HRR突变亚组(12例)和HRR未突变亚组(9例)。用药期间若不良反应严重,则行减量或中断治疗,对症处理并缓解后继续按原剂量服用。
1.3随访方式及疗效、安全性评估通过电子病历查阅、门诊复查,及电话随访,了解mCRPC患者的诊疗过程、PSA和睾酮的变化曲线、影像学检查结果、药物剂量变化、不良反应,以及疾病进展情况。观察分析使用奥拉帕利前后mCRPC患者PSA应答、疾病进展情况、药物副作用发生率。按照不同组及亚组,分别比较用药前后、不同用药方式、基因突变状态不同的mCRPC患者间的PSA缓解率、早期PFS、药物不良事件发生率。随访时间(7.43±2.43)个月(范围:5~11个月),随访截止时间为2023-01-31。
2 结果
2.1临床资料单药治疗组和联合治疗组患者的临床资料差异无统计学意义,见表1。

表1 单药治疗组和联合治疗组临床资料比较[n(%)]
2.2临床疗效
2.2.1 单药治疗组和联合治疗组的疗效 52例mCRPC患者治疗至少2个月后的PSA总体缓解率为44%(23/52),其中17例(33%)PSA下降达50%以上,10例(19%)下降达90%以上。单药治疗组中6例(35%)患者对奥拉帕利有反应,其中3例(18%)患者PSA下降达50%以上,2例(12%)达90%以上。联合治疗组中17例(48%)患者对奥拉帕利联合新型AR拮抗剂有反应,其中14例(40%)PSA下降达50%以上,8例(23%)下降达90%以上。见图1。
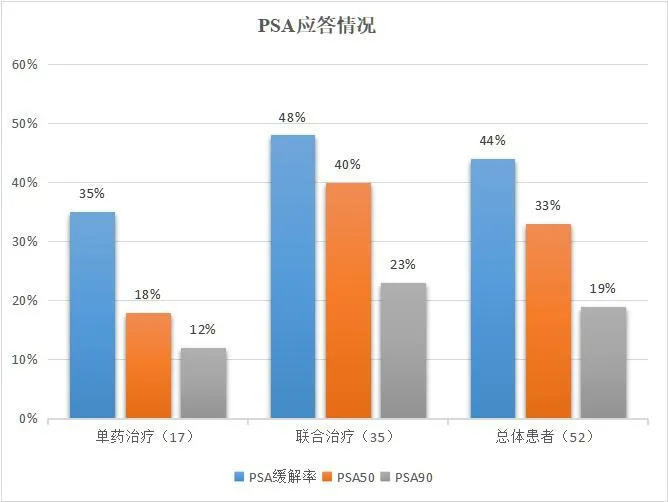
图1 奥拉帕利单药或联合治疗mCRPC患者PSA应答情况
截至随访前,单药治疗组和奥拉帕利联合新型AR拮抗剂治疗组随访时间分别为(7.8±2.97)个月和(7.3±2.14)个月(P=0.703)。52例mCRPC患者中有33例(63%)出现不同程度的疾病进展。单药治疗组患者中13例(76%)出现进展,中位PFS为3.5个月;联合治疗组患者中20例(57%)出现进展,中位PFS为6.5个月。利用Kaplan-Meier法绘制PFS曲线图,见图2。采用Log-rank检验结果显示,联合治疗组的PFS优于单药治疗组(P=0.034)。

图2 以疾病进展为终点的Kaplan-Meier曲线
2.2.2 奥拉帕利联合不同新型AR拮抗剂亚组间疗效 联合治疗组患者中,18例(51%)联合阿比特龙,9例(26%)联合阿帕他胺,8例(23%)联合达罗他胺。联合阿比特龙的患者中,8例(44%)对治疗有反应,6例(33%)PSA下降至50%以上,3例(17%)PSA下降至90%以上。联合阿帕他胺治疗的患者中,5例(56%)对联合治疗有反应,4例(44%)患者的PSA下降至50%以上,3例(33%)下降至90%以上。联合达罗他胺治疗的患者中,4例(50%)对治疗有反应,PSA均下降至50%以上;2例(25%)PSA下降至90%以上。见图3。
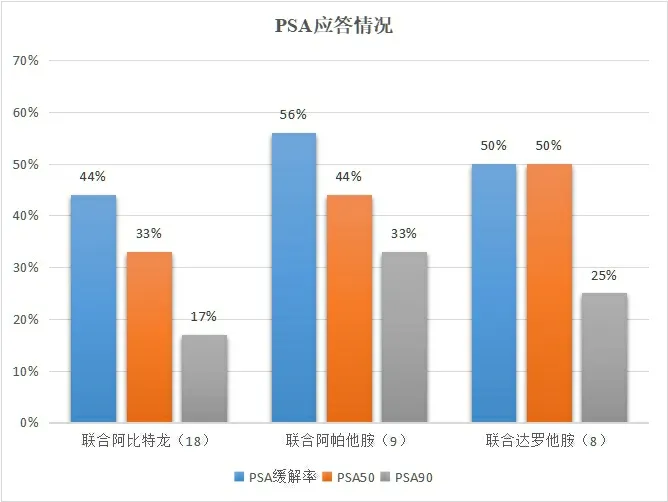
图3 奥拉帕利联合不同新型AR拮抗剂PSA应答情况
截至随访前,联合治疗组的35例患者中,20例(57%)出现疾病进展。其中:阿比特龙组有11例(61%)出现进展,中位PFS为6.5个月;阿帕他胺组有5例(56%)出现进展,中位PFS为6.5个月;达罗他胺组有4例(50%)出现进展,中位PFS为5.5个月。绘制PFS曲线图,见图4。检验结果显示,奥拉帕利联合不同新型AR拮抗剂各亚组之间的PFS差异无统计学意义(P=0.812)。
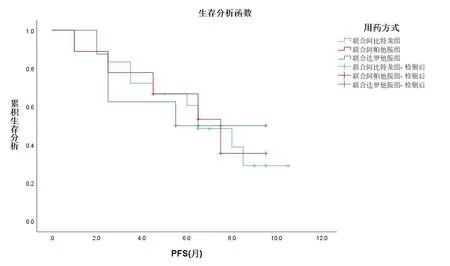
图4 以疾病进展为终点的Kaplan-Meier曲线
2.2.3 不同HRR基因突变状态患者使用奥拉帕利疗效 52例患者中,21例(40%)患者通过随访获得了HRR相关基因检测的结果(其余患者因未进行检测或结果缺失未知HRR突变状态)。无突变9例(43%)。HRR相关基因突变12例(57%),其中BRCA2突变患者6例,CDK12突变患者2例,CHEK2、ATM、RAD51C、RAD51D突变患者各1例。BRCA2突变患者中,1例患者同时合并ATM突变。HRR无突变的9例患者中,1例联合阿比特龙治疗,1例联合阿帕他胺治疗。2例(22%)PSA均下降至90%以上。HRR突变的12例患者PSA总体缓解率为67%(8/12),6例BRCA2突变患者PSA缓解率为67%(4/6),其中2例(33%)患者PSA下降至90%以上。2例CDK12突变患者中,1例PSA下降至50%以上,1例出现PSA进展。1例RAD51D突变患者PSA下降至50%以上,1例RAD51C和1例CHEK2突变患者PSA均下降至90%以上。ATM突变的1例患者对奥拉帕利的治疗无反应。值得注意的是,应用奥拉帕利单药治疗且截止随访前未发生进展的4例患者,均有HRR相关基因突变,分别为BRCA2突变2例、RAD51C突变1例和RAD51D突变1例。不同HRR基因突变状态使用奥拉帕利单药或联合治疗的PSA应答情况见图5。本研究27例HRR相关基因突变状态未知的患者,使用奥拉帕利联合新型AR拮抗剂治疗,PSA总体缓解率为44%,且截至随访前,37%未发生进展。
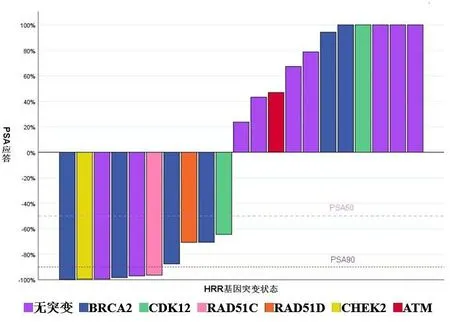
图5 不同HRR基因突变状态使用奥拉帕利PSA应答情况瀑布图
截至随访前,携带HRR相关基因突变的12例患者中,5例(42%)患者出现疾病进展,中位PFS为7.25个月;无突变的9例患者中,7例(78%)患者出现疾病进展,中位PFS为2个月。绘制PFS曲线图,见图6。采用Log-rank检验结果显示,携带HRR相关基因突变的mCRPC患者的PFS明显优于未突变患者,差异有统计学意义(P=0.027)。
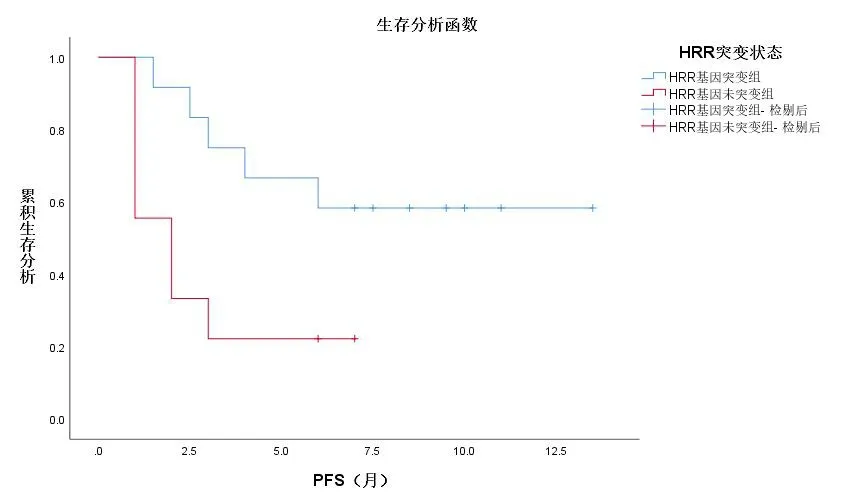
图6 以疾病进展为终点的Kaplan-Meier曲线
2.3安全性本研究52例患者在治疗过程中,39例(75%)出现不同程度的不良反应,以1~2级为主,其中13例(25%)出现3级以上不良反应。最常见的不良反应为疲劳和乏力(69%)、消化系统症状(67%)、贫血(63%)。5例(10%)患者因不良反应减量治疗,7例(13%)中断治疗,1例(2%)患者停止用药。1~2级不良反应轻微,经对症处理后有所好转,3级以上不良反应经减量、中断治疗和对症处理后,均有所好转且继续用药,总体不良反应可控。见表2。其中单药治疗组12例(71%)患者出现不同程度的不良反应,联合新治疗组27例(77%)出现不同程度不良反应。2组差异无统计学意义(P=0.864)。

表2 不良反应发生情况[n(%)]
3 讨论
本研究结果表明,奥拉帕利单药或是联合某种新型AR拮抗剂对经多西他赛或新型AR拮抗剂一线治疗后进展的mCRPC患者均有一定疗效。至少用药2个月后的PSA总体缓解率为44%,其中单药治疗组为35%,联合治疗组为48%。截至随访前,单药治疗组76%的患者出现进展。中位PFS为3.5个月,联合治疗组57%的患者出现进展。中位PFS为6.5个月,差异有统计学意义。奥拉帕利联合不同新型AR拮抗剂各亚组之间的PSA缓解率、疾病进展情况、PFS的差异均无统计学意义。HRR相关基因突变亚组和未突变亚组间的PSA缓解率分别为67%和22%,中位PFS分别为7.25个月和2个月,差异有统计学意义。治疗期间,75%的患者出现不同程度的不良反应,以1~2级为主,25%的出现3级以上不良反应。均经减量、中断治疗,以及对症处理后有所好转且继续用药,总体不良反应可控,2组的不良反应发生率差异无统计学意义。
HRR相关基因缺陷正日益成为PC患者个体化治疗的重要生物标志物,应用PARPi治疗mCRPC也具有里程碑意义[10]。数据表明,约有30%的mCRPC患者存在HRR功能缺陷[11],利用PARPi和HRR缺陷间的合成致死性,奥拉帕利已使HRR相关基因突变的mCRPC患者获得生存优势和受益,有争论的是HRR突变是使用奥拉帕利的先决条件,还是HRR未突变的mCRPC患者接受奥拉帕利与其他药物的联合治疗也可能受益[12]。研究表明[13],AR抑制剂的AR阻断作用会导致参与DNA修复的基因受到抑制,增强DNA损伤;同时,多聚腺苷二磷酸核糖聚合酶(poly adenosine diphosphate-ribose polymerase,PARP)除了在DNA修复中的作用外,还参与多种转录调节功能,包括调节AR功能。这种双重作用增加了mCRPC患者对PARRi与AR拮抗剂联合治疗的敏感性。HRR、PARP和AR间复杂的相互作用可通过联合治疗策略加以利用,以增强DNA损伤和癌细胞死亡,即使在没有HRR改变的患者中也是如此[14]。一项Ⅱ期临床研究评估了奥拉帕利与阿比特龙联合治疗142例未行HRR基因检测的mCRPC患者的疗效[15],结果表明,奥拉帕利与阿比特龙联合与阿比特龙单独治疗,中位影像学的PFS均有所改善。PROpel[16]研究是一项全球多中心、随机、双盲Ⅲ期临床研究,将796例mCRPC患者按照1∶1随机分为奥拉帕利联合阿比特龙组(399例)和安慰剂联合阿比特龙组(397例)。结果显示,奥拉帕利联合阿比特龙比阿比特龙单药治疗的中位影像学PFS延长8.2个月(HR 0.66,95%CI0.54~0.81,P<0.0001),联合治疗组的中位影像学PFS>24个月,总生存时间>42个月,这是当前mCRPC一线研究中最长总生存时间。本研究27例HRR相关基因突变状态未知的患者,使用奥拉帕利联合新型AR拮抗剂治疗,PSA总体缓解率为44%,截至随访前,37%的患者未发生进展。奥拉帕利联合新型AR拮抗剂,能够使mCRPC患者生存获益,且无需考虑HRR相关基因的突变状态。
奥拉帕利的不良反应与药物剂量相关,以血液学毒性最为明显,多以轻、中度为主,通常在用药的前3个月出现,半年内缓解,不良反应绝大多数可通过对症支持治疗、减少剂量,或中断治疗得到有效控制[17-18]。PROfound研究[7]中,奥拉帕利3级以上贫血的发生率为21%,贫血总发生率是46%,本研究与之相似。但mCRPC患者在确诊时,约有30%即患有贫血。本研究亦发现,与单药治疗比较,联合新型AR拮抗剂并不会明显增加不良反应事件发生率。
综上所述,奥拉帕利单药或联合一种新型AR拮抗剂均能使已对多西他赛或其他新型AR拮抗剂耐药的mCRPC患者获益,联合治疗的PFS优于单药治疗且未明显增加不良反应发生率。奥拉帕利单药治疗多限于HRR相关基因突变患者,HRR未突变者反应相对较差。奥拉帕利与新型AR拮抗剂间具有协同作用,即便是HRR未突变患者仍能从中获益。奥拉帕利联合不同新型AR拮抗剂对患者的PSA缓解率、疾病进展,以及PFS等无显著差异。因此,对mCRPC患者进行基因测序,早期进行针对性联合治疗,可能是一种有前途的策略。
本研究存在一定局限性,首先,作为单中心的回顾性研究,存在选择偏倚。其次,由于HRR相关基因测序及奥拉帕利在PC的使用时间较短,样本量小,随访时间短。还需进一步扩大样本量,延长随访时间证实结论。最后,本研究中奥拉帕利联合不同新型AR拮抗剂各亚组及HRR相关基因突变状态不同亚组患者比例较少,联合不同新型AR拮抗剂以及不同HRR相关基因突变状态患者间的差异性仍待考量。
