原发性膀胱副神经节瘤12例临床分析并文献回顾
2023-08-12王子豪李铮司马晨阳陈欢欢杨锦建
王子豪 李铮 司马晨阳 陈欢欢 杨锦建
郑州大学第一附属医院 郑州 450052
副神经节瘤(paraganglioma,PGL)是起源于肾上腺外自主副神经节的罕见肿瘤,与嗜铬细胞瘤(pheochromocytoma,PHEO)的联合发病率约为0.8/10万[1]。交感神经副神经节瘤沿胸部、腹部和盆部的交感神经椎旁神经节分布,瘤体可持续或间断释放大量儿茶酚胺入血并激活肾上腺素能受体,从而引起 “头痛、心悸、大汗”三联征,以及阵发性高血压等[2]。膀胱PGL可能起源于膀胱逼尿肌的交感神经丛,占膀胱肿瘤的不到1%,在无阳性家族史、高血压、典型肉眼血尿和特异性排尿症状时,诊断较困难[3]。现回顾性分析12例2012-08—2022-12就诊于我院的原发性膀胱PGL患者的临床资料,并结合文献复习,以提高对膀胱PGL的诊疗水平。
1 临床资料
12例患者中,男7例,女5例;年龄48岁(范围:13~66岁)。首发症状为间断肉眼血尿3例,排尿后心悸、头痛4例,发作性头痛、头晕1例,无症状4例。9例合并有“高血压”,最高达160~220/100~120 mmHg;3例血压正常。术前推定诊断为“膀胱肿瘤”4例,“膀胱副神经节瘤”8例。均经超声或CT检查发现膀胱占位,其中,膀胱左侧壁5例,右侧壁3例,前壁2例,顶壁1例,三角区1例。肿瘤直径3.73 cm(范围:1.5~7.1 cm)。6例行膀胱镜检查,肿瘤突出于膀胱腔内4例,局限于膀胱壁而黏膜表面正常2例。2例行膀胱根治性切除术,2例行经尿道膀胱电切术,余8例行膀胱部分切除术。术后病理结果均为膀胱副神经节瘤。免疫组化结果:CK阳性0例,Syn、CgA、CD56的阳性率均为100%(12/12),S-100的阳性率为83.3%(10/12)。1例失访,余11例术后定期于门诊随访8~84个月,8例无复发,血压平稳,机体代谢基本恢复正常。3例复发,复发时距初次治疗分别间隔8个月、15个月和36个月,其中1例于术后18个月死于全身多发转移。
2 病例简介
病例1,17岁男性,以“体检发现血尿、蛋白尿15天”为主诉,拟诊为“肾炎综合征”收入我院肾内科。尿常规检查:尿蛋白++,红细胞442/μL,24 h尿蛋白总量0.63 g。泌尿系超声检查示左肾积水,左侧输尿管全程扩张,膀胱壁增厚、毛糙,膀胱实性占位。转我院泌尿外科治疗,单胺类神经递质及代谢物检测示:去甲肾上腺素5.13 nmol/L(参考范围0~5.17 nmol/L),肾上腺素<0.12 nmol/L(参考范围0~0.34 nmol/L), 3-甲氧基去甲肾上腺素0.71 nmol/L(参考范围0~0.71 nmol/L),3-甲氧基肾上腺素0.18 nmol/L(参考范围0~0.42 nmol/L),香草扁桃酸105.22 nmol/L(参考范围0~62.00 nmol/L)。CT检查示膀胱左后壁团块状软组织密度影,增强扫描明显不均匀强化,累及左侧输尿管膀胱入口,左侧肾盂及输尿管扩张积液,左肾局部强化程度减低(图1)。诊断为“膀胱副神经节瘤”,行“腹腔镜膀胱部分切除术+左侧输尿管膀胱再植术”。大体标本示:(膀胱肿物)部分膀胱黏膜组织大小3.2 cm×2.7 cm×2.3 cm,黏膜上可见一大小约3.0 cm×2.5 cm×2.0 cm灰红肿物,切面灰红、质中、界欠清。病理结果:(膀胱肿瘤)副神经节瘤/嗜铬细胞瘤。免疫组化:CK(-),CD56(+),Syn(+),CgA(+),S-100(+),Ki-67(约2%+),GATA-3(少数+)。术后随访21个月,未发现复发或转移。

注:A下腹部平扫CT显示膀胱左后壁可见一团块状软组织密度影(箭头所示),轮廓光滑,断面约为37 mm×25 mm。B 增强CT可见膀胱内肿块呈明显不均匀强化。
病例2,59岁女性,以“小便时血压升高20年余、加重6月余”为主诉,以“膀胱占位,高血压病”收入我院泌尿外科。24 h尿去甲肾上腺素46.00 μg/d(参考范围0~50 μg/d),肾上腺素17.00 μg/d(参考范围0~20 μg/d),多巴胺281.00 μg/d(参考范围0~500 μg/d)。CT检查提示膀胱左侧壁见类圆形软组织肿块,约3.4cm×2.5 cm,增强扫描呈轻中度不均匀强化,内见低密度无强化区。膀胱镜检查示:膀胱左前壁近颈口处有约4 cm×4 cm外压性表现,黏膜光滑未见明显异常,充盈或排空膀胱后患者均未诉特殊不适(图2A)。患者有间断小便后血压升高、头痛、心悸等特异性症状,结合影像学检查和膀胱镜检查,术前诊断为“膀胱副神经节瘤”。行“达芬奇机器人辅助下膀胱部分切除术”。术后病理示:(膀胱肿物)副神经节瘤/嗜铬细胞瘤。断面未见肿瘤。免疫组化:CK(-), CD56(+), Syn(+), CgA(+), a-inhibin(-), S-100(+), GATA-3(部分弱+), CK7(-), CK20(-), P63(-), Ki-67(约1%+)。随访至术后41个月,无复发转移征象。
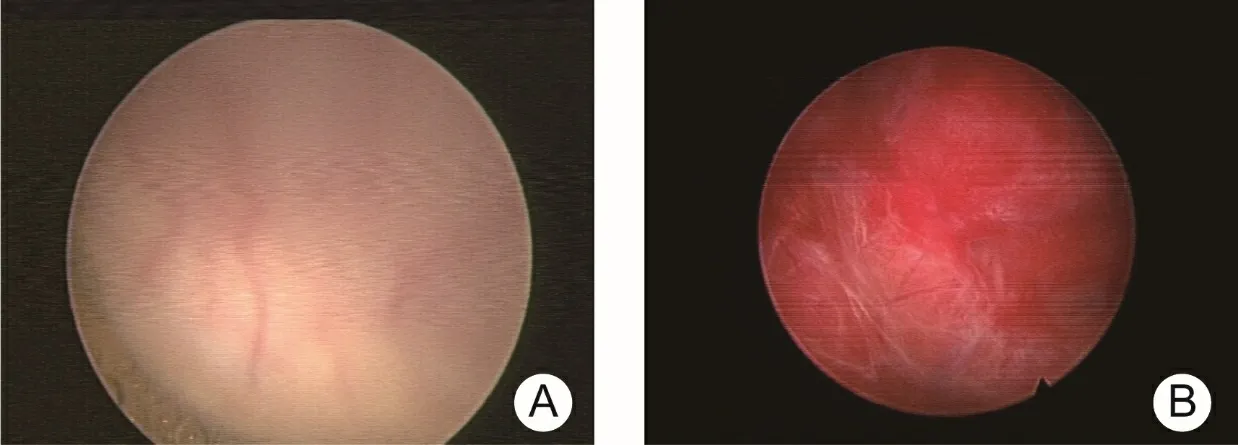
注:A病例2膀胱镜检查示膀胱左前壁近颈口处,范围约4 cm×4 cm膀胱壁呈外压性表现,其上黏膜光滑未见明显异常。B病例4膀胱镜检查示膀胱前壁近颈口处一实性肿物凸向膀胱腔内,大小约2 cm×2 cm,表面血供丰富。
病例3,43岁男性,以“确诊膀胱副神经节瘤10年,间歇性肉眼血尿半月,加重2天”为主诉,初步诊断“膀胱副神经节瘤并膀胱出血”收入我院泌尿外科。既往首发症状为间断肉眼血尿,伴阵发性排尿时晕厥、心悸、恶心。10年前于院外确诊为膀胱副神经节瘤行膀胱部分切除术,其间因复发行3次膀胱部分切除术减瘤,2次行131I-MIBG放射性核素治疗。还因严重血尿先后于我院介入科接受4次选择性膀胱动脉栓塞止血术。生化检查:24 h尿去甲肾上腺素1 958 μg/d,尿肾上腺素732 μg/d,尿多巴胺230 μg/d。单胺类神经递质及代谢物检测示:3-甲氧基肾上腺素2.59 ng/mL(参考范围0~20 ng/mL),3-甲氧基去甲肾上腺素26.63 ng/mL(参考范围0~170 ng/mL)。CT检查示膀胱前下壁见不规则软组织肿块影,内密度不均,见斑块状致密度影,境界不清,前壁与腹直肌分界不清,下壁与前列腺分界不清;增强后强化不均,边缘强化较明显,最大横截面约7.1 cm×6.7 cm。术前诊断为“膀胱副神经节瘤”,行“膀胱根治性切除术”。术后病理示:(膀胱)副神经节瘤,自检四周切缘及送检输尿管断端均未见肿瘤累及。免疫组化:CK(-), CEA(-), CD56(+), Syn(+), CgA(-), GATA-3(灶+), CK5/6(-), CK7(-), CK20(-), P63(-), Ki-67(局部10%+), S-100(+)。随访至术后18个月,死于肝、肺、骨转移。
病例4,58岁女性,以“体检发现膀胱占位10天”为主诉,以“膀胱占位性病变”收入我院泌尿外科。膀胱镜检查示膀胱前壁占位(图2B)。CT检查示膀胱底部可见圆形软组织肿块,大小约2 cm×2 cm,增强扫描明显强化,延迟期可见充盈缺损,膀胱壁不均匀稍厚、毛糙。诊断为“膀胱肿瘤”,行“经尿道膀胱肿瘤电切术”。术中见膀胱前壁近颈口处一实性肿物,血供丰富,切除过程中,血压波动较大,最高升至220/130 mmHg,心率123次/min。高度怀疑为膀胱副神经节瘤,予以乌拉地尔控制血压,肿瘤切除后患者血压降低明显,予以去甲肾上腺素持续泵入控制血压。术后病理示:(膀胱肿瘤)神经内分泌肿瘤,符合副神经节瘤/嗜铬细胞瘤。免疫组化结果:CK(-),CK7(-),CK20(-),Syn(+),CD56(+),CgA(+),S-100(+),GATA-3(-),P63(-),CK5/6(-),Ki-67(约1%+)。术后随访24个月,无复发转移征象。
3 讨论
膀胱PGL仅占PGL的6%,患者的存活率低于其他类型的PGL[4]。在胚胎发育过程中,副神经节可沿主动脉轴和盆腔广泛分布,并向膀胱壁迁移。膀胱PGL主要起源于膀胱壁内交感神经丛嗜铬细胞,大多数瘤体呈孤立结节状,局限于膀胱黏膜下层和肌间层。目前其病因尚不明确,可能与遗传背景有关,是某些遗传综合征的临床表现之一,包括:多发性内分泌腺肿瘤综合征2A和2B型(MEN2)、神经纤维瘤病Ⅰ型(NF1)、von Hippel Lindau综合征(VHL)和Carney-Stratakis二联征等[2]。在许多病例队列研究中,与PHEO相比,PGL的遗传易感性更为多见。因此,欧洲内分泌学协会2016版PHEO和PGL临床实践指南建议对所有行手术的PGL患者进行基因检测。对最常见的致病性变异,临床上现有标准的基因组合检测有RET、VHL、NF-1、SDHD、SDHC、SDHB、SDHA、SDHAF2、TMEM127和MAX[5]。大多数PGL患者诊断时年龄是20~50岁,而且与颈部和颅底PGL患者相比,膀胱PGL就诊时的年龄更小。遗传性PGL患者往往比散发性患者早近10年发病。本研究12例患者中,年龄最小的仅13岁,中位年龄48岁。但受限于患者经济状况或接诊医师的诊疗意识,所有患者均未进行基因检测。事实上,在膀胱PGL患者诊治过程中,应用基因检测技术可帮助估计肿瘤复发的概率,确定相关综合征表现的随访流程,以及指导患者及其家属进行遗传咨询。因此,期望未来基因检测技术能更好应用于PGL的诊治。
由于膀胱PGL的发病率比尿路上皮癌等疾病低,泌尿外科医师在处理膀胱占位性病变时,难以将其列入鉴别诊断,造成误诊。术前正确识别PGL是十分重要的,否则术中可造成严重的高血压危象,大大增加了围手术期病死率[6]。本研究中病例4术前无血压升高和排尿时晕厥、心悸、头痛等临床表现,以及阳性家族史,影像学检查亦缺少典型改变,因此误诊为膀胱尿路上皮肿瘤,缺少充分术前准备,导致经尿道膀胱电切术中血压波动较大、术后血压持续偏低。
膀胱PGL的诊断主要依赖于临床表现、生化检验、影像学和组织学检查,排尿时晕厥是儿茶酚胺分泌型膀胱PGL的临床标志,若具备高血压、血尿和排尿排便时有症状的三联征,基本可以诊断该病(如本研究中病例2和病例3)。但某些患者仅表现为无痛性血尿(如本研究中病例1)[7]。膀胱PGL的生化检查是测定血浆和/或尿液中分馏的儿茶酚胺和甲氧基肾上腺素类物质。儿茶酚胺在瘤细胞内代谢为甲氧基肾上腺素类物质,这一过程是持续性的,与儿茶酚胺的释放无关,因此甲氧基肾上腺素类物质的诊断敏感性相对更高[8]。由于膀胱PGL可能合并PHEO,即使患者未表现出儿茶酚胺过度分泌的临床特征,亦应对患者在排尿前后分别进行生化检查,以提高检测的准确性。一旦定性诊断成立,就应行CT、MRI,以及核素成像检查进行定位和肿瘤分期[9]。膀胱PGL的典型CT表现是:平扫时表现为亨氏单位40~50的均质肿块,注射静脉造影剂后呈明显强化且廓清延迟;肿块内常见囊性改变、坏死和钙化。但CT对膀胱PGL的特异性稍差,一些膀胱尿路上皮癌在增强CT上也呈现不同程度的强化,难以与PGL相鉴别[10]。MRI对软组织的分辨率较高,在检测较小的膀胱PGL进行局部分期时,多参数MRI优于CT检查。T1加权像上,PGL呈现相当于逼尿肌的均匀中等强度信号,伴散在的空白信号区域,代表血流丰富的血管;T2加权像上,大部分肿瘤呈现相对于逼尿肌的富血供高信号表现,有典型的“盐和胡椒”样外观。DWI为高强度信号,DWI降低代表低分期肿瘤;ADC为低强度信号,ADC降低代表更高级别的肿瘤[11]。此外,间碘苄胍(metaiodobenzylguanidine,MIBG)显像、生长抑素受体显像、PET显像等功能影像学检查亦可应用于膀胱PGL的鉴别诊断和发现转移灶等[12]。通过完善的生化和影像学检查,通常可在术前推定诊断膀胱PGL,但无论瘤体是否具有功能性,确诊仍需要组织病理学评估。
膀胱PGL手术方式包括经尿道电切术、膀胱部分切除术和根治性膀胱切除术。本研究中,12例患者有8例行膀胱部分切除术,2例行根治性膀胱切除术,72.7%的患者在中位随访41个月时无复发。虽然多项研究显示该种技术的有效性,但仍缺乏证据证明保膀胱术(经尿道电切和膀胱部分切除)与根治性膀胱切除术控制疾病进展的效果等是否相同,亦缺乏确定各种术式的适应证。
膀胱PGL是从膀胱壁交感神经丛发展而来,其范围和侵袭深度较难预测,而且瘤体在受到破坏性操作时释放儿茶酚胺的风险更高,因此经尿道电切术在临床上并不常用。本研究中2例选择经尿道电切术治疗的患者术前均未考虑膀胱PGL。由于根治性膀胱切除术后与尿流改道相关的并发症风险、生活方式巨大改变,以及尚且缺乏强有力的证据支持其优于保膀胱治疗,只有在膀胱部分切除术无法实现清除所有局部病灶时才选择根治性膀胱切除术[13]。
综上所述,原发性膀胱PGL临床少见,对有特异性临床表现的患者应及时完善生化、影像学和膀胱镜检查以尽快诊断。对无明显症状的膀胱占位性病变也应将PGL列入鉴别诊断。考虑到膀胱PGL的不同表现和不确定的恶性潜能,个体化的风险分层的方法是必要的。对无远处转移和严重并发症的患者,膀胱部分切除术及术后密切随访能有效提升疾病控制率;对于不可切除的病灶,要结合患者的症状、并发症风险等因素,以延长生存时间、提高生活质量为目的,为其制定个体化综合方案。
