颈动脉内膜剥脱术围术期并发症的影响因素分析
2023-08-12崔松岭吴世勇刘时标郭学利
崔松岭 吴世勇 刘时标 郭学利
郑州大学第一附属医院血管外科 郑州 450052
脑卒中是成人致死、致残的首位病因,其中缺血性脑卒中占85%左右[1]。我国缺血性卒中发病率约为145/10万人,且呈逐年上升及年轻化趋势[2]。25%~30%的颈动脉狭窄与缺血性脑卒中密切相关。颈动脉内膜剥脱术(carotid endarterectomy,CEA)是治疗颈动脉狭窄的重要措施,对于狭窄程度为50%~99%的有症状的低手术风险患者和狭窄程度在70%~99%的无症状患者,CEA被推荐作为一线治疗方案[3]。但术后并发症不仅严重影响患者的生活质量,也限制了CEA的临床应用。本研究以颈动脉狭窄行CEA的患者为研究对象,探讨围手术期相关并发症的影响因素,现报道如下。
1 资料与方法
1.1研究对象回顾性分析2022-03—2022-09于我院血管外科行CEA的110例颈动脉狭窄患者的资料。纳入标准:(1)年龄≥40岁。(2)符合颈动脉粥样硬化性狭窄的诊断标准。(3)符合手术指征并行CEA治疗。排除标准:(1)颈部放疗、颈动脉璞等所致的非动脉硬化性狭窄。(2)同期接受其他手术治疗者。(3)病历资料不完整。最终纳入110例患者,男 92 例,女 18例,年龄63.85岁(范围:43~89岁)。根据围术期是否出现并发症分为并发症组和无并发症组。
1.2方法术前完善血常规、凝血功能、肝肾功能、电解质、血脂分析、头颈部CTA、颈部血管超声等相关检查。服用抗血小板药物及他汀类降脂药物。监测并稳定术前血压,根据影像学结果及术中情况选择传统或外翻式CEA。阻断颈动脉前按1 mg/kg剂量静脉注入肝素并适当提升血压。术中常规监测脑氧及动脉血压。根据术前影像学结果及术中评估决定是否使用转流管及血管补片。仔细冲洗动脉管腔,开放颈动脉前静脉给予甘露醇降低脑颅压,常规放置引流管。开放后维持血压低于基础血压的10%~20%,观察患者的意识、四肢活动和相关并发症情况。术后第1~3 天复查血常规、凝血功能、肝肾功能等,术后1周时复查颈部超声或头颈联合CTA,如出现并发症则行相关检查及治疗。
1.3信息采集(1)基线资料:年龄、性别、BMI。(2)并存疾病:高脂血症、高血压、冠心病、糖尿病、脑血管疾病、外周血管疾病、慢性肾功能不全等。(3)影像学资料:手术部位、狭窄程度、是否合并对侧颈动脉狭窄。(4)实验室资料:血常规、凝血功能、肝肾功能、血脂、血糖。(5)术中情况:手术时间、手术方式、颈动脉阻断时间,是否使用转流管、是否使用补片。(6)术后并发症:脑卒中、心血管事件、脑过度灌注综合征、神经损伤、颈部血肿、感染、死亡等。
2 结果
2.1CEA围术期并发症分布情况110例行CEA的颈动脉狭窄患者中, 42例(38.2%)围术期出现不同程度的并发症,其中10例同时合并2种及以上并发症。 总并发症42例,其中神经损伤23例,过度灌注综合征8例,颈部血肿4例,脑卒中6例(脑梗死5例、脑出血1例),心肌梗死2例,颈动脉血栓形成2例,其他并发症10例(肝肾功能损伤6例、肺部感染4例)。术后预后不良者7例,其中偏瘫3例、死亡4例。
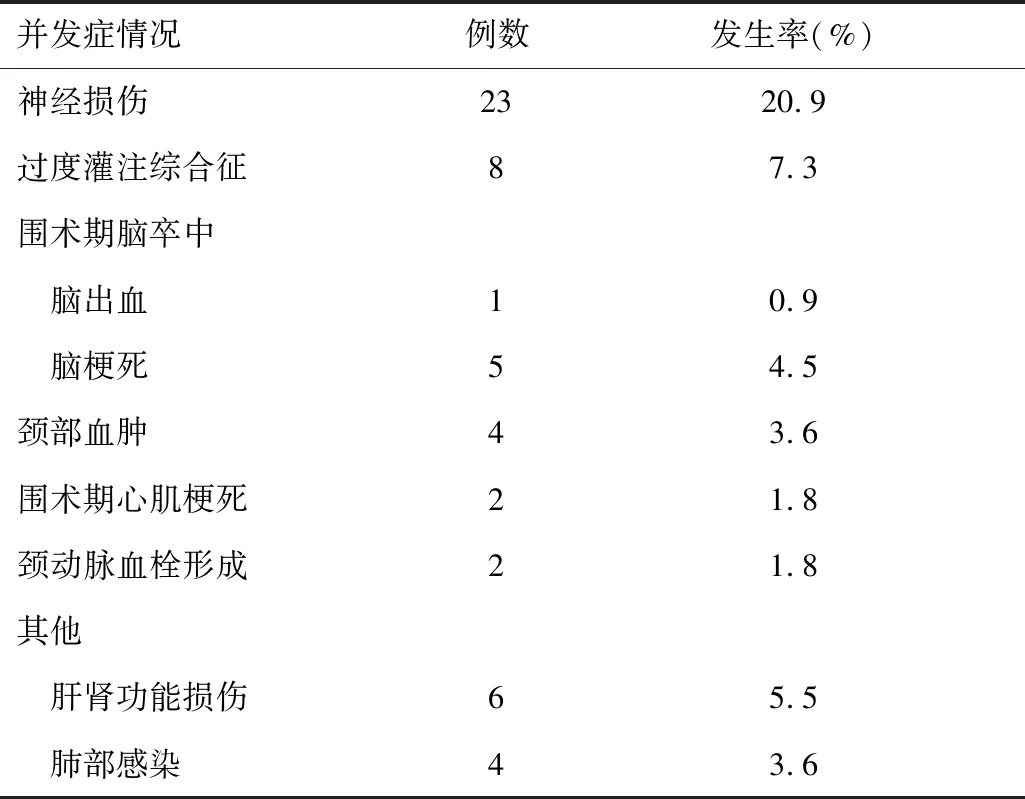
表1 110例CEA患者围术期并发症分布情况
2.2CEA围术期并发症的单因素分析单因素分析结果显示:大脑前动脉重度狭窄/闭塞、使用补片为CEA围术期并发症的影响因素。差异有统计学意义(P<0.05)。
2.3CEA围术期并发症的多因素分析以是否出现并发症为因变量,以是否合并大脑前动脉重度狭窄、是否使用补片等因素为自变量,进行二分类Logistic回归分析。结果显示:大脑前动脉重度狭窄/闭塞、使用补片为CEA围术期发生并发症的危险因素。

表2 110例CEA患者围术期并发症的单因素分析
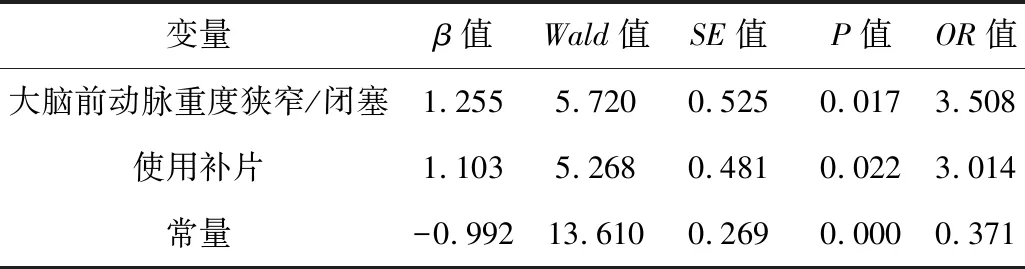
表3 110例CEA患者围术期并发症的多因素分析
3 讨论
脑过度灌注综合征(cerebral hyperperfusion syndrome,CHS)是CEA后的严重并发症,总发生率为0%~3%[4],亦有报道可达14%[5]。一般在术后第1~4天出现症状,以同侧头痛、高血压、癫痫发作,以及局灶性神经功能缺损为特征。本研究中,CHS的发病率为7.3%,以头痛及精神障碍为主要症状,在术后数小时至数天内发生,均伴有血压明显升高,部分患者收缩压甚至高达200 mmHg。
围术期脑卒中是指术后30 d内发生的缺血性脑卒中和出血性脑卒中,多发生在术侧,主要为缺血性脑卒中及前循环卒中,是CEA围术期的主要死因[6-7]。一项荟萃分析报告显示,围术期脑卒中的发生率约为2.15%,而与其相关的死亡风险较无卒中患者增加约40倍[8]。另一项研究显示,围术期卒中/病死率高达7%[9]。对此,指南要求有症状患者预期围术期卒中/病死率应<6%,无症状患者应<3%[10]。颅内出血(intracranial hemorrhage, ICH)即出血性脑卒中,是CHS的最严重后果,一项大型研究报道显示,CEA术后ICH的发病率为0.42%,180 d内的病死率高达43.3%[11]。本研究发生1例(0.9%),症状出现于术后第5天,表现为手术对侧肢体偏瘫,血压明显升高,影像学检查提示术侧基底节区脑出血。CHS的病理生理机制可能为脑血管自动调节机制、压力感受器、三叉神经血管反射受损等[4]。多数CHS患者经颅多普勒超声(transcranial doppler,TCD)测量,大脑中动脉的脑血流速度显著升高,通常可增加150%~300%[5]。因为大脑中动脉的直径不会因自动调节而改变,所以血流速度的变化可反映大脑的灌注状态。通过TCD测量术后大脑中动脉血流量变化,是预防及检测CHS的一项简便且实用的手段。CHS的发生与高血压关系密切,有文献认为,收缩压>180 mmHg可反映颅内的高灌注状态,因其存在于81%的CHS患者[12]。控制血压是防治CHS的首要措施,但应避免使用硝酸盐类和钙通道阻滞剂等具有脑血管扩张作用的降压药物,因其可加重脑水肿而加重患者的头痛等症状[13]。依达拉奉可通过抑制脂质过氧化和血管内皮细胞损伤、改善脑水肿和组织损伤等多种机制,可用于CHS的治疗。甘露醇和皮质类固醇等减轻脑水肿的药物在临床中也广泛应用。缺血性脑卒中较为常见,本研究共发生5例(4.5%),症状出现于术后2 h~5 d,其中死亡2例、偏瘫2例。围术期脑卒中的发生与术中脑灌注不足、术中斑块脱落栓塞、术后血栓形成等密切相关。转流管尽管可以改善术中脑灌注情况,但也增加了斑块脱落、血栓形成、动脉夹层等相关并发症的风险,并不推荐常规放置转流管以预防围术期脑卒中。指南推荐的转流管放置指征包括:(1)对侧颈内动脉完全闭塞。(2)颈动脉反流压<50 mmHg。(3)术中不能耐受颈动脉阻断试验者。(4)术中经颅TCD检查显示大脑中动脉血流减少者。(5)通过术中脑电图或体感诱发脑电监测可能出现脑缺血者。(6)颅内Willis环代偿不全者。(7)既往有过大卒中行CEA者[10]。术中脑电图、体感诱发电位和经颅TCD监测都是可靠的脑灌注评估工具,可用于预测围术期脑卒中的发生风险[14]。非同侧脑卒中的发生率约为0.6%,可能与对侧颈动脉的狭窄和闭塞有关[15]。围术期脑卒中的预防措施包括:阻断颈动脉前将血压提升20 mmHg;术中仔细剥离和冲洗;围术期抗血小板治疗及抗凝治疗等。
颅神经损伤(cranial nerve injury, CNI)是CEA术后常见的并发症,发生率为3%~27%,以迷走神经、舌下神经、面神经下颌缘支损伤较多见,舌咽神经等损伤罕见;大多由于术中过度牵拉所致,通常在术后6~12个月内恢复,舌咽神经的恢复率最高,迷走神经的恢复率最低[16]。约8%的CNI是持续性的[17]。本研究中共出现CNI 23例(20.9%),其中舌下神经损伤15例,面神经损伤10例,迷走神经损伤1例;3例患者同时合并舌下神经及面神经损伤。一项解剖学研究发现,颈动脉分叉处存在与舌下神经交叉的小静脉与术后舌下神经损伤密切相关[18],提示解剖学变异与神经损伤的相关性。有报道称围术期使用地塞米松可以减少CEA期间一过性CNI的发生率,但不会减少永久性CNI的发病率[19]。
颈部血肿是CEA术后危重的并发症,发病率为5.5%[20]。血肿压迫气管可引起呼吸困难或窒息,大多需再次手术清除血肿,部分危重患者需行气管切开术以挽救生命。再次手术的后果很严重,心肌梗死、脑卒中的发生率和病死率明显升高[21]。本研究共出现颈部血肿4例,发生在术后第1~6天。4例患者均行急诊血肿清除术,3例患者预后良好,1例术后合并急性肾衰竭、肺部感染、呼吸衰竭,行气管切开术,最终死亡。术前使用氯吡格雷、术后未使用鱼精蛋白与颈部血肿的高风险相关[22]。鱼精蛋白是肝素的特异性拮抗剂,可用于逆转术中肝素化。一项研究表明,使用鱼精蛋白可使严重出血事件减少50%,并且不会增加心肌梗死、脑卒中的发生率或围术期病死率[21]。术中严密缝合颈动脉、充分止血,可减少颈部血肿的发生率。
本研究统计得到的与并发症发生相关的危险因素,大脑前动脉狭窄/闭塞与前循环脑卒中的高发生率较一致。因此加强术前影像学评估可有助于识别高风险人群;而补片的影响似乎与目前的研究相悖,原因是本研究使用补片的病例较少。仍需后续多中心、大样本量数据的研究。
综上所述,尽管CEA有较高的围术期并发症发生率,但大部分并发症是一过性的,因此,CEA仍是一种安全的手术方式。预防围术期脑卒中、颈部血肿等严重并发症,对降低术后伤残/病死率具有重要意义。
