阿卡波糖口服固体制剂的质量情况分析与评价
2023-08-12石笑弋彭飞城李昌亮李帅刘雁鸣兰文易必新
石笑弋,彭飞城,李昌亮,李帅,刘雁鸣,兰文,易必新
(1.湖南省药品检验检测研究院,湖南长沙 410001;2.国家药品监督管理局药用辅料工程技术研究重点实验室,湖南长沙 410001;3.湖南省药品质量评价工程技术研究中心,湖南长沙 410001;4.湖南省药品审核查验中心,湖南长沙 410001)
阿卡波糖是一种口服降血糖药,多用于Ⅱ型糖尿病的治疗及控制餐后血糖的升高,严重不良反应为低血糖。阿卡波糖片由德国拜耳公司研制,1988 年在比利时获批上市[1-4]。目前国内上市剂型有片剂和胶囊剂2 个剂型,规格有50 mg 和100 mg。1994 年原研阿卡波糖片获批进口中国,原研地产化阿卡波糖片分别于1999 年和2001 年获批上市。2002 年国内G公司的胶囊和片剂获批上市,并于2019 年5 月通过了50 mg 规格制剂的一致性评价[5-8]。
阿卡波糖原料在《中华人民共和国药典》《欧洲药典》《英国药典》和《美国药典》均有收载。阿卡波糖胶囊在国外药典中均未收载,国产样品现行质量标准为《中华人民共和国药典》2020 年版二部。阿卡波糖片在《美国药典》(2022 年版)中有收载,国产样品现行质量标准有《中华人民共和国药典》2015、2020 年版二部及相应企业注册标准[国家市场监督管理总局YBH02192020(B 公司)、YBH14742020(C公司)、YBH02692019(D 公司)、YBH11712020(E公司)、YBH06432018(A 公司)、YBH06492018(F公司)][9-10]。阿卡波糖口服固体制剂标准之间差异不大,为进一步了解、评价、监测阿卡波糖片、阿卡波糖胶囊的质量,本文对全国市场上收集到的165 批次阿卡波糖口服固体制剂按照法定质量标准进行全项目检验,并对有关物质进行探索性研究,考察了包装材料对样品稳定性的影响,为市场阿卡波糖片、阿卡波糖胶囊的质量评价提供依据。
1 材料与方法
1.1 实验材料
阿卡波糖片和阿卡波糖胶囊样品信息见表1。收集市场上流通的29 个省6 个生产企业8 个批准文号50 mg 与100 mg 规格的131 批阿卡波糖片、17 个省1 个生产企业1 个批准文号50 mg 规格的34 批阿卡波糖胶囊。阿卡波糖片抽自生产企业21 批次(占16.1%)、经营单位103 批次(占78.6%)、医疗机构7批次(占5.3%);阿卡波糖胶囊抽自生产企业4 批次(占11.76%)、经营单位28 批次(占82.35%)、医疗机构2批次(占5.88%)。参比制剂为阿卡波糖片(拜糖平®)[11]。
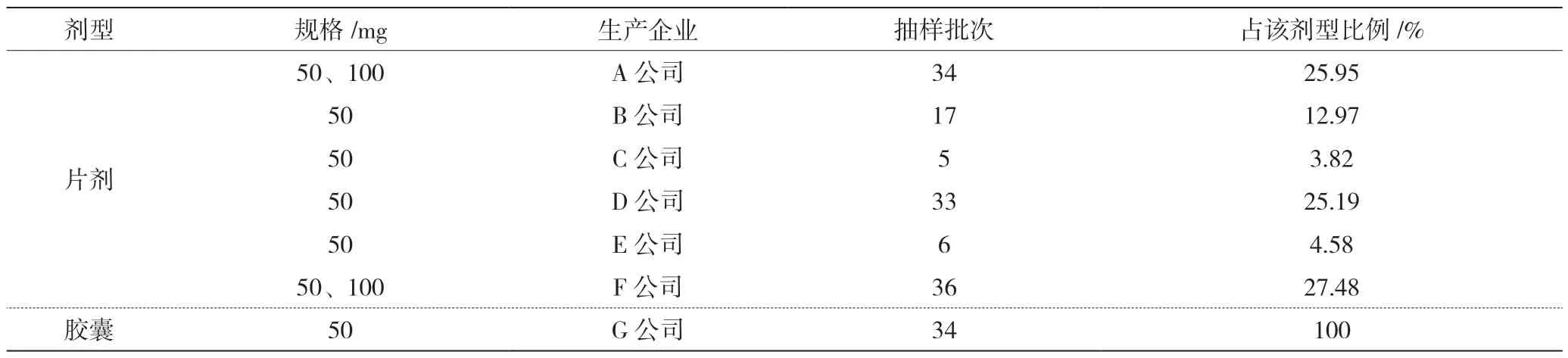
表1 样品信息
1.2 实验试剂
阿卡波糖对照品(100808-201905,中国食品药品检定研究院,99.4%);磷酸二氢钾、无水磷酸氢二钠、氢氧化钠,分纯纯,国药集团化学试剂有限公司;乙腈,HPLC 级,美国Merk 公司;纯水为Thermo Scientific GenPure 超纯水机制备。
1.3 实验仪器
1260 高效液相色谱仪(DAD 检测器),美国Agilent 公司;LD-20AT 高效液相色谱仪,日本岛津公司(PDA 紫外检测器);XP205 电子分析天平(十万分之一),瑞士Mettler Toledo 公司。
1.4 实验方法
1.4.1 有关物质常规检验
1.4.1.1 执行质量标准
F 公司、G 公司执行质量标准为《中华人民共和国药典》2015、2020 年版二部,A 公司、B 公司、C 公司、D 公司、E 公司注册标准分别为YBH06432018、YBH02192020、YBH14742020、YBH02692019、YBH11712020,内容与中国药典2020 年版基本一致。
1.4.1.2 色谱条件
采用氨丙基硅胶键合色谱柱(Thermo Gold Amino,4.6 mm×150 mm,3 μm),流动相为磷酸盐缓冲液(pH 6.4)-乙腈(25 ∶75),流速为2.0 mL/min,检测波长210 nm,柱温35 ~45 ℃。
1.4.1.3 杂质限度
杂质Ⅰ不得超过1.2%、杂质Ⅱ不得超过0.5%、杂质Ⅱ异构体不得超过0.5%(为A 公司特有杂质及限度要求)、杂质Ⅲ不得超过1.5%、杂质Ⅳ不得超过1.0%,其他单个杂质不得超过0.2%、杂质总量不得超过3.0%。
1.4.2 有关物质探索性研究
参考A 公司注册标准(YBH06432018)有关物质色谱方法并采用A 公司方法中系统适用性溶液与E公司的样品加该系统适用性溶液进行主峰与杂质分离度考察。色谱柱:氨丙基硅胶键合色谱柱(Thermo Gold Amino,150 mm×4.6 mm,3 μm);PDA 检测器;检测波长:210 nm;柱温:45 ℃;流速为2.2 mL/min;流动相:磷酸盐缓冲液(磷酸二氢钾2.13 g 与磷酸氢二钠二水合物770 mg,加水至1 000 mL,调至pH 6.4)-乙腈(22 ∶78)。
1.4.3 包装材料对样品稳定性的影响
将7 个公司的样品带包装放置于40 ℃或相对湿度75%的条件下,10 d 后取样检测其性状、有关物质、溶出度及含量情况。其中溶出度及含量情况参考《中华人民共和国药典》2020 年版二部色谱方法。色谱柱:氨丙基硅胶键合色谱柱(Welch /Ultimate XB-NH2,250 mm×4.6 mm,5 μm);PDA 检测器;检测波长:210 nm;柱温:35 ℃;流速:2 mL/min;流动相:磷酸盐缓冲液(磷酸二氢钾0.6 g 与无水磷酸氢二钠0.279 g,加水至1 000 mL)-乙腈(25 ∶75)。
2 结果与分析
2.1 常规检验测定结果
按法定标准检验性状、液相鉴别、有关物质、溶出度、水分(胶囊剂)、重(装)量差异、含量测定等项目,如表2 所示,165 批次样品全部合格,合格率100%。34 批次A 公司样品、17 批次B 公司样品、33 批次C 公司样品、33 批次D 公司样品、6 批次E 公司样品、36 批次F 公司样品、34 批次G 公司样品均符合规定,合格率100%。
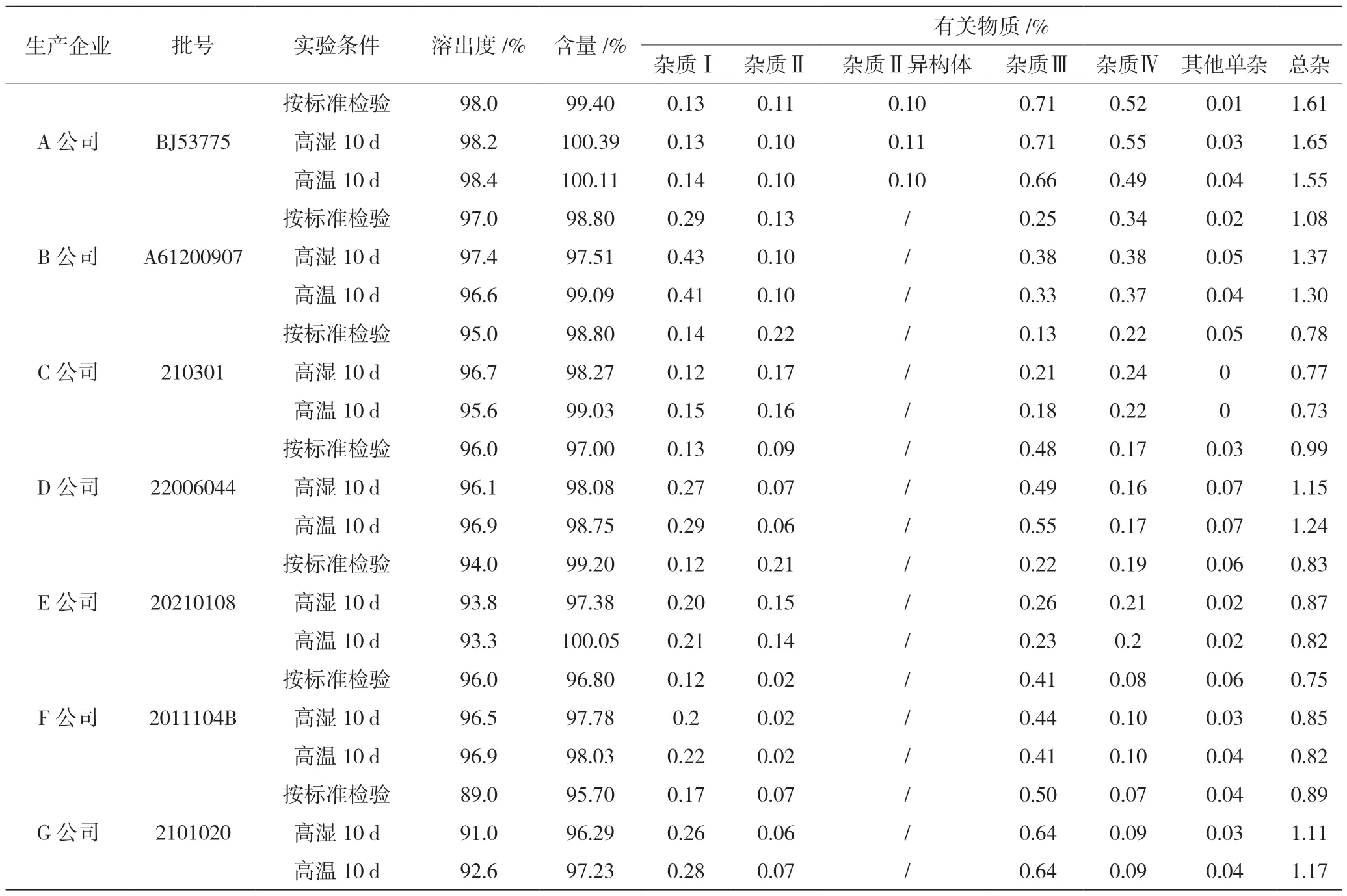
表2 稳定性实验数据
2.2 有关物质探索性研究测定结果
探索性研究有关物质典型HPLC 图,见图1 ~2。7 个公司165 批阿卡波糖片(胶囊)样品,除A 公司外,其他6 个公司的样品均有检出与主峰相对保留时间约为0.75 倍的杂质蜂(即图2 中,保留时间为22.461 min 的峰),且杂质量超出A 公司所采用的标准中规定的“未知杂质量不得超过0.2%”的限度要求。杂质总量最多的为A 公司,最少的为F 公司。杂质Ⅳ在各个公司均有检出,且D 公司、F 公司的检出量最低。杂质Ⅱ每个公司都有检出,其中F 公司的量最少,且批间差异较小。杂质Ⅱ异构体为A 公司特有的杂质,其余公司均无检出。杂质I 每个公司都有检出,其中A 公司的量最少,B 公司的量最大。杂质Ⅲ各个公司均有检出,C 公司的检出量最低。其他未知单杂,各个公司均有检出,且均小于0.1%。杂质总和在0.75%~1.61%,均小于3.0%的限度。与各公司现行质量标准中的方法相比,采用探索性研究中的色谱系统能检测出更多的杂质(杂质情况详见图2),说明现行质量标准未能完全反映出产品中杂质的真实状况。
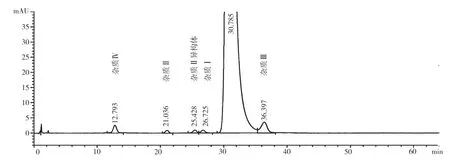
图1 A 公司系统适用性图谱
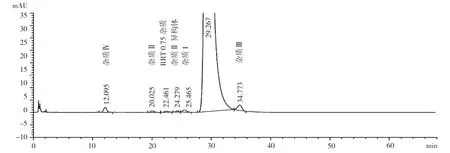
图2 样品加系统适用性样品图谱
2.3 包装材料对样品稳定性研究测定结果
如表2 所示,7 个公司的样品在高温高湿条件下放置10 d 后,各企业样品性状、溶出量、含量均无大变化。各公司样品中无新杂质产生,G 公司、B 公司的样品中杂质Ⅰ与杂质Ⅲ略有增加,C 公司的样品中杂质Ⅲ略有增加,F 公司、D 公司、E 公司的样品中杂质Ⅰ略有增加,A 公司的特有杂质无变化,与特定储藏条件下样品的数据之间无显著差异。特定贮藏条件:片剂企业除E 公司的储藏条件为遮光、密封、在30 ℃以下保存外,其余均为遮光、密封、在25 ℃以下保存。胶囊为遮光、在凉暗处保存,直接接触样品的包装均为铝塑泡罩。除F 公司的有效期为36 个月外,其余有效期均为24 个月;G 公司的胶囊在铝塑泡罩外加套了防潮袋。大部分企业都要求在25 ℃下保存,说明温度对样品的稳定性有较大影响,应注意控制贮藏时的温度。
3 讨论与结论
不同企业的贮藏条件、包装、有效期略有不同。A 公司、B 公司、C 公司、D 公司的保存条件均为遮光、密封,在25 ℃以下保存,E 公司保存条件为遮光、密封,30 ℃以下保存,保存条件比A 公司等宽松;G公司(胶囊)均要求在密封、凉暗处保存,保存条件比A 公司更严苛。从包装材料上看,C 公司与F 公司均采用双铝泡罩包装,成本比其他企业要高,但F 公司的有效期为36 个月,其余均为24 个月,有效期更长;G 公司的大包装样品(60 粒装)在铝塑泡罩外加套了防潮袋。后续拟考察包装材料对样品稳定性的影响。
各企业针对阿卡波糖口服固体制剂的质量标准相差不大,些许差异主要表现在:A 公司标准的有关物质与其余企业不同,A 公司标准的有关物质项目设置非常严谨,对系统适用性,杂质Ⅰ峰和杂质Ⅱ异构体峰、杂质Ⅰ峰和阿卡波糖峰的分离度,理论板数,灵敏度,精密度以及主峰的保留时间等都有详细规定;A 公司还针对特有杂质Ⅱ异构体及与主峰相对保留时间约为0.75 倍的特有杂质进行了控制,其余企业均只控制了杂质Ⅰ、杂质Ⅱ、杂质Ⅲ、杂质Ⅳ 4 个已知杂质。本文参照A 公司的标准对其他企业的样品进行有关物质测定,建立杂质谱,从杂质种类、杂质个数、最大杂质、不同公司样品所含的杂质等方面进行统计分析,从而对其产品质量及生产工艺进行评价,为进一步提高阿卡波糖口服固体制剂质量标准提供实验依据,结果提示应制定相关质量控制标准[12]。
目前市场上阿卡波糖口服制剂质量整体状况较好,通过此次研究分析,认为需要进一步提高和完善阿卡波糖片及阿卡波糖胶囊现行标准。
