左炔诺孕酮宫内缓释系统联合GnRH⁃a 治疗子宫腺肌病临床疗效观察
2023-08-12姜丽张德应于丹军林秀丽金海红张冰
姜丽,张德应,于丹军,林秀丽,金海红,张冰
子宫腺肌病是指子宫内膜(包括腺体和间质)侵入子宫肌层生长而产生的病变[1],好发于生育年龄妇女中,发病率为7%~23%[2]。该病总体呈逐年增加趋势,且发病年龄呈年轻化趋势。主要临床症状包括月经量多、渐进性加重痛经和不孕。子宫切除术可达到根治的目的,但术后会影响患者的卵巢功能[3],对患者身心健康造成影响。随着对子宫腺肌病研究的不断深入,一些新的理念、方法和药物的应用,一定程度上可抑制疾病的发展,有助于保留子宫,尤其是药物的应用。目前治疗该病临床常用的药物主要有非甾体类抗炎药(non‑steroid anti‑inflammatory drugs,NSAIDs)、促性腺激素释放激素激 动 剂(gonadotropin ‑ releasing hormone agonist,GnRH‑a)、复方短效口服避孕药、孕激素类药物以及中医中药等五大类,不同药物均有各自的适应证和局限性。建议年轻、希望保留子宫的患者使用口服避孕药或放置左炔诺孕酮宫内缓释系统((levonorg‑estrel intrauterine sustained release system,LNG ‑IUS)[2],放置LNG‑IUS 虽然安全有效,但不良反应(阴道异常出血、脱环及环下移等)会影响患者的治疗依从性,导致治疗中断,影响治疗效果,甚至还有一部分患者因反复放环而增加治疗成本。本研究旨在探讨理想的联合用药方案,降低单一药物的不良反应率,增强药物的疗效,提高患者的治疗依从性。
1 对象与方法
1.1 研究对象
选取2020 年8 月至2021 年6 月秦皇岛市第一医院收治的60 例子宫腺肌病患者作为研究对象,按数字表法随机将其分为对照组和观察组,每组各30 例。对照组年龄31~48 岁[(39.87 ± 4.42)岁];病程3~10 年[(6.07 ± 2.23)年]。观察组年龄32~45 岁[(39.40 ± 3.00)岁];病程2~9 年[(5.97 ± 1.92)年]。2 组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:已婚妇女;年龄为20~50 岁;符合《妇产科学(第9 版)》中子宫腺肌病诊断标准;子宫增大体积小于孕期12 周大小;卵巢功能正常;无生育要求,要求保守治疗,保留子宫。排除标准:近3 个月使用药物治疗子宫腺肌病;合并肝肾功能异常;既往存在生殖道或乳腺肿瘤病史;合并卵巢囊肿和子宫内膜病变;存在宫内节育器或左炔诺孕酮禁忌证;处于妊娠期或哺乳期;不能配合完成随访。本研究经秦皇岛市第一医院医学伦理委员会批准,患者及家属知情同意。
1.2 治疗方法
观察组:月经第1~5 天皮下注射GnRH‑a(商品名:诺雷德;生产厂家:阿斯利康制药有限公司;国药准字:J20160052)3.6 mg/次,1 次/28 d,连续注射3 次,停药后28 d 内由专业人员严格按照操作指南放置LNG‑IUS(商品名:曼月乐,生产厂家:德国拜耳公司;国药准字:J20140088)。所有放置的LNG‑IUS 均经超声确定位置正常。对照组:月经第5~7 天,由专业人员严格按照操作指南放置LNG‑IUS,所有放置的LNG‑IUS 均经超声确定位置正常。
1.3 观察指标
1.3.1 痛经改善程度 于治疗前和治疗后3 个月、6 个月、12 个月分别评估对照组和观察组患者痛经改善程度,采用视觉模拟评分法(visual ana‑logue scale,VAS)[4]判定痛经程度,即画1 条10 cm长的线段,按0~10 分评估疼痛程度,患者根据自我感觉在该线段上做出标记表示疼痛程度,得分越高表示疼痛越剧烈。
1.3.2 月经量改变情况 于治疗前和治疗后3 个月、6 个月、12 个月分别评估对照组和观察组患者月经量改变情况,采用月经失血图评分(pictorial blood loss assessment chart,PBAC)[5],测定患者月经量。
1.3.3 子宫变化情况 于治疗前和治疗后3 个月、6 个月、12 个月分别评估对照组和观察组患者子宫变化情况:采用阴道超声检测患者子宫体积[6],子宫体积=0.523×长径×前后径×横径。
1.3.4 血清VEGF、PGE2 和CA125 水平 于治疗前和治疗后3 个月、6 个月、12 个月分别评估对照组和观察组患者血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、前 列 腺 素E2(prostaglandin E2,PGE2)和CA125 水平。采集患者清晨空腹静脉血6 ml,将其移到离心管进行离心处理,转速3 500 r/min,离心时间为5 min,然后选取上层血清放置−40 ℃冰箱保存备用,采用酶联免疫吸附剂测定法(ELISA)检测VEGF、PGE2 水平。采用罗氏Cobase602 型全自动免疫化学发光免疫分析仪检测CA125 水平(参考值:0~35 U/ml)。
1.3.5 不良反应 观察分析治疗后3 个月、6 个月、12 个月对照组和观察组患者的不良反应,如阴道异常出血、环下移和脱环等。
1.4 统计学处理
采用SPSS 25.0 统计软件对所得数据进行统计分析,计量资料以±s表示,采用独立样本t检验,组内比较采用配对样本t检验。计数资料以百分比(%)表示,采用χ2检验,组间比较采用重复测量数据方差分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 治疗前后观察组与对照组患者痛经程度比较
治疗前2 组患者痛经程度比较差异无统计学意义(P>0.05)。治疗后3 个月、6 个月、12 个月2 组患者痛经程度较治疗前均有所缓解,差异有统计学意义(P<0.05);且观察组较对照组缓解程度更明显,差异有统计学意义(P<0.05)。见表1。
表1 治疗前后观察组与对照组患者痛经程度比较(分,± s)

表1 治疗前后观察组与对照组患者痛经程度比较(分,± s)
注:与同组治疗前比较aP<0.05,与对照组比较bP<0.05
治疗后12 个月1.00 ± 0.53ab 2.10 ± 0.96a 5.508<0.001组别观察组对照组t 值P 值例数30 30治疗前8.13 ± 0.86 8.13 ± 0.90 2.009 1.000治疗后3 个月1.40 ± 0.93ab 2.73 ± 1.11a 5.033<0.001治疗后6 个月0.67 ± 0.76ab 2.4 ± 0.89a 8.097<0.001
2.2 治疗前后观察组与对照组患者月经量比较
治疗前2 组患者月经量比较差异无统计学意义(P>0.05)。治疗后3 个月、6 个月、12 个月2 组患者月经量低于治疗前,差异有统计学意义(P<0.05),且观察组降低幅度更大,差异有统计学意义(P<0.05)。见表2。
表2 治疗前后观察组与对照组患者月经量比较(ml,± s)
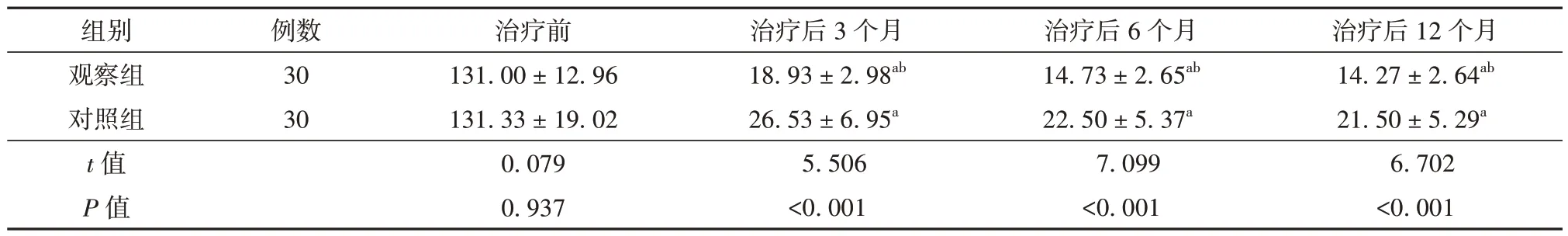
表2 治疗前后观察组与对照组患者月经量比较(ml,± s)
注:与同组治疗前比较aP<0.05,与对照组比较bP<0.05
治疗后12 个月14.27 ± 2.64ab 21.50 ± 5.29a 6.702<0.001组别观察组对照组t 值P 值例数30 30治疗前131.00 ± 12.96 131.33 ± 19.02 0.079 0.937治疗后3 个月18.93 ± 2.98ab 26.53 ± 6.95a 5.506<0.001治疗后6 个月14.73 ± 2.65ab 22.50 ± 5.37a 7.099<0.001
2.3 治疗前后观察组与对照组患者子宫体积比较
治疗前2 组患者子宫体积比较差异无统计学意义(P>0.05)。治疗后3 个月、6 个月、12 个月2 组患者子宫体积均小于治疗前,差异有统计学意义(P<0.05),且观察组患者子宫体积缩小程度更明显,差异有统计学意义(P<0.05)。见表3。
表3 治疗前后观察组与对照组患者子宫体积比较(cm3,± s)

表3 治疗前后观察组与对照组患者子宫体积比较(cm3,± s)
注:与同组治疗前比较aP<0.05,与对照组比较bP<0.05
治疗后12 个月157.92 ± 27.92ab 175.33 ± 35.28a 2.120 0.038组别观察组对照组t 值P 值例数30 30治疗前258.43 ± 45.41 243.33 ± 42.76−1.326 0.190治疗后3 个月126.21 ± 31.00ab 193.44 ± 28.78a 8.704<0.001治疗后6 个月172.61 ± 27.76ab 191.26 ± 24.43a 2.763 0.008
2.4 治疗前后观察组与对照组患者血清VGEF、PGE2 和CA125 水平比较
治疗前2 组患者血清VEGF、PGE2 和CA125水平比较差异无统计学意义(P>0.05)。治疗后3 个月、6 个月、12 个月2 组患者血清VEGF、PGE2 和CA125 水平较治疗前均有所下降,差异有统计学意义(P<0.05);且观察组患者下降得更明显,差异有统计学意义(P<0.05)。见表4。
表4 观察组与对照组患者治疗前后血清VEGF、PGE2 和CA125 水平比较(± s,每组n=30)

表4 观察组与对照组患者治疗前后血清VEGF、PGE2 和CA125 水平比较(± s,每组n=30)
注:与同组治疗前比较aP<0.05;与对照组比较bP<0.05。VEGF 为血管内皮生长因子,PGE2 为前列腺素E2
CA125(U/ml)201.96 ± 27.94 144.65 ± 26.55ab 105.08 ± 24.20ab 68.75 ± 11.13ab 204.41 ± 17.17 166.8 ± 26.21a 115.23 ± 21.91a 78.38 ± 9.91a组别观察组对照组时间治疗前治疗后3 个月治疗后6 个月治疗后12 个月治疗前治疗后3 个月治疗后6 个月治疗后12 个月VEGF(ng/L)155.85 ± 21.07 121.08 ± 15.94ab 87.56 ± 15.09ab 69.99 ± 12.92ab 165.69 ± 25.58 126.69 ± 19.78a 114.73 ± 16.08a 89.03 ± 13.41a PGE2(pg/ml)274.03 ± 19.44 190.45 ± 17.44ab 179.89 ± 17.08ab 170.38 ± 17.14ab 274.25 ± 20.28 214.89 ± 20.18a 205.52 ± 20.22a 185.69 ± 29.25a
2.5 观察组与对照组患者治疗期间不良反应比较
观察组患者总不良反应发生率为13.33%,低于对照组的50.00%,2 组比较差异有统计学意义(P<0.05)。见表5。

表5 观察组与对照组患者治疗期间不良反应比较[例(%)]
3 讨论
子宫腺肌病是一种慢性疾病,具体病因不清,临床症状明显,主要表现为月经量过多和痛经,严重影响患者的生活质量,而患者多为育龄期女性,影响其长达数年至数十年时间。因此,选用长期安全有效的治疗方法,是临床亟待解决的问题。
LNG‑IUS 是一种新型宫内激素避孕系统,置入后每天向宫腔持续低剂量释放左炔诺孕酮,一般持续5 年,可调节子宫内膜的雌、孕激素受体的表达,使异位内膜病灶萎缩和蜕膜化,缓解痛经症状,导致月经量减少甚至闭经,而不影响卵巢功能[7]。循证医学资料显示,LNG‑IUS 对治疗月经过多和痛经有效[8]。但既往研究显示,子宫腺肌病单纯应用LNG‑IUS 治疗存在一些不足,如放置该系统后阴道发生点滴出血,6 个月内发生率可高达58.3%[9-10];如子宫腺肌病患者的宫腔增大、变形,合并月经过多,LNG‑IUS 使用后的脱落和环下移较为常见[11],尤其是子宫增大大于孕期12 周大小时,脱环率可高达37.5%,其中75%的脱落和取出发生在置入后12 个月内,33.3%的取出是因环下移或嵌顿[12]。以上均会影响患者对治疗的满意度和信心,不利于临床推广应用。
GnRH‑a 通过干扰下丘脑‑垂体‑性腺轴,抑制黄体生成素和卵泡激素的分泌,从而抑制卵巢分泌雌激素和孕激素,引起暂时性闭经,明显缩小子宫体积,减少出血和缓解痛经。研究表明,GnRH‑a 对缓解子宫腺肌病相关的疼痛和治疗月经量过多疗效确切,并能有效缩小子宫体积[13]。由于对性激素的强烈抑制,长期应用GnRH‑a 会出现骨量丢失和围绝经期症状等不良反应,故对于子宫腺肌病患者长期应用GnRH‑a 治疗尚未获得临床指南推荐,建议疗程不超过6 个月,但一旦停药会出现复发的情况。
基于药物单独使用的局限性,临床上提出联合用药,以达到最佳的治疗效果及减少不良反应。同时,由于临床上对子宫腺肌病病情程度的判断多数基于月经量、痛经程度等主观指标,缺乏客观、统一的标准。因此,本研究设计观察GnRH‑a 应用3 个月后宫内置入LNG‑IUS 对比单用LNG‑IUS,并通过客观动态监测CA125、VEGF、PGE2 血清学指标,评估治疗效果。
异位子宫内膜会大量分泌CA125,使CA125 水平大幅升高[14]。异位子宫内膜血浆中的VEGF 含量呈现上调现象,而高水平的VEGF 能够促进血管的增生,为异位内膜在子宫肌层的生长提供条件,促进其浸润与增殖,进而扩大病灶范围[15-16]。异位子宫内膜血浆中PGE2 水平会升高,并与患者的痛经强度呈正相关[17-18]。
本研究结果显示,观察组患者在缓解痛经、减少经血量、缩小子宫体积、血清学指标下降(包括CA125、VEGF、PGE2)等方面明显优于对照组,差异有统计学意义。同时脱环、环下移及阴道异常出血等不良反应明显减少。
综上所述,LNG‑IUS 联合GnRH‑a 治疗子宫腺肌病疗效显著,且降低LNG‑IUS 治疗后不良反应发生率,值得在临床治疗上进一步推广和应用。
本研究仍存在不足之处,如样本数量较小,在后期研究中应当增加样本数量,使结果更加详细、准确,为临床治疗提供更加可靠的依据。
