基于转录组学的多组学分析腐败希瓦氏菌冷适应的机制
2023-08-12高鑫李博刘小杰
高鑫,李博*,刘小杰*
(1.上海城建职业学院,上海 201415;2.上海教育教学创新团队,上海 201415)
冷藏水产品的特定腐败菌种(spoilage organism,SSOs)可以在低温下对水产品中的蛋白质进行降解,并生成腐胺、尸胺和H2S 等异味物质,形成生物膜导致水产品表面发黏等[1-2],造成水产品在低温运输与贮藏过程中的腐败,从而影响感官。在冷藏水产品中,绝大部分微生物生长缓慢甚至停滞,但腐败希瓦氏菌(Shewanella putrefaciens)能够在低温下长期存活并繁殖,形成特定腐败菌种(SSOs)[3]。农产品流通产业发展报告显示,2022 年我国海水产品流通损耗率高达10%。因此,深入探究S.putrefaciens 的冷适应机制对于延长冷藏水产品货架期具有重要意义。
转录组学可从RNA 水平上阐述宿主或环境对原核生物影响而产生的基因转录应答变化,细菌通过表达单组分感应转录因子或双组分系统感受胞外信号,激活相关的转录因子,并使下游的转运蛋白和酶在基础水平上增强或减弱表达,增加代谢途径中间体的产生,进而进入各个代谢途径调控细胞物质和能量的分配。例如,通过RNA-seq 分析发现,低温导致柑橘黄龙病菌(Xanthomonas citripv.Citri,Xcc)的Ⅳ型菌毛状突系统及发病机制相关的基因表达产生差异性变化,这是Xcc 对冷应激的重要细胞适应反应[4]。目前已有很多研究表明,细胞壁组分合成基因[5]、细菌趋化性相关基因[6]和群体感应相关基因[7]等的表达对S.putrefaciens 在低温冷适应方面具有重要的贡献。基于转录组学数据进行多组学关联分析,能够深层次挖掘大量数据,已经成为阐述生物应答机制的重要手段[8-11]。
本研究利用多组学联合分析的手段,探究低温下S.putrefaciens 在不同基因表达层面的适应性变化,以期探索脂肪酸代谢和能量代谢通路对促进腐败希瓦氏菌冷适应的作用及机理,并深入探讨S.putrefaciens在低温下的代谢改变和调控机理,为低温水产品的储运提供理论依据。
1 材料和方法
1.1 材料与试剂
S.putrefaciens ATCC8071:上海海洋大学食品学院实验室保藏;琼脂粉、氯化钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(均为分析纯):生工生物工程股份有限公司;胰蛋白胨、酵母提取物、胰蛋白胨大豆肉汤(tryptone soya broth,TSB)、RNase/DNase free八连管:赛默飞世尔科技公司;罗氏荧光定量试剂盒:上海罗氏制药有限公司;逆转录试剂盒:上海普洛麦格生物产品有限公司、DNA 酶活:德润诚生物科技有限公司;荧光染料:上海翊圣生物技术有限公司;DNA marker DL2000/5000:宝日医生物技术有限公司;三羟甲基氨基甲烷:北京德尔曼生物科技有限责任公司;溶菌酶(≥20 000 U/mg):BBI 生命科学有限公司;Promega Eastep Super 总RNA 提取试剂盒:上海普洛麦格生物产品有限公司。
1.2 仪器与设备
荧光定量基因扩增仪(StepOnePlusTM)、超净工作台(YJ):赛默飞世尔科技公司;冰箱(4、-20 ℃和-80 ℃):海尔集团公司;摇床(ZHTY-70):上海知楚仪器有限公司;恒温培养箱(GZP-450):上海精宏实验设备有限公司、聚合酶链式反应仪(MastercyclerRX50):艾本德国际贸易有限公司。
1.3 方法
1.3.1 S.putrefaciens 的培养
将低温冻存的S.putrefaciens 活化于无抗大豆胨琼脂(tryptic soytone agar,TSA)培养基上,30 ℃培养过夜,次日取单菌落接种于胰蛋白胨大豆肉汤(tryptic soy broth,TSB)液体培养基中,200 r/min、30 ℃振荡培养16 h,取500 μL 菌液再次接种于35 mL TSB 液体培养基中,继续振荡培养至适当OD600并进行后续试验。
1.3.2 S.putrefaciens 总RNA 的提取
培养过夜的S.putrefaciens 转接到新鲜TSB 液体培养基中生长16 h 后,分别将细菌转入4 ℃和30 ℃继续恒温培养48 h,并用总RNA 提取试剂盒提取总RNA,总RNA 保存于-80 ℃超低温冰箱。
1.3.3 逆转录与实时荧光定量多聚核苷酸链式反应(real time quantitative polymerose chain reaction,RTqPCR)
参考检测试剂盒说明书进行试验,引物设计见表1。
对全部107个实验样本进行实验分析,统计107个实验样本平均50 km行程中不同因素出现的频数如表2所示:

表1 RT-qPCR 引物Table 1 Primers of RT-qPCR
1.3.4 转录组测序分析
过夜培养的菌液取500 μL 转接入35 mL 新鲜的TSB 液体培养基内,30 ℃振荡培养至OD600=0.4,取1 mL菌液分别置于4 ℃(样品编号记为E)和30 ℃(样品编号记为A)下继续培养48 h,提取总RNA。进行转录组测序(transcriptome sequencing,RNA-seq),分析方法采用DESeq2,筛选标准为|log2FoldChange|>0(log2Fold-Change 是一种表达量变化比率,可以用来比较不同表达量水平的数据之间的相对变化)和padj<0.05(padj为统计学差异显著性检验指标)。
1.4 数据统计分析
所有数据使用Prism 8 软件,分别采用t-test、Oneway ANOVA 和Two-way ANOVA 进行分析,数据均使用平均值±标准差表示,当p<0.05 时,表明数据具有显著性差异。
1.5 多组学联合分析
对处于低温培养的S.putrefaciens 脂质组学、蛋白组学和转录组学数据进行了多组学相关性分析、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析及相关性网络分析,数据采用spearman 算法进行相关性计算,以相关系数绝对值>0.9 和p<0.05 作为筛选显著性相关的阈值标准进行高通量数据两两联合分析。
2 结果与分析
2.1 低温条件影响S.putrefaciens 脂肪酸代谢和能量代谢通路相关基因的表达
4 ℃和30 ℃下S.putrefaciens 表达基因的韦恩图见图1。
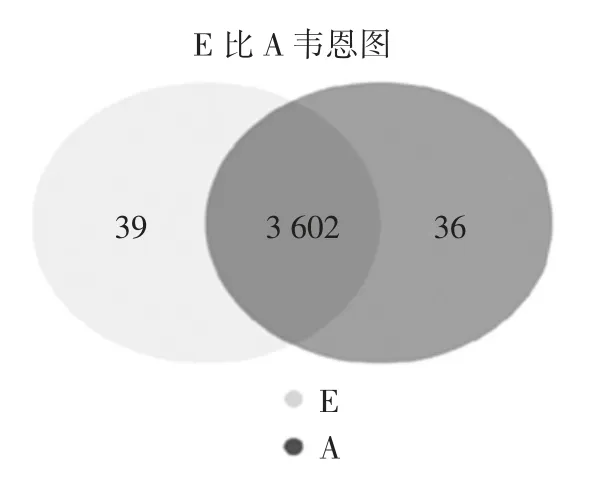
图1 4 ℃和30 ℃下S.putrefaciens 表达基因的韦恩图Fig.1 Venn diagram of S.putrefaciens expression genes at 4 ℃and 30 ℃
由图1 可知,S.putrefaciens 只在4 ℃和只在30 ℃表达的基因分别有39 个和36 个,而有3 602 个基因在两种条件下均表达。进一步比较4 ℃和30 ℃下的基因表达差异,结果显示,4 ℃下生长的S.putrefaciens 相较于30 ℃共有2 142 个基因具有显著性差异,其中上调和下调的基因分别有1 066 个和1 074 个。
RNA-seq 关键基因的RT-qPCR 验证见图2。

图2 RNA-seq 关键基因的RT-qPCR 验证Fig.2 Verification of RNA-seq by RT-qPCR
4 ℃和30 ℃下S.putrefaciens 脂肪酸代谢和能量代谢差异基因所在的KEGG 通路见表2。

表2 4 ℃和30 ℃下S.putrefaciens 脂肪酸代谢和能量代谢差异基因所在的KEGG 通路Table 2 The different genes of fatty acid metabolism and energy metabolism in S.putrefaciens at 4 ℃and 30 ℃strains according to KEGG pathway
由表2 可知,这些共同表达的差异基因在脂肪酸代谢及能量代谢相关通路富集较多,其中脂肪酸合成、代谢和降解的基因占富集基因总数的41.5%,三羧酸循环(tricarboxylic acid cycle,TCA cycle)占16%,氧化磷酸化占23.6%,糖酵解/糖异生占18.9%,结果表明:与脂质和能量代谢相关的通路在低温下可能与S.putrefaciens 的冷适应有密切联系。
2.2 低温影响S.putrefaciens 脂肪酸代谢基因的表达
S.putrefaciens 低温下与脂肪酸代谢相关基因表达情况见表3。S.putrefaciens 低温下与甘油酯代谢相关基因表达情况见表4。
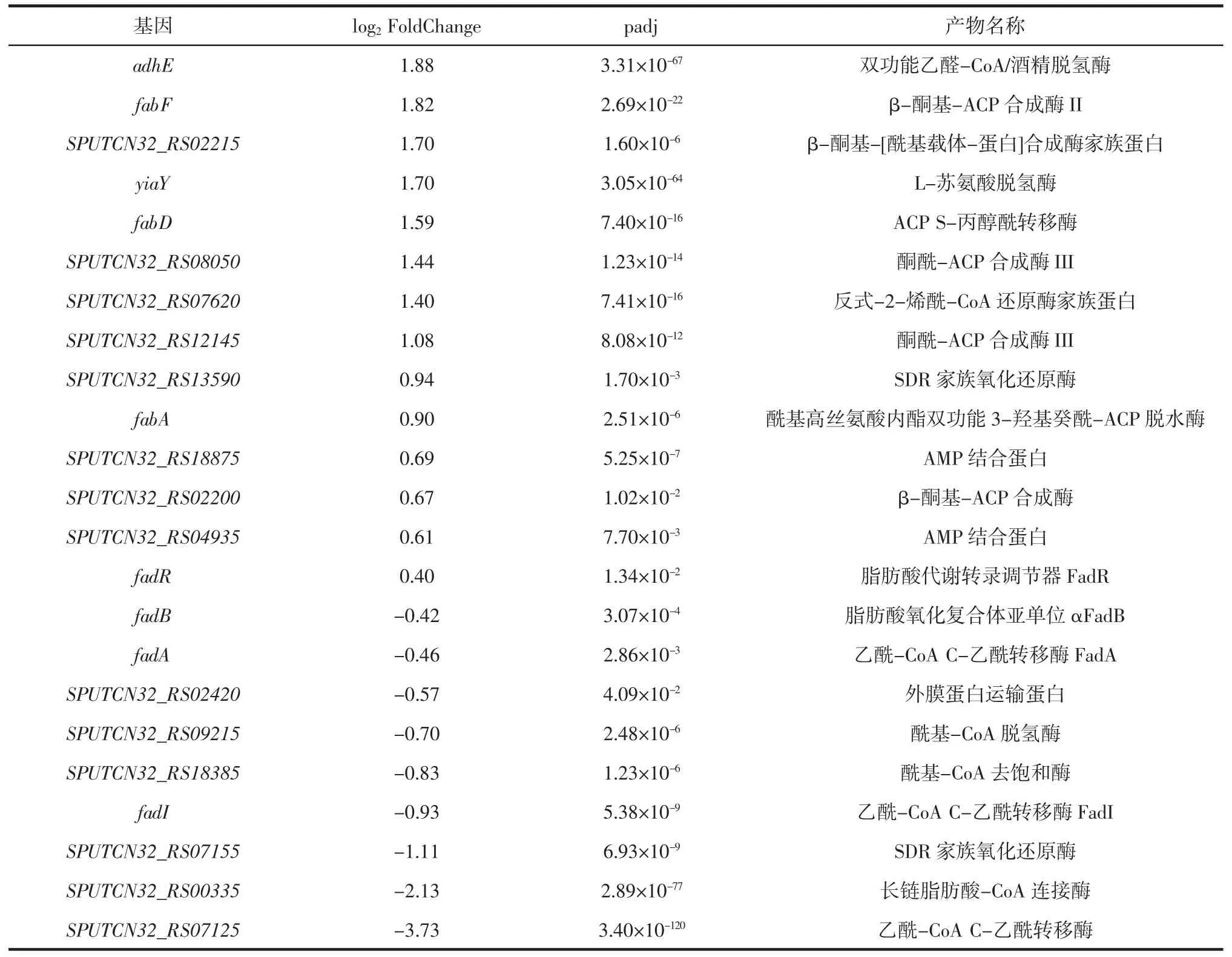
表3 S.putrefaciens 低温下与脂肪酸代谢相关基因表达情况Table 3 Expression of genes related to fatty acid metabolism of S.putrefaciens at low temperature

表4 S.putrefaciens 低温下与甘油酯代谢相关基因表达情况Table 4 Expression of genes related to glyceride metabolism of S.putrefaciens at low temperature
由表3~表4 可知,通过分析RNA-seq 结果发现,与脂肪酸代谢相关的fadA、fadB、SPUTCN32_RS09215以及参与脂肪酸跨膜转运的外在膜蛋白基因SPUTCN32_RS02420 出现显著性下调(表3)。参与细胞膜甘油酯代谢相关的基因出现显著性上调(表4),表明在低温会抑制S.putrefaciens 脂肪酸的降解和转运途径。此外,RNA-seq 结果显示,S.putrefaciens 的多种控制3-ketoacyl-ACP synthases 的基因在低温下出现显著性上调,例如fabF、SPUTCN32_RS02215、SPUTCN32_RS08050、SPUTCN32_RS12145、SPUTCN32_RS -02200,激活了低温下的脂肪酸合成途径,增加细胞脂质含量,可能防止了细胞在低温下的损伤;除了多种3-ketoacyl-ACP synthases 基因显著性上调,与链延长中还原反应相关的trans-2-enoyl-CoA reductase 家族蛋白基因SPUTCN32_RS07620、负责合成长链不饱和脂肪酸的fabA 和负责将丙二酰CoA 转移到酰基载体蛋白ACP 上的fabD 基因同样显著性上调,这些结果均证明了低温激活了S.putrefaciens 的脂肪酸合成。
2.3 多组学联合分析低温条件影响S.putrefaciens 脂肪酸代谢促进其冷适应的机制
为了深入分析参与S.putrefaciens 冷适应相关的基因表达的变化,进一步了解低温下S.putrefaciens维持存活和生长的关键机制,基于前期掌握的低温下S.putrefaciens 冷适应相关蛋白组学数据[12],对蛋白组学与转录组学数据进行联合分析,进而挖掘差异蛋白和差异基因的相关性,筛选出S.putrefaciens 在低温下显著上调的蛋白并将其定位到KEGG 途径上。通过整理联合分析得到的S.putrefaciens 映射通路,发现S.putrefaciens 甘油酯代谢(spc00564)中CDP-二酰基甘油-丝氨酸O-磷脂酰转移酶出现显著性上调,CDP-二酰基甘油-丝氨酸O-磷脂酰转移酶能够参与细胞膜中磷脂酰乙醇胺(phosphatidylethanolamines,PE)的生成,首先该酶催化由CDP-二酰基甘油和L-丝氨酸产生的磷脂酰丝氨酸(phosphatidylserine,PS),随后PS经磷脂酰丝氨酸脱羧酶催化脱羧形成PE,PE 含量的增加有利于维持细胞膜通透性,促进细胞在低温下进行有效的物质交换。此外,基于试验前期掌握的低温下S.putrefaciens 冷适应相关脂质组学数据[13],进一步对脂质组学与蛋白组学联合分析差异脂质和差异蛋白的相关性,发现S.putrefaciens 脂肪酸代谢途径(spc01212)中乙酰辅酶A 脱氢酶结构域蛋白出现显著性上调。酯酰基辅酶A 脱氢酶作为脂肪酸β 氧化过程中第一个限速酶参与长链脂肪酸的脱氢步骤,产物再经加水、脱氢和硫解步骤,每循环一次产生一分子的乙酰辅酶A,对于β 氧化至关重要。除了参与β 氧化外,酯酰基辅酶A 脱氢酶能够增加细菌体内不饱和脂肪酸的含量,而不饱和脂肪酸增加降低了磷脂双分子层的堆积密度,导致液相至凝胶相变温度的降低,对于低温下维持细胞膜流动性、保证细胞正常的生理功能具有重要的生理意义。
2.4 低温影响S.putrefaciens 能量代谢基因的表达
S.putrefaciens 低温下与糖酵解和糖异生相关基因表达情况见表5。
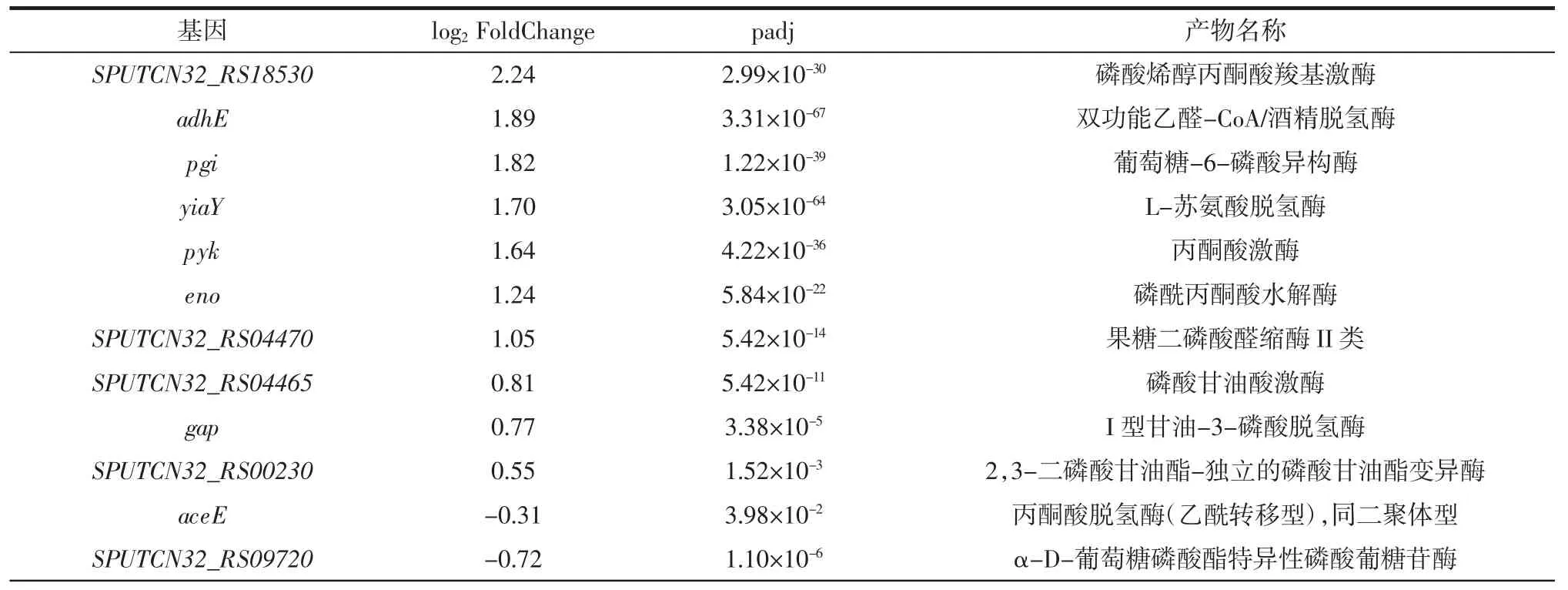
表5 S.putrefaciens 低温下与糖酵解和糖异生相关基因表达情况Table 5 Expression of genes related to glycolysis and gluconeogenesis of S.putrefaciens at low temperature

续表5 S.putrefaciens 低温下与糖酵解和糖异生相关基因表达情况Continue table 5 Expression of genes related to glycolysis and gluconeogenesis of S.putrefaciens at low temperature
糖酵解和糖异生是影响细菌持续供能和抵抗外部不良环境的关键因素。由表5 可知,在4 ℃下,S.putrefaciens 与糖酵解相关的乙醇脱氢酶、丙酮酸激酶、磷酸甘油酸激酶和葡萄糖-6-磷酸异构酶等基因表达上调,表明在低温条件下S.putrefaciens 的糖酵解过程增强,为细胞抵抗低温环境和维持正常的生理代谢提供更多的能量,同时为其它代谢提供三磷酸腺苷和中间产物。此外,S.putrefaciens 与糖异生相关的基因也有个别上调,如磷酸烯醇式丙酮酸羧基酶等产物的基因表达(表5),该酶能够在细胞高糖水平下启动磷酸烯醇丙酮酸的羧化过程并将其氧化到羧酸,提供细胞有利的热能量,维持细胞正常运转。
S.putrefaciens 低温下与三羧酸循环相关基因表达情况见表6。S.putrefaciens 低温下与氧化磷酸化相关基因表达情况见表7。
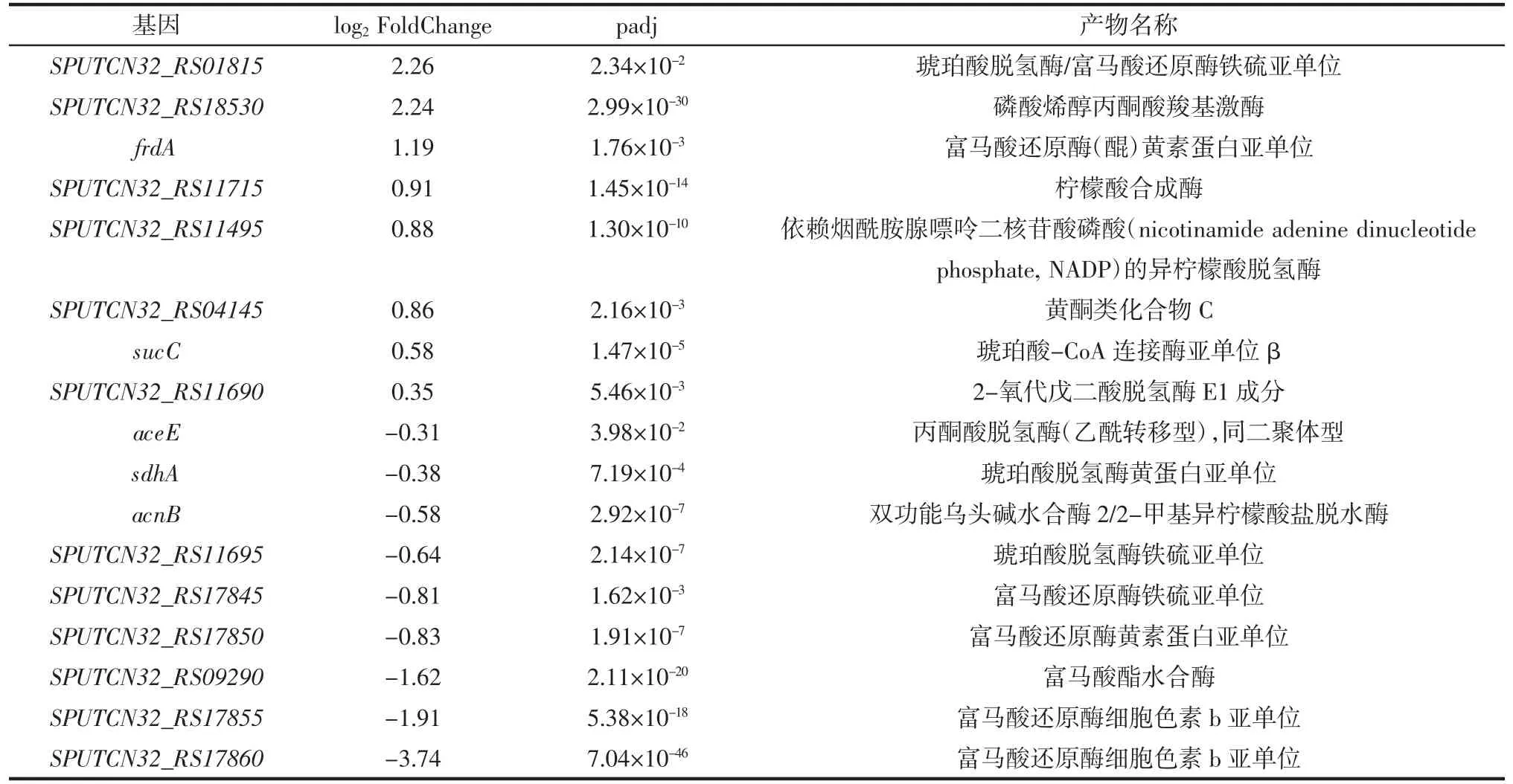
表6 S.putrefaciens 低温下与三羧酸循环相关基因表达情况Table 6 Gene expression of S.putrefaciens related to the TCA cycle at low temperature

表7 S.putrefaciens 低温下与氧化磷酸化相关基因表达情况Table 7 Expression of genes related to oxidative phosphorylation of S.putrefaciens at low temperature
通过分析RNA-seq 结果,在4 ℃下S.putrefaciens与三羧酸循环和氧化磷酸化相关的诸多基因出现显著性上调,例如琥珀酸脱氢酶、磷酸烯醇式丙酮酸羧激酶、延胡索酸还原酶、柠檬酸合酶、细胞色素c1、黄酮类化合物c、泛醌氧化酶亚基II、细胞色素c、b 氧化酶亚基、细胞色素o 泛醌氧化酶亚基I 等产物的基因表达(表6、表7),这些基因表达的上调均有利于S.putrefaciens 能量的产生和中间产物的积累,可能用于S.putrefaciens 在冷适应状态下物质的生物合成和能量获取。
2.5 多组学联合分析低温条件影响S.putrefaciens 能量代谢促进其冷适应的机制
为了深入分析冷适应与能量代谢之间的关联,从而了解低温下S.putrefaciens 繁殖和水产品腐败关键机制,研究对脂质组学与蛋白组学进行了联合分析,发现与S.putrefaciens 氧化磷酸化(spc00190)相关的还原型辅酶I(nicotinamide adenine dinucleotide,NADH)脱氢酶、琥珀酸脱氢酶亚基B、细胞色素c1、琥珀酸脱氢酶亚基C、琥珀酸脱氢酶亚基D、泛醌-细胞色素c还原酶/铁硫亚单位、细胞色素b/b6/N 末端结构域和细胞色素杜比奎醇氧化酶亚基II 在低温下出现显著性上调。此外,还发现S.putrefaciens 的三羧酸循环(spc00020)中琥珀酸脱氢酶亚基B 和O-氧戊二酸脱氢酶成分2 出现显著性上调。
NADH 脱氢酶作为电子传递链的第一个质子泵,其上调表达能够在增强S.putrefaciens 在低温下的呼吸链,使细胞在低温等不利因素下仍然能持续供能,这可能是S.putrefaciens 在低温下大量繁殖的重要原因。除了NADH 脱氢酶,琥珀酸脱氢酶在低温下的上调对于S.putrefaciens 的三羧酸循环供能也起着重要作用。细胞色素c 氧化酶、细胞色素还原酶以及细胞色素c1、细胞色素b 作为电子传递链末端的酶和中间电子载体,具有质子泵和电子传递的功能,其上调对于S.putrefaciens 氧化磷酸化和电子传递链具有增强作用,促使细胞处于低温环境的同时能够保证其进行营养的获取、代谢酶促反应、生物合成及繁殖,增强抗逆性。2-氧戊二酸脱氢酶E2 是二氢硫辛酸琥珀酰转移酶的组分,二氢硫辛酸琥珀酰转移酶是α-酮戊二酸脱氢酶系之一,构成α 酮戊二酸脱氢酶复合体的核心酶,同时也负责腺苷三磷酸的产生,对于能量的产生具有重要作用。该酶的上调促进了琥珀酰CoA 的产生,从而增强三羧酸循环和腺苷三磷酸的产生。
3 讨论
S.putrefaciens 在低温中具有很强的可持续存活、增殖和致腐能力,对全球水产品的物流和销售造成了很大的经济损失。为克服寒冷环境对微生物存活的多重胁迫,微生物演化出了多种复杂的协作适应能力,从细胞膜和酶的适应到低温保护剂及其伴侣的产生,甚至进化出新的代谢能力[14-17]。利用多组学联合分析微生物对于环境适应的基因应答变化是有效的研究手段,将基因组、转录组、蛋白组、代谢组等组学试验数据进行综合分析已成为人们探索生物应答机制的一种有效方法。本文为探究S.putrefaciens 在低温下的存活和增殖机制,对4 ℃和30 ℃条件下的S.putrefaciens RNA-seq 结果进行分析,发现S.putrefaciens 在低温下参与调节脂肪酸代谢、脂肪酸生物合成和降解、糖酵解和糖异生、三羧酸循环、氧化磷酸化、碳代谢等相关基因的表达,这与Liao 等[4]在探究低温对微生物的冷刺激有相似的结果,同时,RT-qPCR 的验证结果与RNA-seq 的数据具有一致性。
脂肪酸是细胞膜的重要组成部分,根据脂肪酸的含量来决定脂肪酸的降解和合成,对于维持膜脂稳态具有重要作用。杨胜平等[18]对不同培养温度下S.putrefaciens DSM6067 差异蛋白质组学进行了分析,发现温度越低,S.putrefaciens 细胞膜脂肪酸代谢相关酶的表达量越高。在细菌中,大多数脂肪酸都可以酯化成脂质,如磷脂(phospholipid,PL)和糖脂(glycolipid,GL)等[19],而且在低温胁迫下,脂质构成变化对细菌生存的重要性也是普遍性认同的[20-21]。通过对S.putrefaciens 脂肪酸代谢基因的研究发现,低温条件可以调控脂肪酸代谢产物和代谢酶的表达,例如,与脂肪酸代谢相关的fabF 和fabD 可以促进酰基转移到酰基载体蛋白上。质膜长链不饱和脂肪酸的减少会影响细胞膜流动性、通透性和物质交换速率[22],因此与长链脂肪酸拮抗的脂肪酸代谢转录调节子基因fadR 出现显著性上调,其拮抗机制是由于环境中存在14 个碳以上的长链脂肪酸,它们被降解成酰基辅酶A 并结合到fadR上,导致fadR 从fad 基因簇上释放并解除对fad 基因簇的转录抑制,促进长链脂肪酸降解[23],维持质膜流动性等功能。
与S.putrefaciens 在低温下保持其稳定存活和繁殖相关的重要因素是脂肪酸合成相关的诸多基因出现上调,这与脂肪酸降解相关基因的下调相反。在脂肪酸生物合成中,乙酰CoA 通过碳碳缩合、还原、脱水和还原的循环反应来产生长链脂肪酸,细菌的这些反应是通过II 型合成酶催化,反应的中间体以小的酰基载体带白的硫酯形式存在于胞内,而链的延长是通过多种3-酮脂酰-ACP 合成酶将酰基CoA 或酰基-ACP与丙二酰-ACP 缩合形成。脂肪酸合成相关基因上调说明细胞膜中脂质组成变化对于细菌在低温胁迫下存活具有重要作用,联合脂质组学分析结果可表明S.putrefaciens 脂质代谢的变化可以更好地适应低温的环境。
除了脂质代谢,转录组学和脂质组学、蛋白组学的联合分析结果表明,与糖酵解/糖异生相关的乙醇脱氢酶adhE 和磷酸烯醇式丙酮酸羧基酶SPUTCN32_RS18530、与三羧酸循环/氧化磷酸化相关的琥珀酸脱氢酶SPUTCN32_RS01815 和细胞色素c SPUTCN32_RS17000 等能量代谢相关基因的差异表达对于细胞在低温下保持正常代谢、从环境中获取能源物质以及维持正常增殖有着不可或缺的功能。葡萄糖作为微生物主要的碳源物质能够被优先利用,当胞外葡萄糖被摄取进入胞内后,首先通过糖酵解途径形成6-磷酸葡萄糖、磷酸烯醇丙酮酸、丙酮酸等产物,中间过程产生大量的腺苷三磷酸和NADH 等能源物质,产生的丙酮酸转化为乙醛和CO2,随后乙醛在ADH I 和NADH 的作用下转化为乙醇和NAD+,经糖酵解产生的丙酮酸转化为乙酰CoA 后进入三羧酸循环和氧化磷酸化进一步被氧化为细胞供能。糖异生涉及葡萄糖-6-磷酸酶、丙酮酸羧化酶和磷酸烯醇式丙酮酸羧基酶等关键酶的催化,促进菌体降解乳酸、协调氨基酸代谢、维持菌体正常代谢[24-25]。因此,这些与能量代谢相关的基因差异性表达对于S.putrefaciens 在低温下能量的产生和繁殖具有不可忽视的作用。
4 结论
本文深入探究了S.putrefaciens 在低温下脂肪酸代谢和能量代谢通路关键基因的差异性变化,确定了S.putrefaciens 在低温下代谢水平的改变,4 ℃和30 ℃培养的S.putrefaciens 脂肪酸生物合成和代谢、三羧酸循环、能量代谢等相关的部分基因出现显著性差异,在4 ℃下与脂肪酸降解的相关基因出现下调,而与脂肪酸合成的相关基因出现上调,这能够促使S.putrefaciens 在低温下维持一定的细胞膜脂质成分,进而维持其流动性和物质交换;在4 ℃下S.putrefaciens 能量代谢过程的关键基因表达上调,这能够为菌体抵抗低温环境和维持正常的生理代谢提供更多的能量,对于S.putrefaciens 维持低温下的生理状态和能量代谢具有重要作用。本文为研究S.putrefaciens 冷适应机制和靶向抑制低温S.putrefaciens 的繁殖提供了新的思路和靶点。
