荞麦槲皮素改善脂代谢异常肝原代细胞的作用机制
2023-08-12程菲儿要子妍云少君曹瑾玲程艳芬冯翠萍
程菲儿,要子妍,云少君,曹瑾玲,程艳芬,冯翠萍
(山西农业大学食品科学与工程学院,山西 太原 030001)
随着健康中国建设的推进,更多的人开始关注饮食健康。《健康中国行动(2019-2030 年)》提示“关注血糖水平”,缓解血糖异常是营养学研究领域的前沿问题之一[1]。高油脂、高热量的方便食品摄入过多,会造成机体肥胖、氧化应激、糖脂代谢紊乱等一系列健康问题,极易造成机体胰岛素抵抗的发生,而这一现象被普遍认为是引发2 型糖尿病、肥胖症和心血管疾病等代谢综合征的重要原因[2]。胰岛素抵抗是影响葡萄糖利用率的主要因素,从而引发血糖稳态失衡甚至是糖尿病[3]。然而,当肝脏中的供需平衡被打破而产生过量的葡萄糖即可引发高血糖,肝胰岛素抗性可增强脂质积累并促进葡萄糖产生,导致血脂异常和高血糖症。因此,靶向肝胰岛素抗性的天然活性成分可以有效改善2 型糖尿病和肝脂肪变性[4]。
自然界中,槲皮素大量存在于植物中,其中苦荞(Fagopyrum tataricum)为蓼科荞麦属作物,是一种药食两用的假谷物,其种子是槲皮素的主要来源[5]。日常补充槲皮素大都需要通过食物摄取。流行病学研究发现,在我国以荞麦为主食的产区人群中,血糖、血脂、血压水平均低于非荞麦产区居民[6]。苦荞对慢性病的治疗效果引起了科学家的广泛关注[7]。苦荞中最重要的生物活性成分为黄酮[8],槲皮素是具有多种生物活性的植物黄酮类物质,多数情况下以甙的形式存在,如金丝桃甙、槲皮甙等,经过水解后可以得到槲皮素。有抗糖尿病活性、抗炎活性、抗疲劳性,可用于治疗微血管病,预防肝炎症损伤[9-11]。很多研究者已经在肝基因表达和脂代谢的调控中揭示了槲皮素的作用[12-13]。研究表明,槲皮素可预防高脂肪饮食诱导C57BL/6 小鼠的肥胖,槲皮素改变了与脂代谢有关的基因图谱,包括法尼基转移酶α、对氧磷酶1、过氧化物酶体增殖物激活受体、载脂蛋白、脂肪酸转运酶/CD36[14]。槲皮素的抗糖尿病特性包括通过丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)胰岛素依赖型机制刺激葡萄糖的吸收,在肝脏中它可以通过抑制关键的葡萄糖生成酶来减少葡萄糖的产生[15-16]。
基于此,本研究建立离体组织的胰岛素抵抗模型,探索槲皮素对脂质代谢的调控作用及其具体的生物学机制,以期为槲皮素成为高效的、缓解高脂造成的肝脏胰岛素抵抗的膳食补充剂奠定科研基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
5 周龄洁净健康级的C57BL/6J 雄性小鼠:西安交通大学医学部,所有操作严格遵守实验动物护理和使用指南以及山西农业大学实验动物管理办法。
异氟烷:上海玉燕科技有限公司;胶原酶IV 型:美国Gibco 公司;胰蛋白酶(≥250 U/mg):南京建成生物工程研究所有限公司;杜氏改良低糖培养基(dulbecco's modified eagle medium,DMEM):美国HyClone 公司;RNAiso Plus 试剂盒、PrimeScriptTMRT Master Mix 反转录试剂盒、TB GreenTMPremix Ex TaqTMⅡ试剂盒:大连TaKaRa 生物工程公司;Ⅳ型胶原酶(≥100 U/mg)、溴化乙锭:北京索莱宝科技有限公司;胎牛血清:浙江天杭生物科技股份有限公司。其他化学试剂均为国产分析纯。
1.1.2 主要仪器与设备
Illumina HiSeqTM 2500 型测序仪:广州基迪奥生物有限公司;MA-6000 型基因扩增仪:杭州博日科技有限公司;Multishan Go 型多功能酶标仪:香港伯齐科技有限公司;ABI 7500 型实时荧光定量聚合酶链式反应仪:美国安捷伦公司。
1.2 方法
1.2.1 细胞处理及测序样品准备
异氟烷麻醉小鼠(C57BL/6),迅速解剖,完全暴露肝脏门静脉和下腔静脉。门静脉插入插管灌流70 mL含胶原酶Ⅳ型浓度0.03%的培养基,1~3 min 终止消化。取得完整的肝放到培养皿中,轻微撕拉肝脏培养基变成云状,肝大部分溶解到培养基里,轻摇释放残存的细胞,将悬液过70 μm 滤膜。4 ℃、600 r/min 离心5 min,弃掉上清液,加入25 mL 4 ℃培养基重悬细胞。接板后37 ℃培养45~60 min,待细胞黏附后,用培养基洗1 次,再加培养基(含10%胎牛血清)培养3~4 h。预先将细胞与10 μmol/mL 槲皮素孵育0.5 h 后加棕榈酸(100 μmol/mL)刺激24 h 造模。将六孔板放置于冰上,用磷酸缓冲盐溶液清洗细胞,每孔加500 μL 总RNA抽提试剂,4 ℃裂解30 min,完成RNA 收集。将测试样品分为3 组,依次为空白组、100 μmol/mL 棕榈酸组和槲皮素组(10 μmol/mL 槲皮素+棕榈酸处理)。
1.2.2 测序文库构建及数据处理
提取总RNA 后,测序后构建文库,富集真核mRNA,将富集的mRNA 片段化成短片段,并用随机引物逆转录成cDNA,纯化并修复cDNA 片段,连接到Illumina测序接头上。通过琼脂糖凝胶电泳选择连接产物的大小,进行聚合酶链式反应扩增,并测序。
1.3 生物信息学分析
与核糖体RNA(rRNA)的比对,与参考基因组的比对,转录本重建,新的基因转录本鉴定和注释,利用RSEM 软件对基因丰度进行定量分析。利用基因本体数据库(gene ontology,GO)富集分析、通路富集分析鉴定差异表达基因相关转导途径。
2 结果与分析
2.1 转录组表达的主成分分析
转录组测序获得了各样本中所有基因的表达值信息,通过主成分分析(principal component analysis,PCA)比较样本之间在基因表达值的整体相似性或者差异程度。运用降维的方法保留高维度的数据最重要的一些特征,去除噪声和不重要的特征,从而探究基因表达存在的相关性。
PC1 和PC2 是两个主坐标成分,PC1 表示尽可能最大解释数据变化的主坐标成分,PC2 为解释余下的变化度中占比例最大的主坐标成分。不同处理下样品的情况,样品组成越相似,其距离越近。由图1 可知,各处理组分布于不同象限,组内平行性较好,可进行后续分析利用。
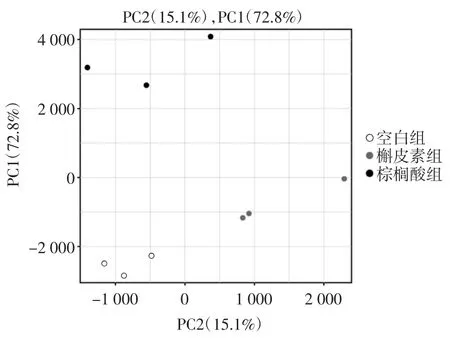
图1 主成分分析Fig.1 Principal component analysis plot
2.2 差异表达基因的分析
不同处理组差异表达基因的韦恩图和火山图见图2。


图2 不同处理组差异表达基因的韦恩图和火山图Fig.2 Venn diagram and volcano plots of differentially expressed genes between different groups
对不同处理条件下的测序数据差异结果进行分析,差异基因用韦恩图(图2A)和火山图(图2B~D)表示,在火山图中,用圆点表示为各个差异基因,以差异倍数(fold change,FC)≥2 且错误发现率(false discovery rate,FDR)≤0.05 来选择阈值。不同处理组之间的比较研究发现(图2E),空白组与棕榈酸组相比,上调基因404 个,下调基因291 个;棕榈酸组与槲皮素组相比,显著上调的基因为385 个,下调基因共有172 个。上述结果表明,与空白组相比,棕榈酸处理小鼠肝原代细胞会使其中的众多基因表达量发生改变,而加入槲皮素干预后,调节了基因转录水平。
将测序结果中显示的差异基因进行相关热图分析,建立了空白组、棕榈酸组、槲皮素组各不同处理方式下肝原代细胞差异基因的热图,结果见图3。
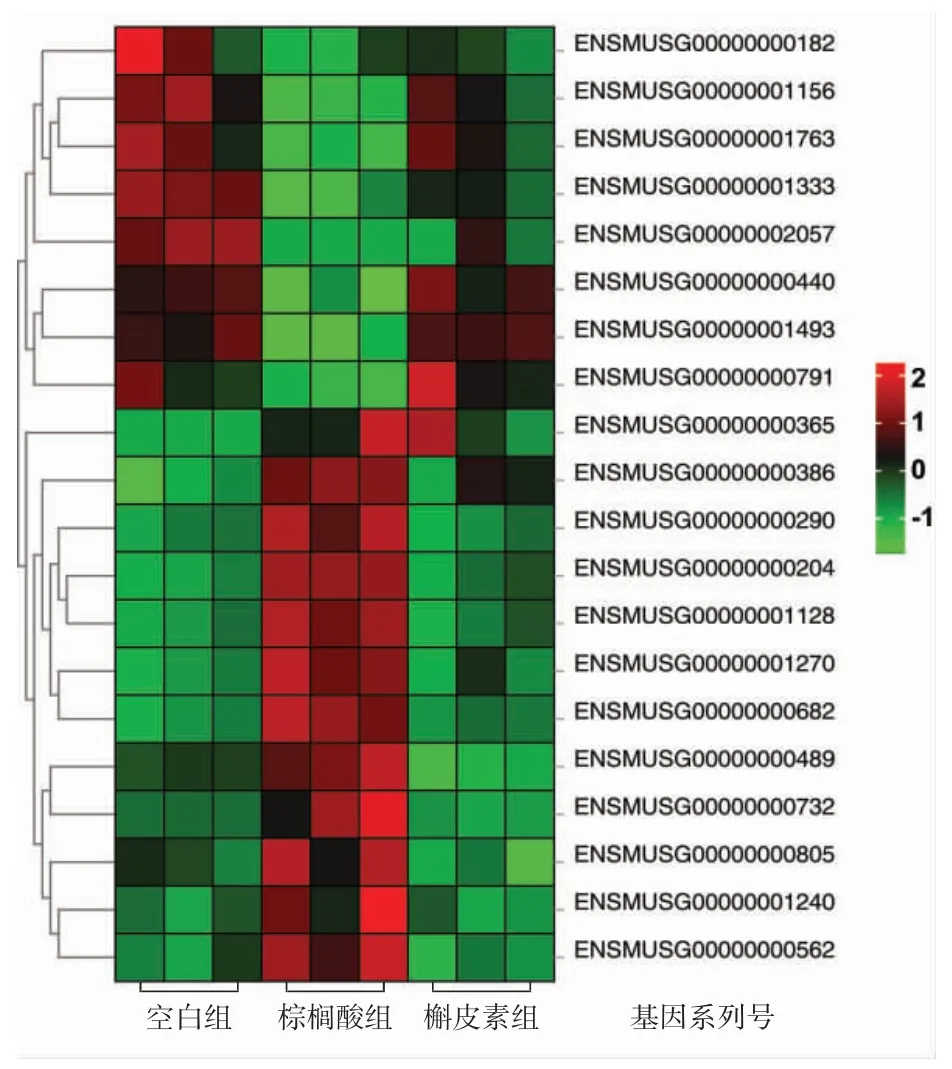
图3 不同处理组测序差异表达基因的热图分析Fig.3 Heatmap of differentially expressed genes between different groups determined via RNA-Seq
图3 中,每个格子表示1 个基因,颜色越深代表这个基因的表达量越高。每行表示每个基因在不同样本中的表达量情况,每列表示每个样品中所有基因的表达量情况。左侧树形图就是对基因的聚类,聚类可以观察到基因之间的关系及其上下游调控会导致连锁反应。
2.3 基因本体数据库分析
基因本体(gene ontology,GO)数据库把基因的功能分成了3 个部分,分别为细胞组分(cellular component,CC)、分子功能(molecular function,MF)、生物过程(biological process,BP)。利用GO 数据库,就可以得到目标基因在CC,MF 和BP 3 个层面上的生物调节机制。GO 的功能注释分析见图4。

图4 GO 的功能注释分析Fig.4 GO annotation of the differentially expressed genes
图4 GO 分析表明,槲皮素作用于肝原代细胞中,生物过程包括细胞过程、信号-组织过程、刺激反应、代谢过程、生物调节;分子功能包括绑定、接触反应活性、信号转导、转录因子活性等;细胞组成包括细胞、细胞器、细胞膜等。通过对核心靶点的GO 分析,发现槲皮素改善脂代谢紊乱的肝脏原代细胞,与细胞代谢过程、生物调节信号等生物学过程密切相关,说明槲皮素有助于肝脏脂质代谢调控。而脂质在肝脏的异位沉积被认为是代谢紊乱和胰岛素抵抗发生的关键性因素,表明脂肪组织功能紊乱与肝脏胰岛素抵抗发生之间的关系[17],通过基因组测序结果证实棕榈酸刺激肝原代细胞确使其发生代谢紊乱。
2.4 京都基因与基因组百科全书数据库分析
京都基因与基因组百科全书数据库(kyoto encyclopedia of genes and genomes,KEGG)是系统分析基因产物在细胞中的代谢途径以及这些基因产物功能的数据库。根据mRNA-gene 调控信息,为了能够比较清晰地研究不同组之间基因差异的生物学影响,将显著富集的基因利用KEGG 进行分析,结果见图5。

图5 KEGG 通路的功能注释分析Fig.5 KEGG pathways of the differentially expressed genes
差异基因主要富集的信号通路有炎症相关通路、缺氧诱导因子-1 信号通路(hypoxia-inducible factor 1,HIF-1)、MAPK 信号通路、肿瘤坏死因子信号通路(tumor necrosis factor,TNF)等通路富集的差异基因数量较多。已有研究表明棕榈酸刺激细胞极易引发其自身氧化应激及代谢紊乱。Cheng 等[18]利用棕榈酸刺激HepG2细胞建立糖代谢紊乱模型。本试验中利用100 μmol/L棕榈酸刺激小鼠肝脏原代细胞建立肝脏原代细胞糖脂紊乱模型。此外,Zhang 等[19]发现荞麦中的功能性成分可预防PA 介导的内皮功能紊乱。KEGG 分析结果显示,槲皮素改善脂代谢紊乱的通路为HIF-1 信号通路,MAPK 信号通路、TNF 信号通路。HIF-1 的发现给肝脏脂质代谢紊乱研究提供了新思路,缺氧导致肝组织功能紊乱。当氧气水平低时,HIF-1 的量会增加,因此它可以结合并调节促红细胞生成素基因以及其他具有HIF 结合DNA 片段的基因。这一因子的升高标志了组织处于缺氧状态,而这与线粒体功能障碍有关,包括脂肪酸氧化受损,电子传输链活性降低和活性氧产生增加[20]。这些缺氧性改变极易加速肝脂质积累和炎性细胞浸润,形成恶性循环,导致肝脏中不可逆的纤维化重塑[21]。高脂饮食间歇性缺氧通常会加剧肝脂肪变性,并伴有肝脏炎症和脂质过氧化作用。MAPK信号通路调节着细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理/病理过程。在糖脂代谢紊乱所产生的应激刺激(缺氧、内质网应激和氧化应激等)和炎性刺激状态中起转导作用,MAPK 是信号从细胞表面传导到细胞核内部的重要传递者。进入血液循环的高浓度游离脂肪酸会造成脂肪代谢的紊乱,MAPK 通过依次磷酸化将上游信号传递至下游应答分子,使机体具有信号传递功能的脂质甘油二酯的含量升高从而导致蛋白激酶C-ε 向胞膜异位,与胰岛素受体结合并抑制该受体的作用,通过损坏胰岛素下游的磷脂酰肌醇3 激酶信号通路,从而减弱了胰岛素抑制糖异生的作用,导致肝脏产糖量增加[22-24]。而在高血糖的刺激下,极易导致机体的炎症反应,此时TNF 信号通路中的关键因子介导了体内的细胞存活、死亡和分化。脂质代谢紊乱引发的肝脏胰岛素抵抗是后续研究的新思路,值得我们进一步深入探究其机制。
3 结论
肝脏在代谢调控中具有主导作用,但很少有研究全面揭示槲皮素作为膳食补充剂在原代肝细胞中基因表达情况,尤其是对全基因谱的调控作用。转录组测序及分析显示,差异基因主要富集的信号通路分别是HIF-1 信号通路、MAPK 信号通路、TNF 信号通路等通路。测序结果表明不同处理组对小鼠肝原代细胞中基因表达量产生影响。其中,荞麦槲皮素有效改善HIF-1 途径值得特别关注,这一发现将为荞麦作为高原缺氧条件下的膳食补充提供理论基础,丰富荞麦制品,延长地方特色小杂粮产业链,为促进杂粮可持续发展提供理论依据。
