NO熏蒸对冷藏枸杞鲜果糖代谢及基因表达的影响
2023-08-12王雪李乾王新宇李慧毕莹刘彩红古丽丹塔勒达吾刘凤兰王静
王雪,李乾,王新宇,李慧,毕莹,刘彩红,古丽丹·塔勒达吾,刘凤兰,王静*
(1.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;2.新疆林业科学院经济林研究所,新疆 乌鲁木齐 830063)
枸杞(Lycium barbarum L.)是茄科枸杞属多年生落叶灌木,含有丰富的营养物质和生物活性物质,如多糖、类胡萝卜素、类黄酮、维生素和氨基酸等,有助于清洁肝脏、明亮眼睛、增强气力、提高免疫力、预防心血管疾病和癌症,因此它也被称为“超级食品”[1]。由于新鲜枸杞皮薄且易损,因此在采摘和储运过程中,非常容易受到外力作用,导致细胞膜破坏,果胶等大分子物质快速降解,同时,微生物入侵后极易引起霉变和损失。新鲜枸杞在储运阶段出果率差导致货架期过短,失去食用价值,影响鲜枸杞产业健康持续发展[2]。因此,寻找具有成本效益且高效的方法来延长新鲜枸杞的贮藏期并改善其贮藏品质显得尤为重要。
目前,枸杞鲜果采后保鲜主要集中于水杨酸处理[3]、水杨酸结合气调[4]、冰温[5]、预处理结合气调包装[6]、壳聚糖涂膜[7]和褪黑素处理[8]等,但采用NO 熏蒸枸杞鲜果保鲜的研究较少。
一氧化氮(NO)是一种生物活性分子,可以抑制水果在贮藏期间的呼吸速度,影响氧化物质的代谢、糖类物质的代谢、膜脂质过氧化和功能成分的积累等,并可以调节水果和蔬菜的生长、成熟和抗病性等[9-11]。研究表明,用NO 处理可以抑制乙烯的产生和呼吸速率,推迟桃子的成熟[12],并可抑制哈密瓜果实冷害的发生[13];抑制“雨花露”水蜜桃果实膜脂过氧化,缓解软化速率,改善常温贮藏品质[14];控制木纳格葡萄果肉的软化程度和水分的流失,减慢其衰老速度[15];减少莲雾果实收获后的絮状绵软速度,延长果实的货架期[16]。NO 处理对糖代谢也存在影响,张美姿[17]研究发现,NO 处理显著降低了冷藏枇杷果实中分解方向的相关酶[酸性转化酶(acid invertase,AI)、中性转化酶(neutral invertase,NI)]活力上升,并降低了合成方向的相关酶[蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)和蔗糖合成酶(sucrose synthetase,SS)]的活性下降,降低了可溶性糖含量下降的速度,延缓了木质化劣变的速度。经NO 处理的肥城桃果实在贮藏前期AI、NI、己糖激酶(hexokinase,HK)、分解方向相关酶的活力水平高于对照,为呼吸跃变提供能量;贮藏后期处理果实的SPS活力高于对照,降低已糖激酶和磷酸葡糖异构酶的活力,同时下调已糖激酶的基因表达,从而限制果实糖酵解速率,延长贮藏期[18]。孙振[19]以肥城桃为原料,发现NO 处理可以有效延缓糖类物质相互之间的转换;提高SPS活力,对AI、NI 和SS 活力的抑制有时间效应。
糖代谢是多种代谢的中心,在果实软化中起着重要作用[9],并与果实的后熟软化显著相关[20-21]。维持糖代谢平衡,有利于保持果实细胞的膨压和细胞壁张力,从而延缓软化[22]。有研究指出,植物中蔗糖合成与分解之间的平衡是合成酶和转化酶协同作用的结果[23]。AI、NI、SS、SPS 共同调节蔗糖的积累与降解,与果实品质形成、成熟衰老等密切相关[24]。张强等[25]研究发现,果实软化在一定程度上归因于糖代谢的积累,在哈密瓜果实成熟后软化过程中,蔗糖、果糖和葡萄糖含量下降,蔗糖代谢也参与瓜果成熟后软化。董黎梨[26]发现淀粉酶和转化酶参与菠萝蜜果实成熟软化过程中糖代谢的反应,并与淀粉、可溶性总糖、葡萄糖、果糖和蔗糖含量的变化相关。齐秀东等[22]研究表明,苹果果实可以在低温下保持糖分稳定,平衡细胞渗透压进行自我防御,防止硬度降低,有效减少果实软化,从而有效地保存和延长水果的新鲜程度。但NO 熏蒸枸杞鲜果对糖代谢影响的研究鲜见报道。
本试验采用99.9%的外源NO 熏蒸“宁杞七号”枸杞鲜果,研究其对冷藏枸杞鲜果中糖代谢及基因表达的影响,以期为将外源NO 熏蒸应用于延缓枸杞鲜果软化方面提供参考。
1 材料与方法
1.1 材料与试剂
“宁杞七号”枸杞:2019 年7 月3 日采摘自新疆博乐市精河县托里乡。
3,5-二硝基水杨酸:上海科丰实业有限公司;结晶酚:天津市风船化学试剂科技有限公司;酒石酸钾钠、氢氧化钠、亚硫酸钠、氯化镁、蔗糖、硼砂:天津市致远化学试剂有限公司;碳酸钠、巯基乙醇:天津市北联精细化学品开发有限公司;乙二胺四乙酸:天津市盛奥化学试剂有限公司;曲拉通X-100、果糖:天津市光复精细化工研究所;尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)、R1200 总RNA 提取试剂盒:北京索莱宝科技有限公司;PrimeScript 1st stand cDNA 试剂盒:北京庄盟国际生物基因科技有限公司。所用试剂均为分析纯。
1.2 仪器与设备
本试验所需主要仪器见表1。

表1 主要仪器设备及生产厂家Table 1 Main instruments and manufacturers
1.3 方法
1.3.1 枸杞鲜果的处理方法
枸杞鲜果带果柄和萼片采摘,在当地冷库(3.0±0.5)℃中预冷24 h,然后将其装框,运到新疆农业大学冷库(3.0±0.5)℃中,选择16 kg 无腐烂、霉变及机械损伤的新鲜枸杞作为试材(处理组和对照组各8 kg)。熏蒸罐在样品处理前一天晚上用酒精密闭消毒12 h,并在熏蒸前4 h 打开使酒精味消散。在酒精味消失后,将熏蒸罐进行抽真空处理,在体积26 L 的熏蒸罐内注入99.9%纯度的NO 标准气体,使用300 μL/L NO 室温熏蒸3 h,每个熏蒸罐处理新鲜枸杞2 kg。将处理后的枸杞装入带孔的塑料筐中,每筐约2 kg(少于塑料筐的三分之一),并在上方用报纸覆盖,并立即放置3 ℃的低温冷库进行贮藏;对照组不使用NO 进行熏蒸,其余条件与处理组均相同。每6 d 取1 次样,共7 次。
1.3.2 硬度测定
处理组和对照组随机各取50 枚果实,使用质构仪测定枸杞硬度。全质构分析(texture profile analysis,TPA);探头:P/36 R 柱形探头;测试目标模式:应变;压缩程度:70%;测前速度:2 mm/s;测中速度:1 mm/s;测后速度:1 mm/s。
1.3.3 可溶性固形物含量测定
随机取10 g 枸杞,打浆机打碎,将枸杞汁滴在手持折光仪测定可溶性固形物含量(%),每种浓度测定10 次,取平均值。
1.3.4 可溶性糖含量测定
采用蒽酮硫酸法[27]测定可溶性糖含量。
1.3.5 酸性转化酶活力的测定
参考杨涓[23]的方法进行测定,并稍作改动。称取0.5 g 枸杞果实,加入5 mL 预冷缓冲液,冰浴研磨至匀浆,12 000 r/min、4 ℃离心20 min,收集上清液;在沉淀中继续加入4 mL 提取缓冲液,同等条件离心1 次,合并上清液并用提取缓冲液定容至10 mL,为酶提取液。
25 mL 试管中加入1 mL 酶提取液和1 mL 反应液[1%蔗糖、0.1 mol/L 醋酸缓冲液(pH5.5)],在34 ℃的水浴条件下使其充分反应1 h,再加入1.5 mL 3,5-二硝基水杨酸溶液后,沸水浴5 min 终止反应,并立即用冷水将其降至室温(20±5)℃后定容至25 mL,充分摇匀后在540 nm 波长下测定吸光度;以经过10 min 沸水浴的酶液作对照,上述步骤重复3 次,取平均值。
1.3.6 中性转化酶活力的测定
参考杨涓[23]的方法进行测定,并稍作改动。酶提取液提取方法同1.3.5,测定时将酸性转化酶反应液[1%蔗糖、0.1 mol/L 醋酸缓冲液(pH5.5)]替换为pH7.5、浓度为0.1 mol/L 磷酸缓冲液[1%蔗糖、5 mmol/L MgCl2、1 mmol/L 乙二胺四乙酸(ethylene dia-mine tetra-acetie acid,EDTA)]。
1.3.7 蔗糖合成酶活力的测定
参考杨涓[23]的方法进行测定,并稍作改动。酶提取液提取方法同1.3.5。将0.05 mL 酶提取液和0.05 mL SS 反应液加入25 mL 的试管中,在34 ℃水浴条件下反应1 h,加入30%KOH 溶液0.2 mL,煮沸10 min 终止反应后自然冷却至室温(20±5)℃,加入3.5 mL 硫酸-蒽酮溶液,在40 ℃水浴条件下反应20 min,冷却至室温(20±5)℃,充分摇匀后在620 nm 处测定溶液吸光度。以经过10 min 沸水浴的酶液作对照,上述步骤重复3 次,取平均值。
1.3.8 蔗糖磷酸合成酶活力的测定
参考杨涓[23]的方法进行测定,并稍作改动。将SS反应液[0.1 mol/L 磷酸缓冲液(pH8)、4 mmol/L UDPG、0.06 mol/L 果糖、15 mmol/L MgCl2]替换为pH8、浓度为0.1 mol/L 硼酸缓冲液(10 mmol/L UDPG、5 mmol/L果糖-6-磷酸、15 mmol/L 葡萄糖-6-磷酸、15 mmol/L MgCl2、1mmol/LEDTA),其余操作方法同1.3.7。
1.3.9 cDNA 合成与荧光定量聚合酶链式反应引物分析的测定
使用试剂盒将经检测合格并定量的总RNA 逆转录成cDNA,并将表2 中反应混合物置于冰浴试管中。

表2 逆转录反应体系1Table 2 Reverse transcription reaction system 1
加RNase free dH2O(灭菌蒸馏水)至10 μL,混匀后65 ℃孵育5 min,结束后迅速冰浴。在冰浴的试管中加入表3 反应混合物。

表3 逆转录反应体系2Table 3 Reverse transcription reaction system 2
反应混合物在42 ℃反应30~60 min 后,再在95 ℃加热5 min 结束反应,并在冰浴条件下进行后续试验。
结合贮藏过程中糖代谢酶的差异显著性,选择酸性转化酶、中性转化酶、蔗糖合成酶和蔗糖磷酸合成酶4 个酶进行酶基因的定量表达测定。
实时荧光定量聚合酶链式反应(quantitative real time polymerase chain reaction,qRT-PCR)的定量基因特异性引物如表4 所示。

表4 qRT-PCR 引物序列Table 4 Primer sequence of qRT-PCR
选择该目的基因的cDNA 为模板,进行PCR,PCR 反应体系如表5 所示。

表5 PCR 上机反应体系Table 5 PCR reaction system
按照表5 反应体系配制的PCR 反应溶液置于PCR 仪上进行PCR 扩增反应。反应条件:95 ℃、5 min预变性,然后按95 ℃、15 s,60 ℃、30 s,共40 个循环。
1.3.10 数据处理与分析
试验数据均由Excel 处理,SPSS 19 进行方差分析,Origin 2018 制图。实时荧光定量PCR 检测的相对表达水平使用2-ΔΔCt进行计算分析并使用Origin 2018做图。
2 结果与分析
2.1 NO 熏蒸对果实硬度的影响
NO 熏蒸对冷藏枸杞鲜果硬度的影响见图1。

图1 NO 熏蒸对冷藏枸杞鲜果硬度的影响Fig.1 Effect of NO fumigation on firmness of postharvest of Lycium barbarum fruit during cold storage
果实硬度是衡量果实感官质量的一个重要指标,与商业价值和适口性密切相关。图1 显示,两组枸杞硬度在贮藏0~6 d 均迅速下降,其中对照组下降速度更快;贮藏6~36 d,对照组果实的硬度迅速下降,但300 μL/L NO 处理组呈现小幅度波动;在整个贮藏过程中,300 μL/L NO 处理组的果实硬度一直高于对照组枸杞。结果表明,300 μL/L NO 熏蒸可以推迟枸杞果实软化,保持果实硬度。
2.2 NO 熏蒸对果实可溶性固形物含量的影响
NO 熏蒸对冷藏枸杞鲜果可溶性固形物含量的影响见图2。

图2 NO 熏蒸对冷藏枸杞鲜果可溶性固形物含量的影响Fig.2 Effect of NO fumigation on soluble solids of fresh fruits of Lycium barbarum during cold storage
枸杞中的可溶性固形物包括多糖、类胡萝卜素和类黄酮类化合物等[28]。可溶性固形物的含量与枸杞的质量密切相关。通常,可溶性固形物含量越高,水果和蔬菜的贮藏品质就越好。如图2 所示,对照组新鲜枸杞的可溶性固形物含量呈现动态变化,而使用300 μL/L NO 处理组的枸杞可溶性固形物含量则呈整体上升趋势。贮藏12~30 d,300 μL/L NO 处理组的枸杞可溶性固形物含量迅速增加,而对照组呈下降趋势;在贮藏结束时,300 μL/L NO 处理组的枸杞可溶性固形物含量达到最高值20.98%,较对照组高14%。试验结果表明,300 μL/L NO 熏蒸可显著降低冷藏枸杞中可溶性固形物含量下降速度,贮藏结束时枸杞中的可溶性固形物含量仍保持在较高水平,可能是由于NO 对果实呼吸与多糖物质降解有抑制作用,这与胡江伟等[29]的研究结果相似。
2.3 NO 熏蒸对果实可溶性糖含量的影响
NO 熏蒸对冷藏枸杞鲜果可溶性糖含量的影响见图3。
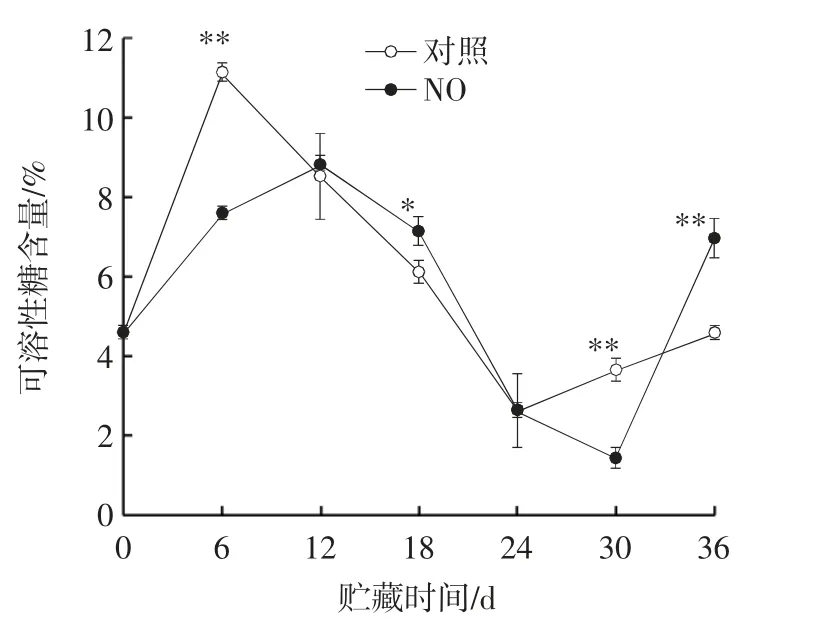
图3 NO 熏蒸对冷藏枸杞鲜果可溶性糖含量的影响Fig.3 Effect of NO fumigation on soluble sugar content of fresh fruits of Lycium barbarum during cold storage
一方面,果实的可溶性糖为收获后的呼吸代谢消耗等提供能量和底物,另一方面,它们通过维持果实细胞的膨压和细胞壁的张力来参与软化过程[30]。如图3 所示,枸杞的可溶性糖含量在贮藏期间呈“升-降-升”的趋势变化。贮藏0~6 d,所有的处理都呈现出快速上升的趋势,对照组枸杞可溶性糖含量在贮藏第6天时达到最大值11.16%;300 μL/L NO 处理组在贮藏至第12 天时达到最大含量,为8.85%;在贮藏结束时,使用300 μL/L NO 处理的枸杞可溶性糖含量比第0 天增加了34%;而对照组的枸杞可溶性糖含量比第0 天减少了1%。枸杞中可溶性糖含量的变化趋势可能是由NO 处理下调AI 相对表达量和NI 相对表达量来降低贮藏后期AI 活力,同时抑制贮藏前期NI 活力,两者共同作用减缓糖代谢进程,保持较高的可溶性糖含量,维持细胞的膨压和细胞壁张力,以此保护果实的形状和硬度[30]。试验结果表明,300 μL/L NO 处理可抑制枸杞中可溶性糖含量下降,延长枸杞贮藏时间并保持枸杞鲜果品质。
2.4 总RNA 提取结果
采用总RNA 提取试剂盒提取枸杞总RNA,结果见图4。

图4 枸杞总RNA 提取图Fig.4 Total RNA extraction drawing of Lycium barbarum
由图4 可知,从上到下分别为28S、18S 和5S rRNA,电泳结果显示枸杞具有完整的18S 和28S,且主条带清晰、单一、明亮,说明RNA 完整度好、没有降解、无污染、纯度高,可以用于下一步试验。
2.5 NO 熏蒸对果实AI 活力的影响
NO 熏蒸对冷藏枸杞鲜果AI 活力及其相对表达量的影响见图5。

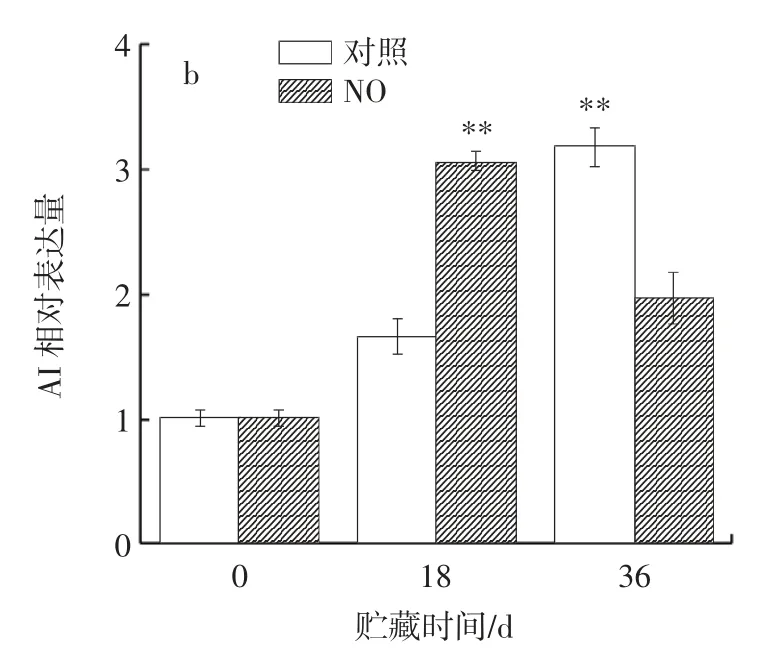
图5 NO 熏蒸对冷藏枸杞鲜果AI 活力及其相对表达量的影响Fig.5 Effect of NO fumigation on AI activity and relative expression of fresh fruits of Lycium barbarum during cold storage
AI 催化蔗糖降解,其中不溶性AI 在细胞壁上,负责细胞壁质外体的卸载[31]。由图5a 可知,贮藏0~24 d,两组枸杞的AI 活力先迅速增加,在贮藏的第12 天达到最高值,之后迅速下降;在贮藏至24 d 时,对照组的枸杞AI 活力比处理组高14.35%,差异极显著(P<0.01);贮藏24~36 d,对照组的枸杞酶活性持续下降,而处理组的枸杞则呈现波动的变化趋势,且在第30 天,对照组酶活力显著高于处理组(P<0.05)。由图5b 可以看出,贮藏第18 天,处理组AI 相对表达量极显著高于对照组(P<0.01);贮藏第36 天,对照组相对表达量极显著高于处理组(P<0.01),AI 相对表达量与AI 活力结果一致,这与韩帅[32]研究结果相似,表明贮藏后期NO 熏蒸通过调控枸杞AI 相对表达量抵抗果实软化。由此说明,NO 熏蒸通过降低贮藏后期AI 表达水平,从而调节AI 活力,控制果实蔗糖分解速度,维持细胞膨压,延缓枸杞软化。
2.6 NO 熏蒸对果实NI 活力的影响
NO 熏蒸对冷藏枸杞鲜果NI 活力及其相对表达量的影响见图6。

图6 NO 熏蒸对冷藏枸杞鲜果NI 活力及其相对表达量的影响Fig.6 Effect of NO fumigation on Ni activity and relative expression of fresh fruits of Lycium barbarum during cold storage
由图6a 可知,自贮藏开始至结束,两组枸杞鲜果中NI 活力呈动态变化;贮藏0~12 d,处理组枸杞中NI活力极显著低于对照组(P<0.01);贮藏18~30 d,处理组NI 活力始终高于对照组,但两者酶活力逐渐接近;贮藏第24 天,处理组枸杞NI 活力出现酶活力高峰,比对照组高峰出现时间推迟12 d。NI 活力的动态变化说明NO 通过诱导不同贮藏时期的NI 转录水平从而调控不同时期的NI 活力,调节糖代谢进程,使整个贮藏过程保持较高的可溶性糖含量和硬度,从而减缓果实软化速度。
2.7 NO 熏蒸对果实SS 活力的影响
NO 熏蒸对冷藏枸杞鲜果SS 活力及其相对表达量的影响见图7。

图7 NO 熏蒸对冷藏枸杞鲜果SS 活力及其相对表达量的影响Fig.7 Effect of NO fumigation on SS activity and relative expression of fresh fruits of Lycium barbarum during cold storage
SS 是糖代谢中的重要酶类,既可以催化蔗糖合成又可以参与蔗糖分解,是一个可逆的过程[33]。由图7a可知,贮藏0~36 d,两组枸杞中SS 活力总体呈现上升趋势,但处理组的枸杞酶活性始终低于对照组。贮藏第0~12 天,处理组和对照组的枸杞SS 活力差别不大,且两组相互接近;在贮藏第12~36 天,对照组的枸杞酶活力高于处理组的酶活力。由图7b 所示,贮藏第18天,对照组枸杞SS 的相对表达量略高于处理组;与图7a 所示SS 活力有一定相似之处,贮藏第36 天,处理组枸杞中SS 相对表达量极显著高于对照组(P<0.01),与酶的活力变化不同。整个贮藏过程中枸杞SS 活力的动态变化趋势,说明NO 熏蒸通过诱导枸杞贮藏后期LbSS 表达量升高延缓蔗糖分解,保持枸杞果实硬度,这与采后枇杷果实经NO 处理后可提高SS 活力结果不同[17],同时也说明NO 熏蒸枸杞通过调控SS 活力维持蔗糖代谢平衡从而抑制软化有一定的复杂性。
2.8 NO 熏蒸对果实SPS 活力的影响
NO 熏蒸对冷藏枸杞鲜果SPS 活力及其相对表达量的影响见图8。
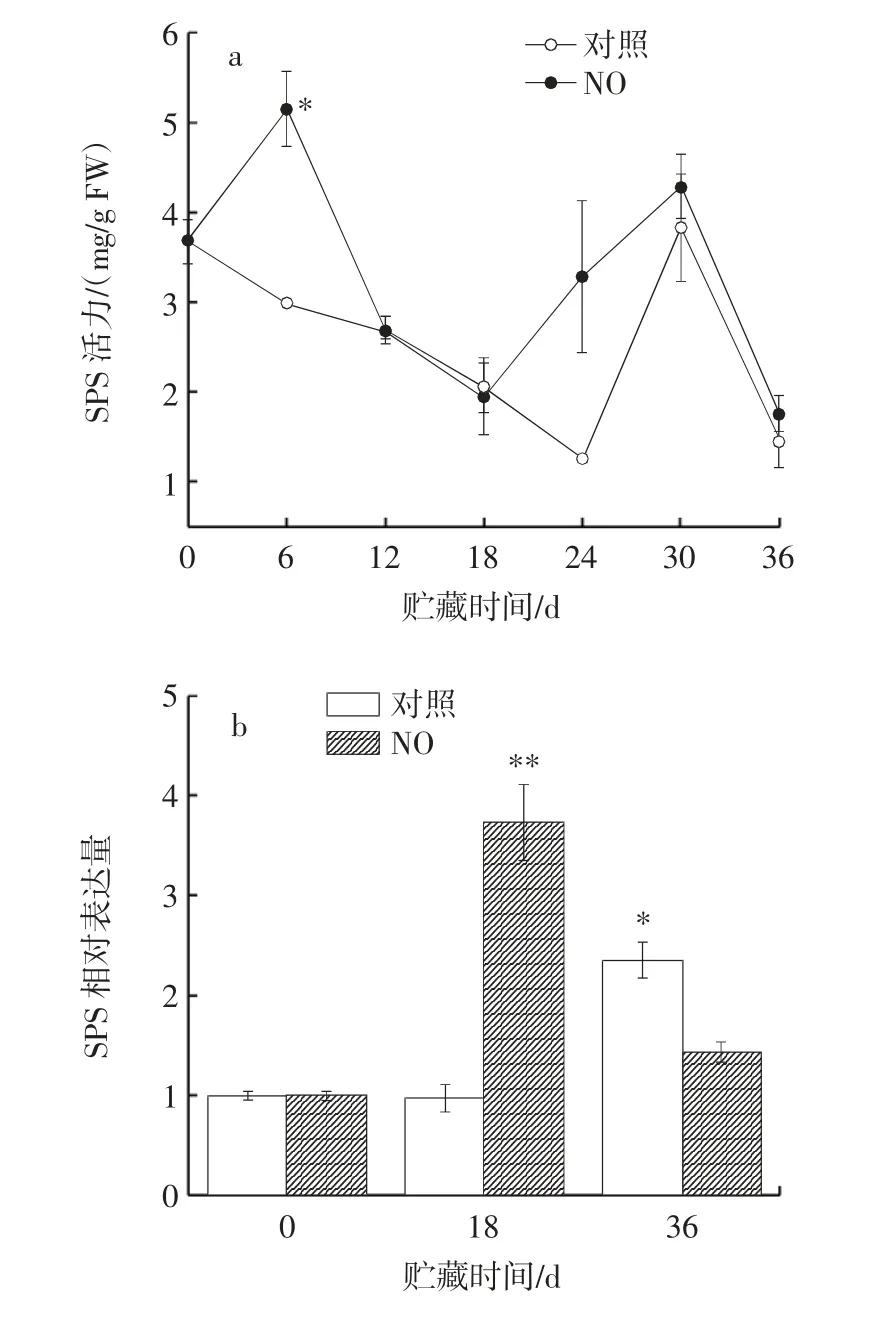
图8 NO 熏蒸对冷藏枸杞鲜果SPS 活力及其相对表达量的影响Fig.8 Effect of NO fumigation on SPS activity and relative expression of fresh fruits of Lycium barbarum during cold storage
SPS 调控蔗糖合成,参与糖类运输[24]。由图8 可知,贮藏0~6 d,处理组枸杞酶活力快速上升达到峰值;贮藏6~18 d,两组枸杞SPS 活力不断下降并逐渐接近,而对照组酶活力在第18 天高于处理组,这与SPS 相对表达量结果不一致;24~36 d,两组枸杞酶活力均呈“升-降”趋势,处理组枸杞中SPS 活力始终高于对照组并于贮藏第30 天出现酶活力高峰。由此说明,NO 熏蒸可以保持较高的SPS 活力,促进蔗糖合成,保持细胞正常膨压与细胞壁张力,延缓枸杞软化。
3 结论
研究结果表明,NO 处理显著上调贮藏第36 天LbSS 表达量,但是整个贮藏过程中保持较低SS 活力,调控不同贮藏时期LbAI 和LbNI 表达量,从而抑制贮藏前期(0~12 d)NI 活力和贮藏后期(24~36 d)AI 活力下降,NO 处理显著上调贮藏第36 天LbSPS 表达量,保持较高的SPS 活力,加快蔗糖合成,保持较高的溶性固形物和可溶性糖含量,对维持细胞渗透压,保持果实细胞坚挺,延缓枸杞鲜果软化具有一定的作用。
