沙棘油对黑曲霉线粒体结构及功能的影响
2023-08-12辛燕花徐丁一吴双全秦萌萌刘云红张建华张铁丹史晓晶
辛燕花,徐丁一,吴双全,秦萌萌,刘云红,张建华,张铁丹,史晓晶*
(1.忻州师范学院生物系,山西 忻州 034000;2.广州万物生健康产业有限公司,广东 广州 510642)
沙棘(Hippophae rhamnoides L.)原产于欧亚大陆,已在俄罗斯、英国、德国、芬兰、罗马尼亚和法国等多个国家驯化并大量种植[1]。沙棘(sea buckthorn,SBT)富含生物活性物质,其中包括大量的维生素、胡萝卜素、微量元素、氨基酸[2-5]。沙棘存在多种天然活性化合物,具有抗菌、抗氧化、抗炎、免疫调节、放射防护、适应性和组织再生等多种特性[1,6-9]。因此广泛应用于放射性损伤、烧伤、口腔炎症、胃溃疡的治疗[10-13]。沙棘是一种含有丰富油脂的植物,其籽、果皮、果实及果渣中都可以检测到油脂,沙棘籽成熟后,其油脂含量可高达20%,而干沙棘果中的油脂含量达到约为25%,另外,提取沙棘汁后的果渣也可含有高达20%的油脂。有文献证实沙棘油包含多种不饱和脂肪酸、类胡萝卜素及其衍生物、甾醇以及天然维生素E 等,多数为人体必需的活性成分,这些活性物质具有抗菌、抗病毒、抗肿瘤、抗溃疡、抗衰老、抗辐射、增强免疫力等功能[14]。
黑曲霉(Aspergillus niger),隶属于半知菌亚门,丝孢纲,丝孢目,丛梗孢科,曲霉属,是一种常见的大型丝状真菌。黑曲霉是一种可以直接侵染人体导致系统性疾病的真菌,同时也能够侵染食品、植物和药材,改变它们原有的营养成分和药用成分,导致质量下降从而丧失经济价值[15-16]。沙棘及其提取出的沙棘油含有广泛的生物活性物质,具有无毒的特性,受到了研究者们的关注。目前大多数研究集中在沙棘提取物对细菌及真菌生长的抑制作用上,已经取得了一定临床应用进展。有学者提取了沙棘叶、果实和沙棘籽中的油,并对细菌和一些致病真菌进行了活性检测,结果显示这些沙棘油粗提物可以抑制细菌和致病菌的生长[14,17],但是目前沙棘油的抗菌机制尚不明确。线粒体是生物体中一个重要的细胞器,承担着细胞进行有氧呼吸的重要职责[18]。细胞生长发育所需的能量都要依靠线粒体来提供,除此之外,细胞分化、细胞信息传递和细胞凋亡等过程也需要线粒体参与,细胞生长和细胞周期的调控也会在线粒体中发生,并可为膜电位调节及细胞程序性死亡控制提供场所[19]。因此,线粒体是抗真菌药物的潜在靶点,任何线粒体功能障碍都会导致细胞死亡[20]。虽然沙棘有许多临床疗效,但以黑曲霉的细胞膜和线粒体为靶位点,探讨沙棘油抗真菌的作用机理研究鲜见报道。本项目以沙棘油为研究对象,以黑曲霉的线粒体为靶位点,在细胞水平上研究沙棘油的抗菌机制,对于研究沙棘的抗菌机制及深度开发沙棘有一定的现实意义。
在本研究中,黑曲霉经沙棘油处理后,线粒体的超微结构变化由透射电子显微镜(transmission electron microscope,TEM)进行测定;线粒体功能的评估通过测定膜电位、活性氧(reactive oxygen species,ROS)生成、丙二醛(malondialdehyde,MDA)水平以及与三羧酸循环(tricarboxylic acid cycle,TCA)循环相关的关键酶活性来揭示,以期为沙棘油抗真菌机理的研究提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
黑曲霉(Aspergillus niger):广东省微生物菌种保存中心;沙棘油纯品:山西省山阳药业有限公司。琥珀酸脱氢酶活性测定试剂盒、ATP 酶活性测定试剂盒(Na+-K+,Ca2+-Mg2+)、丙二醛含量测定试剂盒、活性氧含量测定试剂盒:南京建成生物工程研究所;JC-1 线粒体膜电位检测试剂盒:上海翊圣生物科技有限公司。琼脂:福建泉州市泉港化工厂;吐温-20:西安天茂化工有限公司;三羟甲基氨基甲烷(trismetyl aminomethane,Tris)、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、甲萘醌:上海源叶生物有限公司;氯化钠(NaCl)、盐酸(HCl)、硫酸(H2SO4)、乙醇(含量≥95%):嘉兴市天磊化工有限公司;苯甲基黄酰氟(phenylmethanesulfonyl fluoride,PMSF)、反-4-[(2-氨基-3.5-二溴苄基)氨基]-环乙醇盐酸盐:上海瑞永生物科技有限公司,2-硫代巴比妥酸(2-thiobarbituric acid,TBA)、二甲基亚砜(dimethyl sulfoxide,DMSO):上海百舜生物科技有限公司;丙酮:成都市科隆化学品有限公司。2',7'-二氯二氢荧光素二乙酸酯(dichlorodihydrofluorescein diacetate,DCFH-DA):派科生物有限公司;以上试剂均为分析纯。
1.2 仪器与设备
紫外可见分光光度计(752N):上海精密科学仪器有限公司;水浴恒温振荡器(THZ-82A):金坛市荣华仪器制造有限公司;超声波细胞粉碎机(JY92-IIDN):宁波新芝生物科技股份有限公司;台式低速离心机(LC-4016):安徽中科中佳科学仪器有限公司;恒温振荡培养箱(THZ-98AB):天津欧诺仪器仪表公司;多功能微孔板检测仪(SYNERGY HTX):美国伯腾仪器有限公司北京代表处;超纯水器(GWA-UN4-F40):北京普析通用仪器有限责任公司。
1.3 方法
1.3.1 培养基的配制
PDA 培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,磷酸二氢钾3 g,硫酸镁1.5 g,加水定容至1 000 mL,pH自然。PDB 培养基:马铃薯200 g,葡萄糖20 g,磷酸二氢钾3 g,硫酸镁1.5 g,加水定容至1 000 mL,pH 自然。
1.3.2 黑曲霉孢子悬浮液的制备
采用无菌NaCl(0.9%)冲洗已活化黑曲霉(约2 cm×2 cm)后,将固体培养基上的菌丝体轻轻刮下,经无菌四层纱布过滤,取滤液,得到黑曲霉孢子悬浮液。离心(4 200 r/min,25 min),弃上清液,采用无菌NaCl(0.9%)溶液调整孢子悬浮液的浓度为1.0×107个孢子/mL。
1.3.3 样品的制备
在制备好的黑曲霉孢子悬浮液中添加沙棘油溶液(最终浓度为3、6、18 mL/L 和24 mL/L),同时设置对照样品。28 ℃恒温振荡(150 r/min)培养3 d 后,分离得到的菌丝体,采用无菌NaCl(0.9%)洗涤3 次,冷冻,用液氮研磨备用。
1.3.4 黑曲霉线粒体的提取
黑曲霉线粒体的提取参照文献[17]进行。称取冷冻样品2.0 g 于无菌离心管中,用无菌缓冲液(20 mmol/L Tris-HCl,5 mmol/L Na2EDTA 和15%葡萄糖,pH7.4)洗涤两次,悬浮于20.0 mL 上述无菌缓冲液中。将样品超声3 min,离心(3 000 r/min,10 min),取上清液,再次离心2 次(4 200 r/min,25 min),弃上清,收集沉淀,用1.0 mL 无菌缓冲液悬浮线粒体,-20 ℃备用。所有制备和提取步骤均在4 ℃进行。
1.3.5 黑曲霉线粒体超微结构观察
收集对照组和最大浓度沙棘油(24 mL/L)处理的细胞中的线粒体,采用2.5%戊二醛固定4 h,观察线粒体的超微结构。
1.3.6 黑曲霉线粒体酶活性测定
称取0.2 g 湿菌丝体,蒸馏水洗涤两次,经液氮研磨后,加入1.8 mL 0.9%NaCl,收集上清液得到初酶液,用于酶活性分析。三磷酸腺苷酶(adenosine triphosphatases,ATP)、琥珀酸脱氢酶(succinic dehydrogenase,SDH)和总脱氢酶(total dehydrogenase,THDA)的活性测定参考试剂盒指导。
1.3.7 黑曲霉线粒体丙二醛测定
丙二醛含量的测定同样在试剂盒指导下进行测定。
1.3.8 黑曲霉线粒体活性氧测定
在已制备好的黑曲霉孢子悬浮液中添加一定的沙棘油溶液(最终浓度为3、6、18 mL/L 和24 mL/L)后,进行培养(25 ℃,150 r/min 振荡培养)。12 h 后,离心(4 200 r/min,30 min),收集沉淀,经磷酸缓冲液(phos phate buffer solution,PBS)洗涤后重悬于500 μL PBS溶液中。加入DCFH-DA(1 mmol/L)至溶液终浓度为10 μmol/L,充分混匀,30 ℃,60 r/min 孵育4 h(以DMSO 作为溶剂对照)。将菌丝体离心收集后用PBS 冲洗,然后重悬于500 μL 的PBS 中,最后使用多功能微孔板检测仪进行时间扫描(激发波长为485 nm,发射波长为528 nm)。
1.3.9 黑曲霉线粒体中膜电位变化的测定
膜电位变化的测定根据试剂盒说明书进行测定。
1.4 数据处理
数据采用SPSS statistics 21 软件对数据进行处理和统计分析。
2 结果与分析
2.1 沙棘油对黑曲霉线粒体超微结构的影响
采用透射电镜对经过沙棘油处理后的黑曲霉线粒体超微结构进行评估,结果如图1 所示。由图1 可知,对照组和试验组的细胞线粒体在超微结构方面存在明显差异。未经过沙棘油处理的细胞(对照组)线粒体内外膜清晰,嵴肿胀正常。沙棘油处理后的细胞内的线粒体表现出空泡化、异常小泡形成以及线粒体基质结构的破坏,这些现象可以在图1B和图1D 中观察到。试验结果显示,沙棘油能够引发黑曲霉细胞线粒体结构上的损害。
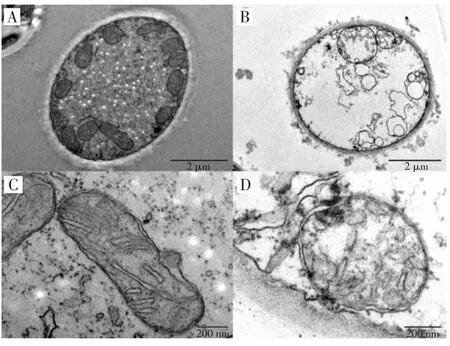
图1 沙棘油对线粒体超微结构的影响Fig.1 Effects of SBT oil on mitochondrial ultrastructure
2.2 沙棘油对黑曲霉线粒体琥珀酸脱氢酶活性的影响
沙棘油对黑曲霉线粒体琥珀酸脱氢酶活性的影响见图2。
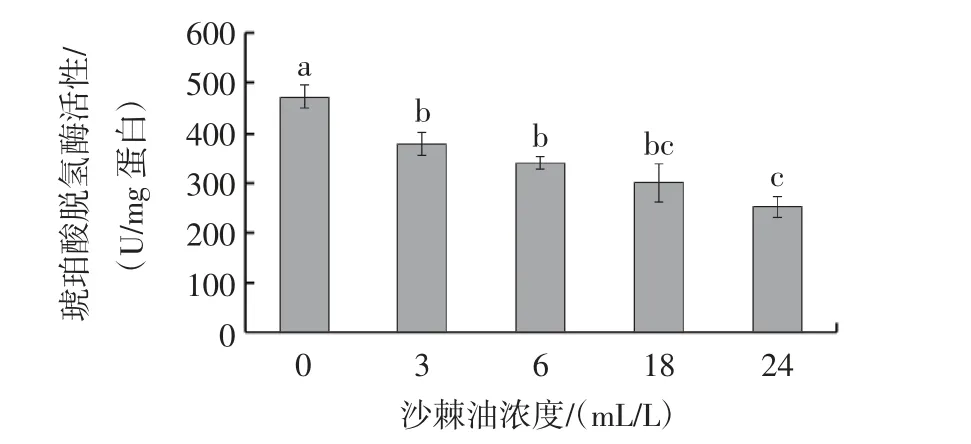
图2 沙棘油对黑曲霉线粒体琥珀酸脱氢酶活性的影响Fig.2 Effects of SBT oil on SDH activity in Aspergillus niger cells
由图2 可知,对照组测得黑曲霉线粒体中的SDH酶活性为(470.29±26.30)U/mg 蛋白。经不同浓度沙棘油处理后,黑曲霉线粒体中的SDH 活性水平下降,分别为(376.23±25.41)、(340.27±15.06)、(304.26±37.10)U/mg 蛋白质和(251.31±23.41)U/mg 蛋白。结果表明,SDH 酶活性在沙棘油处理后呈剂量依赖性降低。
2.3 沙棘油对ATP 酶活性的影响
沙棘油对ATP 酶活性的影响见图3。

图3 沙棘油对ATP 酶活性的影响Fig.3 Effects of SBT oil on ATPase activity
由图3 可知,对照组中Na+-K+ATP 酶活性为(108.94±1.98)U/mg 蛋白。用3、6、18 mL/L 和24 mL/L沙棘油处理后,Na+-K+ATP 酶活性为分别为(94.41±1.64)、(83.96±4.28)、(61.13±1.64)U/mg 蛋白和(36.71±1.07)U/mg 蛋白。并且对Ca2+-Mg2+ATP 酶活性进行测定,发现对照组的活性为(109.84±6.77)U/mg 蛋白,经不同浓度的沙棘油处理后,Ca2+-Mg2+ATP 酶活性分别为(90.52±6.77)、(67.62±0.60)、(60.92±3.91)U/mg 蛋白和(34.69±3.29)U/mg 蛋白。在沙棘油浓度为24 mL/L处理时,Na+-K+ATP 酶和Ca2+-Mg2+ATP 酶分别比对照降低66.3%和68.4%。结果表明,ATP 酶活性在沙棘油处理后呈剂量依赖性下降。
2.4 沙棘油对丙二醛含量的影响
沙棘油对丙二醛含量的影响见图4。

图4 沙棘油对丙二醛含量的影响Fig.4 Effects of SBT oil on malondialdehyde content
从图4 中可以看出,黑曲霉线粒体丙二醛含量受沙棘油的影响。对照组测得丙二醛水平为(0.46±0.02)nmol/mg 蛋白。用3、6、18 mL/L 和24 mL/L 沙棘油处理细胞后,线粒体中丙二醛含量显著升高,分别为(0.63±0.05)、(0.86±0.12)、(1.24±0.22)nmol/mg 蛋白和(4.10±0.30)nmol/mg 蛋白,均显著高于对照细胞(p<0.05)。24 mL/L 沙棘油处理的细胞比对照细胞高550.79%。
2.5 沙棘油对活性氧含量的影响
沙棘油对活性氧含量的影响见图5。

图5 沙棘油对活性氧含量的影响Fig.5 Effects of SBT oil on ROS levels
由图5 可知,黑曲霉细胞内ROS 积累与沙棘油处理有一定的关系,活性氧的积累与沙棘油的浓度呈正相关。相对于对照组细胞中的标准化水平(100.00%),用3、6、18 mL/L 和24 mL/L 沙棘油处理使ROS 水平分别增加到(158.30±14.65)%、(163.57±12.06)%、(179.35±16.43)%和(276.67±6.96)%,均高于对照细胞(p<0.05)。
2.6 沙棘油对线粒体膜电位的影响
沙棘油对黑曲霉细胞线粒体膜电位的影响见图6。

图6 沙棘油对膜电位变化的影响Fig.6 Effects of SBT oil on mitochondrial membrane potential levels
由图6 可知,线粒体膜电位在不同浓度沙棘油处理后呈剂量依赖性下降。经过12 h 处理后,在整个试验剂量范围内,膜电位下降显著,分别为(82.93±2.04)%、(59.41±3.28)%、(57.06±2.12)%和(3.52±2.12)%,均低于对照组(p<0.05)。
3 讨论与结论
沙棘油含有丰富的活性物质,针对沙棘油的研究已取得了一定的进展,但是沙棘油抗菌活性的机制的探讨比较少,有研究者发现沙棘油可抑制真菌和细菌的生长[21]。在本研究中,发现沙棘油可诱导黑曲霉细胞线粒体结构损伤(图1)。研究表明,在用茶树油处理过的灰霉病杆菌中,线粒体的外观和构造会受到破坏,这对于抑制真菌生长起到了积极作用[17]。柠檬醛能够破坏线粒体的结构,从而导致线粒体的功能发生改变,这进而限制了指状假单胞菌的生长[22]。
线粒体内的三羧酸循环需要脱氢酶这一类必不可少的酶[17]。琥珀酸脱氢酶是线粒体内膜上催化琥珀酸进行代谢的关键酶[23]。已有研究结果表明,茶树油会影响琥珀酸脱氢酶活性,而且还能介导抗真菌活性[17]。琥珀酸脱氢酶活性可以很好地反映线粒体功能障碍的程度[24-25]。研究发现,应用羽苔素E 治疗白色念珠菌时,会导致线粒体中的脱氢酶活性降低,从而抑制白色念珠菌的生长[26]。黄曲霉经莳萝挥发油处理后,其细胞膜被破坏,导致细胞内琥珀酸脱氢酶的活性下降[27]。本研究发现琥珀酸脱氢酶活性与沙棘油的浓度正相关(图2),这表明沙棘油可能引起线粒体结构改变并进一步影响线粒体功能,这与上述提到的研究结果相似。
线粒体中进行的一系列代谢反应中,三羧酸循环是较为重要的代谢途径,为细胞产生能量[28]。Li 等[18]证实灰霉病杆菌细胞内的TCA 循环受到茶树油抑制,ATP 酶活性显著降低。在本研究中,加入沙棘油培养黑曲霉时发现,ATP 酶的活性受到沙棘油的抑制(图3),从而黑曲霉的生长和存活产生了影响。
丙二醛是用来评估脂质过氧化的主要指标,当细胞膜遭受氧化损伤时,丙二醛的含量会上升[29]。有研究发现,当青霉菌经肉桂醛与柠檬醛联合处理后,细胞中的丙二醛含量明显增加[30]。研究百里酚的抗菌机制时发现,经百里酚处理的谷镰刀菌,细胞内丙二醛的水平明显升高[31]。本试验发现沙棘油可以提升黑曲霉细胞中丙二醛的积累(图4)通过影响膜流动性从而对线粒体膜造成破坏。
细胞的线粒体在呼吸变化时会产生ROS,当细胞受损时,ROS 水平会大幅上升[27]。ROS 可以通过破坏细胞核酸、酶和细胞膜,从而对细胞活力产生影响[23]。细胞凋亡和活性氧的堆积有密切的关系,除了会引发细胞核碎裂、染色体浓缩和磷脂酰丝氨酸外露等细胞器的形态学变化,活性氧的积累还可能对其他方面的细胞功能产生影响[32]。研究表明,通过使用硼酸盐处理炭疽菌孢子会引起线粒体受损,同时导致活性氧水平显著上升[33]。同样有研究证实,羽苔素E 在抑制白念珠菌生长时,检测到ROS 含量处于上升水平[26];莳萝挥发油也可以引起黄曲霉细胞细胞内ROS 含量增加,从而导致黄曲霉生长受限[27];在研究肉桂醛和柠檬醛组合抑制扩展青霉菌时发现,细胞中的ROS 水平较对照组增加了很多[30];柠檬醛还可以导致小指藻线粒体的电子呼吸链受到破坏,从而改变细胞内的ROS 水平[22]。通过使用沙棘油处理,本研究发现黑曲霉中ROS 积累增加(图5),可能是线粒体功能障碍和氧化损伤的原因。
当化合物用于治疗真菌感染时,线粒体膜电位的变化是一种明显的特征,而线粒体膜电位的丧失是细胞凋亡的一种共同表现[34]。研究表明,化合物2,5-双(4-氨基苯基)呋喃可以使酿酒酵母中的线粒体膜电位显著下降[35]。许多凋亡系统中,过量的活性氧生成是导致Δψm 去极化的主要诱因[34]。经过使用沙棘油处理的黑曲霉细胞中,膜电位的损失与ROS 的积累增加表现出一致的变化趋势(图5),同时该处理使得Δψm 值明显降低(图6)。黑曲霉会使得细胞内的ROS 增加,进而导致线粒体膜内孔洞变大,让线粒体内部更加通透,导致去极化、丢失Δψm 并最终导致细胞死亡。
本研究考察了沙棘油介导下的黑曲霉线粒体结构和功能的变化,发现沙棘油通过破坏线粒体的结构进而损伤线粒体的功能,可以为开发天然的抗真菌药物提供一定参考。
