乳铁蛋白对Dex模型小鼠肠道菌群调控研究
2023-08-12邱金玲成一新刘小凡邓阳郭丽萍龄南任广旭
邱金玲 成一新 刘小凡 邓阳 郭丽萍 龄南 任广旭
摘 要:目的:探索乳铁蛋白是否能够调节Dex模型小鼠肠道微生态结构。方法:选取40只SPF级C57BL/6小鼠,将小鼠随机分为对照组(10只)与造模组(30只),经过4周模型构建,将造模组随机分成DEX组(模型组,10只)、LF组(乳铁组,10只)和LF+WP组(乳铁+乳清组,10只),通过乳铁和乳清连续干预3周后采集样品进行肠道菌群分析。结果:乳铁蛋白能改变Dex模型小鼠腸道菌群,与DEX组相比,梭菌纲(Clostridia)、毛螺菌目(Lachnospirales)、颤螺旋菌目(Oscillospirales)、毛螺菌科(Lachnospiraceae)、普雷沃氏菌科(Prevotellaceae)的相对丰度升高;芽孢杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、丹毒丝菌目(Erysipelotrichales)以及乳杆菌科(Lactobacillaceae)相对丰度下降。结论:大剂量乳铁蛋白能够改变Dex小鼠肠道微生物结构。
关键词:乳铁蛋白;乳清蛋白;16s rDNA;肠道微生物
肌肉萎缩已成为世界上最普遍的健康问题之一,主要表现为肌肉质量和力量的丧失[1],其发生主要与蛋白质合成、分解代谢障碍有关。当蛋白质降解的速度大于合成的速度时就会发生肌肉萎缩,该疾病除了对健康造成破坏性影响外,严重时可带来生命危险。其中,以地塞米松(Dex)为代表的糖皮质激素所引发的肌肉萎缩较为迅速和严重[2],此外,已有文献报道,Dex能够改善肠道微生物组成结构。研究发现,肠道微生物在肌肉萎缩调控中发挥着重要作用[3]。因此,调整肠道微生态结构能够为改善Dex型骨骼肌状态提供可能。
牛奶作为优质的食物资源可为肌肉合成提供必需的原料供给。乳清蛋白作为牛奶中的主要蛋白质已经被广泛应用在增肌领域,但是作为牛奶中的功能性成分乳铁蛋白是否能够有相应的作用鲜有报道。目前,关于乳铁蛋白的研究多集中在抗菌[4]、抗炎、免疫调节特性[5]、肠道屏障保护等方面。研究发现,乳铁可以通过调节小鼠肠道微生物缓解脱氧雪腐镰刀菌烯醇诱导的肠道功能障碍[6]。此外,口服乳铁蛋白可以改善健康婴儿[7]和坏死性小肠结肠婴儿[8]的肠道微生物结构,这些研究提示乳铁蛋白可能改善肠道微生态结构,但乳铁蛋白是否可以改善Dex造成的菌群紊乱尚无研究报道。因此,为探究乳铁蛋白是否能改善Dex造成的肠道微生态紊乱,本研究通过构建Dex模型小鼠,以大剂量乳铁蛋白进行营养干预,并以乳清蛋白联合灌胃处理作为阳性对照,评估其对Dex小鼠肠道组成结构的影响,为未来功能性食品的开发提供科学依据。
1 材料与方法
1.1 材料
Dex,购自索莱宝生物科技有限公司(规格为100 mg),将Dex粉末溶于2 mL二甲基亚砜(DMSO),用生理盐水稀释至所需浓度后腹腔注射。乳清蛋白(规格为250 g)、乳铁蛋白(规格为10 g),购自源叶生物科技有限公司,一组为0.4 g乳铁蛋白粉末用纯水定容至10 mL进行灌胃,另一组为0.2 g乳铁和1.5 g乳清蛋白粉末混合用纯水定容至10 mL灌胃。
1.2 实验动物
40只6周龄雄性C57BL/6、SPF级小鼠,购自北京维通利华实验动物科技有限公司,体重均一(19~22 g)。所有动物均饲养于北京理工大学SPF级动物房。小鼠饲养在通风洁净的动物室内,室温18~23℃,相对湿度45%~55%,光照节律12 h/12 h,控制自然饮食。
1.3 方法
动物适应性饲养1周,控制自然饮食。适应性饲养结束后,随机将小鼠分成2组:(1)对照组10只,间隔1天腹腔注射生理盐水(0.9%)。(2)造模组30只,间隔1天腹腔注射地塞米松(25 mg/kg),共注射4周。造模成功之后,10只对照组小鼠仍正常喂养,将造模组30只小鼠分为3组:(1)DEX组;(2)LF组;(3)LF+WP组,分别给予地塞米松腹腔注射(25 mg/kg)、乳铁蛋白灌胃(40 mg/mL)、乳铁蛋白、乳清蛋白(0.17 g/mL)混合灌胃,每天1次,在持续灌胃3周后采集的所有粪便样本,立即储存 -80℃冰箱直至分析。
1.4 体重、抓力、采食量的测量
每周于同一时间进行抓力、采食量和体重检测,记录至干预结束。用电子天平称量体重和采食量。使用抓力仪测定小鼠的抓力,抓住小鼠尾巴,使其前肢能够抓住金属网,然后轻轻地把小鼠向后拉,直到它们松开网格,记录数据。
1.5 肠道微生物多样性检测
干预结束后,对最后一批粪便采用16s rDNA测序技术对肠道微生物的多样性进行检测。根据说明提取样品中总DNA,完成基因组DNA抽提后,进行PCR扩增,使用1.0%琼脂糖凝胶电泳检测扩增目的条带大小,并用Agencourt AMPure XP核酸纯化试剂盒纯化。用上游引物序列:5-ACTCCTACGGGAGGCAGCAG-3;下游引物序列:5-GGACTACHVGGGTWTCTAAT-3,对16S rDNA的V3 ~ V4可变区进行PCR扩增。扩增程序:94℃预变性5 min、94℃变性30 s、50℃退火30 s、72℃延伸60 s,30个循环后再72℃延伸7 min。所有测序均由北京奥维森基因科技有限公司完成。
1.6 测序数据处理与分析
原始数据下机结果以Fastq格式存储,对测得的Fastq数据进行质控处理,利用Flash、Pear软件对两端序列进行拼接处理,进一步去除Fasta序列的嵌合体和不合要求短序列,获得优质Fastq数据。然后去除barcode和primer并拼接后得到raw_tags,进一步去除嵌合体、短序列后得到clean_tags。将clean_tags用uparse聚类生成操作分类单元(OTUs),对97%相似水平下的OTU进行生物信息统计分析。通过分析稀释曲线判断测序深度和合理性。
1.7 统计分析
采用SPSS 22.0软件进行单因素方差分析,数据用(平均值±标注差)表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 干预完成后各组指标的变化
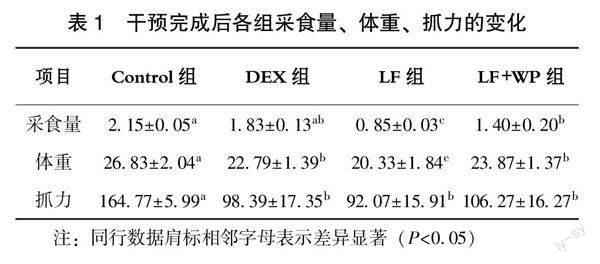
小鼠在适应性饲养结束后,除对照组外,其余小鼠腹腔注射地塞米松进行肌肉萎缩模型构建,连续注射4周后,小鼠肌肉萎缩模型构建成功。对其进行不同的处理,分别用Dex、乳鐵蛋白、乳铁蛋白+乳清蛋白进行干预,连续3周。从表1看出,干预完成后LF组的采食量、体重、抓力均显著低于对照组(P<0.05),与DEX组相比,LF+WP组的采食量、体重、抓力无显著差异(P>0.05)。
2.2 各组有效数据统计及优质序列长度分布
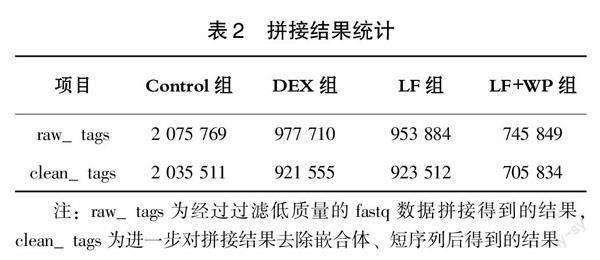
利用高通量测序获得对照组、DEX组、LF组、LF+WP组肠道微生物的序列,其中,LF+WP组样品得到的clean_tags最少(705 834条),对照组最多(2 035 511条)。各组一共获得4 753 212条raw_tags,经拼接、过滤后产生4 586 412条clean_tags,有效序列所占比例为96.5%,由此看出样品的测序准确度较好(表2)。
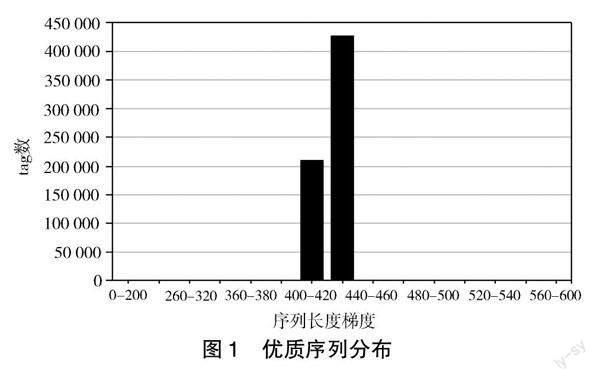
如图1所示,经过数据预处理最终得到的优质序列大多集中在400 ~ 420和420 ~ 440之间,少量的集中在260 ~ 320、320 ~ 360、360 ~ 380、440 ~ 480、480 ~ 500,而0 ~ 200、200 ~ 260、520 ~ 540、540 ~ 560、560 ~ 600之间为0。
2.3 稀释性曲线
不同测序数据量样品的物种丰富度可以通过稀释曲线得到,也可以用来解释样品测序数据是否合理。由图2显示,当测序深度达到28 000 reads时,样品的稀释曲线趋于平滑,说明本实验的测序结果能较好地反映当前所有样本中所包含的多样性且测序数据合理。
2.4 各组间纲、目水平下的肠道微生物组成
由图3可知,在纲水平上,拟杆菌纲(Bacteroidia)、梭菌纲(Clostridia)、芽孢杆菌纲(Bacilli)是四组共有的优势菌,占比达到了90%。与对照组相比,DEX组、LF组、WP+LF组中的拟杆菌纲(Bacteroidia)相对丰度呈显著下降的趋势,由原来的62.9%下降至32.2%、38.4%、40.0%;而梭菌纲(Clostridia)在DEX组的相对丰度变化不大,但在LF组和LF+WP组中显著上升;芽孢杆菌(Bacilli)在DEX组中呈显著上升的趋势,从10.6%(对照组)上升到30.9%(DEX组),经过乳铁和乳铁+乳清蛋白干预后,与DEX组相比显著下降,下降至10%(LF组)和14.5%(LF+WP组)。
在目水平上,DEX组、LF组和LF+WP组与对照组小鼠肠道菌群结构组成无较大差异,由图4可知,与对照组相比,在DEX组、LF组、LF+WP组中的拟杆菌目(Bacteroidales)相对丰度降低,所占比例从62.9%(对照组)下降到32.2%(DEX组)、38.4%(LF组)、43.1%(LF+WP组);而Lachnospirales相对丰度增加,所占比例从13.6(对照组)上升到21.3%(DEX组)、32.3%(LF组)、28.4%(LF+WP组)。与对照组相比,乳杆菌目(Lactobacillales)在DEX组中显著上升,经过乳铁蛋白干预后,在LF组和LF+WP组显著下降。
2.5 各组间科、种水平下的肠道微生物组成
由图5可知,在科水平上,对照组中相对丰度最高的是鼠杆状菌科(Muribaculaceae),其次是毛螺菌科(Lachnospiraceae)。与对照组相比,鼠杆状菌科(Muribaculaceae)的相对丰度显著下降,各组所占比例从56.8%(对照组)下降至25.4%(DEX组)、25.1%(LF组)、30.7%(LF+WP组);毛螺菌科(Lachnospiraceae)的相对丰度呈上升的趋势,所占比例从13.6%(对照组)上升至21.3%(DEX组)、32.2%(LF组)、28.4%(LF+WP组)。与DEX组相比,毛螺菌科(Lachnospiraceae)在LF组和LF+WP组中的相对丰度呈上升的趋势,而乳杆菌科(Lactobacillaceae)的相对表达丰度显著下降。与对照组相比,乳铁蛋白显著提高了肠道中的普雷沃氏菌科(Prevotellaceae)相对丰度,显著降低了丹毒丝菌科(Erysipelotrichaceae)的相对丰度。
各组小鼠肠道微生物组成在种水平上的相对丰度如图6所示,各组中未分类的菌达到了67%~87%。与对照组相比,Lactobacillus_murinus_DSM_20452_NBRC_14221在DEX组呈显著上升的趋势,在LF组和LF+WP组中呈现显著下降的趋势。与对照组相比,DEX组中的Lactobacillus_acidophilus_CFH呈上升趋势,经过乳铁蛋白干预后,在LF组和LF+WP组中下降。
3 讨论
肌肉在全身代谢中起着核心作用,在许多慢性疾病的起源和预防中起关键作用。小鼠肠道是营养物质消化吸收和机体免疫的器官,越来越多的证据表明,肠道微生物在肌肉相关疾病的发展中起着重要作用。在本研究中,给C57BL/6小鼠腹腔注射地塞米松以诱导肌肉萎缩,用乳铁蛋白进行干预,通过从各个水平对各组间的肠道内容物物种菌群的组成分析发现,乳铁蛋白干预能够改变小鼠肠道菌群,同时会增加部分有益菌。
在纲水平上,与DEX组相比,LF组梭菌纲(Clostridia)相对表达丰度上升,梭菌纲(Clostridia)中的许多细菌对人类和其他生物具有益处,可以帮助人体消化、保护免疫系统,同时产生有益物质,是人体必需的微生物之一。通过实验发现地塞米松处理会导致拟杆菌纲(Bacteroidia)的相对丰度下降,而经过乳铁蛋白干预后,发现其丰度值呈上升趋势。研究表明拟杆菌属具有广泛的糖解潜力,可以产生短链脂肪酸,促进小鼠对营养物质的消化吸收,能够维持肠道稳态,促进宿主肠道健康[9]。在目水平上,乳铁蛋白干预能够提高小鼠菌群中拟杆菌目的相对丰度[10],与赵方舟等对哺乳仔猪结果一致。在科水平上,与DEX组相比,乳铁蛋白干预显著提高了肠道中的普雷沃氏菌科(Prevotellaceae)和乳杆菌科(Lactobacillaceae)相对丰度,同时降低了丹毒丝菌科(Erysipelotrichaceae)的相对丰度。普雷沃氏菌科(Prevotellaceae)能够产生一些有益的代谢产物如短链脂肪酸,对肠粘膜屏障起到保护作用[11]。Gopal等[12]研究发现,乳杆菌属(Lactobacilli)作为益生菌,具有抑制致病菌株侵袭的能力,免受肠道病原体的侵害。
此外,还观察到大剂量的乳铁冲击会造成小鼠体重、采食量显著下降(P<0.05),小鼠粪便较少且坚硬干结。乳铁蛋白在牛奶中含量较少,在消化过程中少量主要发挥炎症调控作用,大剂量的乳铁蛋白干预产生的菌可能会引发便秘。研究发现颤螺菌属(Oscillospira)能产生丁酸盐等短链脂肪酸,被列为下一代益生菌的候选者[13],其与肥胖、消瘦、胆结石和慢性便秘、炎症性疾病等[14]相关。一项研究表明,较高丰度的颤螺菌属(Oscillospira)与便秘呈正相关[15]。另一项针对欧洲成年人肠道微生物群和粪便软硬度的研究表明,颤螺菌属(Oscillospira)丰度值与较硬的粪便呈正相关,与稀便呈负相关[16],与本试验结果一致。研究发现,双歧杆菌属(Bifidobacterium)能够产生乳酸和乙酸,降低结肠中的pH值,较低的pH可以刺激蠕动并减少结肠转运时间,从而有助于缓解便秘[17]。
4 结论
综上所述,乳铁蛋白能够改变Dex模型小鼠的肠道微生态结构,同时会增加部分有益菌,包括梭菌纲(Clostridia)、拟杆菌纲(Bacteroidia)、乳杆菌目(Lactobacillales)、乳杆菌科(Lactobacillaceae)、普雷沃氏菌科(Prevotellaceae)。
参考文献
[1]Cruz-Jentoft A J,Bahat G,Bauer J,et al. Sarcopenia:revised European consensus on definition and diagnosis [J].Age Ageing,2019,48(1):16-31.
[2]LI J X,Cummins C L. Fresh insights into glucocorticoid-induced diabetes mellitus and new therapeutic directions [J].Nat Rev Endocrinol,2022,18(9):540-557.
[3]REN G,ZHANG J,LI M,et al. Gut microbiota composition influences outcomes of skeletal muscle nutritional intervention via blended protein supplementation in posttransplant patients with hematological malignancies [J].Clin Nutr,2021,40(1):94-102.
[4]Valenti P,Antonini G. Lactoferrin:an important host defence against microbial and viral attack [J].Cell Mol Life Sci,2005,62(22):2576-2587.
[5]YAO Q,LI H,FAN L,et al. The combination of lactoferrin and linolenic acid inhibits colorectal tumor growth through activating AMPK/JNK-related apoptosis pathway [J].PeerJ,2021,9:e11072.
[6]HU P,ZONG Q,ZHAO Y,et al. Lactoferrin Attenuates Intestinal Barrier Dysfunction and Inflammation by Modulating the MAPK Pathway and Gut Microbes in Mice [J].The Journal of Nutrition,2022,152(11):2451-2460.
[7]Roberts A K,Chierici R,Sawatzki G,et al. Supplementation of an adapted formula with bovine lactoferrin:1. Effect on the infant faecal flora [J].Acta Paediatr,1992,81(2):119-124.
[8]Vongbhavit K,Underwood M A. Prevention of Necrotizing Enterocolitis Through Manipulation of the Intestinal Microbiota of the Premature Infant [J].Clin Ther,2016,38(4):716-732.
[9]HE J,GUO H,ZHENG W,et al. Heat stress affects fecal microbial and metabolic alterations of primiparous sows during late gestation [J].J Anim Sci Biotechnol,2019,10:84.
[10]趙方舟,胡平,汪晶,等. 早期乳铁蛋白干预对哺乳仔猪盲肠菌群结构、短链脂肪酸含量及黏膜炎症因子水平的影响 [J].南京农业大学学报,2021,44(1):151-159.
[11]Yachida S,Mizutani S,Shiroma H,et al. Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer [J].Nat Med,2019,25(6):968-976.
[12]Grigoryan S,Bazukyan I,Trchounian A. Aggregation and Adhesion Activity of Lactobacilli Isolated from Fermented Products In Vitro and In Vivo:a Potential Probiotic Strain [J].Probiotics Antimicrob Proteins,2018,10(2):269-276.
[13]YANG J,LI Y,WEN Z,et al. Oscillospira - a candidate for the next-generation probiotics [J].Gut Microbes,2021,13(1):1987783.
[14]Konikoff T,Gophna U. Oscillospira:a Central,Enigmatic Component of the Human Gut Microbiota [J].Trends Microbiol,2016,24(7):523-524.
[15]Parthasarathy G,CHEN J,CHEN X,et al. Relationship Between Microbiota of the Colonic Mucosa vs Feces and Symptoms,Colonic Transit,and Methane Production in Female Patients With Chronic Constipation [J].Gastroenterology,2016,150(2):367-79 e1.
[16]Tigchelaar E F,Bonder M J,Jankipersadsing S A,et al. Gut microbiota composition associated with stool consistency [J].Gut,2016,65(3):540-542.
[17]LIU J,HUANG X E. Efficacy of Bifidobacterium tetragenous viable bacteria tablets for cancer patients with functional constipation [J].Asian Pac J Cancer Prev,2014,15(23):10241-10244.
Study on The Regulation of Intestinal Flora in Dex Model Mice by Lactoferrin
QIU Jin-ling1,2,3,CHENG Yi-xin2,LIU Xiao-fan2,DENG Yang1,3,
GUO Li-ping1,3,LING Nan4,REN Guang-xu1,2
(1 College of Food Science and Engineering,Qingdao Agricultural University,Qingdao 266109,China;
2 Institute of Food and Nutrition Development,Ministry of Agriculture and Rural Affairs,Beijing 100081,China;
3 Qingdao Institute of Special Food,Qingdao 266109,China;4Nanjing Weigang Dairy Co.,Ltd.,Nanjing 211100,China)
Abstract:ObjectiveTo explore whether lactoferrin can regulate intestinal microecological structure in Dex model mice.MethodTotally 40 SPF C57BL/6 mice were selected and randomly divided into control group (10 mice) and modeling group (30 mice). After 4-week model construction,the modeling group was randomly divided into DEX group (10 mice),LF group (10 mice) and LF+WP group (10 mice). Samples were collected for intestinal flora analysis after 3 weeks of continuous intervention with milk iron and whey.ResultLactoferrin can change intestinal flora of Dex model mice,and compared with DEX group,The relative abundance of Clostridia,Lachnospirales,Oscillospirales,Lachnospiraceae and Prevotellaceae increased. The relative abundance of Bacilli,Lactobacillales,Erysipelotrichales and Lactobacillaceae declined.ConclusionLarge doses of lactoferrin could change the intestinal microbial structure of Dex mice.
Keywords:lactoferrin; whey protein; 16s rDNA; intestinal microbe
基金項目:北京自然科学基金面上项目(项目编号:7192241);国家重点研发计划资助(项目编号:2022YFD1301005)。
作者简介:邱金玲(1996— ),女,在读硕士研究生,研究方向:食品加工与安全。
通信作者:任广旭(1985— ),男,博士,副研究员,研究方向:食物营养与健康。
