Ni-Nb2O5/γ-Al2O3催化1,5-双-(四氢呋喃基)-3-戊酮加氢脱氧制备长链烷烃的研究
2023-08-10陶志平贾丹丹伏朝林朱忠朋郑伟平
闫 瑞,赵 杰,陶志平,杨 鹤,贾丹丹,伏朝林,朱忠朋,郑伟平
(中石化石油化工科学研究院有限公司,北京 100083)
生物质是唯一含有碳源的可再生能源,通过相关技术将其转化为液体燃料,可以满足碳排放要求[1-4]和缓解石油危机。目前,我国每年约产生1 Gt农林废弃物,其主要成分为木质纤维素。木质纤维素一般包括纤维素、半纤维素和木质素[5];其制备液体燃料的途径主要有4种:①水解-发酵法[6];②水解-催化法[6];③气化-费托法[7];④热解[8]/液化[9]法。其中,水解-催化法将木质纤维素水解得到糖平台化合物,再从分子层面进行转化利用,因整体生产效率更高而受到学术界的普遍关注。

1,5-双-(四氢呋喃基)-3-戊酮(BTHFP)是由木质纤维素水解/发酵产物糠醛和丙酮经羟醛缩合-加氢饱和得到的一种典型生物燃料含氧中间体,由其加氢脱氧可以制备低碳烃类液体燃料,本课题以其为原料进行加氢脱氧催化剂反应性能评价。考虑到Ni具有良好的加氢活性[15-17]、Nb2O5具备良好的断裂碳氧键能力和水热稳定性[14,18-24],本研究设计以γ-Al2O3为酸性载体、非贵金属Ni和Nb2O5为活性中心的Ni-Nb2O5/γ-Al2O3催化剂,考察催化剂中Ni、Nb2O5含量和反应工艺条件对BTHFP加氢脱氧制备长链烷烃反应性能的影响。
1 实 验
1.1 试验原料和试剂
试验使用的原料和试剂如表1所示。

表1 试验原料和试剂
1.2 试验仪器与设备
试验使用的仪器和设备如表2所示。

表2 试验仪器与设备
1.3 反应过程
BTHFP加氢脱氧制备长链烷烃的反应过程如图1所示。
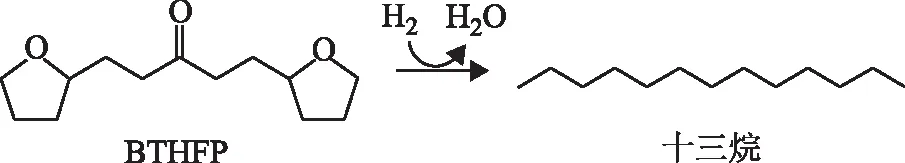
图1 BTHFP加氢脱氧制备长链烷烃的反应过程
1.4 催化剂的制备
采用等体积浸渍法制备Ni-Nb2O5/γ-Al2O3催化剂。称取10 g γ-Al2O3置于烧杯中,再分别称取0.50xg六水合硝酸镍和0.20yg五氯化铌溶于2 g去离子水中,混匀后浸渍到γ-Al2O3上,搅拌均匀后静置12 h。然后,放入鼓风干燥箱中100 ℃下干燥12 h,再将干燥后催化剂置于马弗炉中于500 ℃下焙烧,最后在管式反应炉中于500 ℃下氢气还原制得Ni-Nb2O5/γ-Al2O3催化剂,命名为x%Ni-y%Nb2O5/γ-Al2O3。其中:x%为催化剂中Ni质量分数,x=1,2,3,4,5;y%为催化剂中Nb2O5质量分数,y=10,20。
1.5 催化剂的表征
采用日本理学电机工业株式会社生产的D max-2600 PC型X射线衍射(XRD)仪进行XRD表征。测试条件:Cu靶Kα射线(波长λ=0.154 06 nm),扫描速率为5(°)/min,扫描范围为10°~80°,步长为0.02,管电流为100 mA,管电压为40 kV。
采用美国Baird公司生产的PS-4型电感耦合等离子发射光谱(ICP-AES)仪测定Ni-Nb2O5/γ-Al2O3催化剂中Ni和Nb2O5的含量。测试条件:载气流量为0.6 L/min,辅助气体流量为1.2 L/min,射频功率为1 500 W。
采用美国Quanta-chrome公司生产的AUTOSORB-1-MP型N2吸附-脱附仪测定催化剂的孔结构参数,以N2为吸附质,Ar为平衡气。测试条件:液氮温度吸附,室温脱附。采用BET方法计算试样的比表面积。
采用美国Micromeritics公司生产的AutoChemⅡ2950型多功能程序吸附仪对催化剂进行H2程序升温还原(H2-TPR)分析。测试条件:H2-Ar混合气(其中H2体积分数为10%),气体流速为50 mL/min,升温速率为10 ℃/min,温度范围为50~900 ℃。
采用美国FEI公司生产的Tecnai G2 F20 S-TWIN型透射电子显微镜(TEM)观察催化剂中金属颗粒的分布情况,选择加速电压为200 kV。
采用美国FEI公司生产的Quan TA-400F型扫描电子显微镜(SEM)观测Ni-Nb2O5/γ-Al2O3催化剂的形貌,扫描电压为20 kV。
1.6 BTHFP加氢脱氧试验
1.6.1 催化剂的活性评价
将0.4 gx%Ni-y%Nb2O5/γ-Al2O3催化剂、2 g BTHFP和18 g环己烷依次放入高压反应釜的内衬中,拧紧反应釜,经氢气反复置换釜内空气后充压至5 MPa。开启搅拌,在转速600 r/min、温度260 ℃下反应24 h。反应结束后,取上层油相样品,经GC-MS和GC分别进行定性和定量分析。
1.6.2 加氢脱氧工艺条件优化及稳定性评价
将3.0 g经活性评价后优选的Ni-Nb2O5/γ-Al2O3催化剂(20~40目)和15.0 g石英砂(20~40目)混合均匀,装填至固定床反应装置的不锈钢反应管恒温段中,并用石英砂填满反应管中的非恒温段。拧紧反应管,经氢气吹扫管线内空气后,将反应管保持一定温度和压力。以环己烷为溶剂,配制BTHFP质量分数为10%的混合溶液,在一定空速和氢油比下将混合溶液注入反应系统,反应产物进入产品收集罐。每隔2 h取产品收集罐的上层油相样品,经GC-MS和GC分别进行定性和定量分析,然后按照式(1)~式(3)计算BTHFP转化率、长链烷烃(C11~C13烷烃)的选择性和碳摩尔收率。
(1)
(2)
Y=C×S
(3)
式中:C为BTHFP转化率,%;M′为产物中残余BTHFP的质量,g;M为原料中BTHFP的质量,g;D1为油相产物中长链烷烃的色谱峰总面积;D为油相产物中所有物质的色谱峰总面积;Y为长链烷烃的碳摩尔收率。
2 结果和讨论
2.1 Ni-Nb2O5/γ-Al2O3催化剂表征结果
2.1.1 XRD
对Nb2O5质量分数为10%、Ni含量不同的x%Ni-10%Nb2O5/γ-Al2O3催化剂进行XRD表征,结果如图2所示。由图2可以看出:各催化剂均在2θ为37.1°,46.2°,66.9°处存在γ-Al2O3的衍射峰;图中没有明显的Ni衍射特征峰,这是由Ni衍射特征峰被γ-Al2O3衍射特征峰掩盖所致;图中也没有明显的Nb2O5衍射特征峰,说明催化剂中Nb2O5以无定型的结构存在。此外,x%Ni-10%Nb2O5/γ-Al2O3催化剂的晶相随着Ni负载量的升高没有明显变化。

图2 不同Ni含量催化剂的XRD图谱 —1%Ni-10%Nb2O5/γ-Al2O3; —2%Ni-10%Nb2O5/γ-Al2O3; —3%Ni-10%Nb2O5/γ-Al2O3; —4%Ni-10%Nb2O5/γ-Al2O3; —5%Ni-10%Nb2O5/γ-Al2O3; —γ-Al2O3;
2.1.2 ICP-AES
以4%Ni-10%Nb2O5/γ-Al2O3和4%Ni-20%Nb2O5/γ-Al2O3为代表,采用ICP-AES仪测定催化剂中Ni和Nb2O5的含量,以检测实际催化剂中活性组分含量是否满足设计要求,结果如表3所示。由表3可以看出,在一定误差范围内,采用等体积浸渍法制备的4%Ni-10%Nb2O5/γ-Al2O3和4%Ni-20%Nb2O5/γ-Al2O3催化剂中Ni含量和Nb2O5含量与理论值接近,说明在浸渍过程中,前躯体溶液中的Ni和Nb物种基本都负载到了催化剂上。

表3 4%Ni-10%Nb2O5/γ-Al2O3和4%Ni-20%Nb2O5/γ-Al2O3的ICP-AES表征结果
2.1.3 N2吸附-脱附
4%Ni-10%Nb2O5/γ-Al2O3和4%Ni-20%Nb2O5/γ-Al2O3的N2吸附-脱附曲线如图3所示。由图3可知,两个催化剂样品均符合IUPAC定义的第Ⅳ类吸附-脱附等温线特征,即存在H1型滞后环和毛细凝结的多层吸附情况,是介孔材料普遍存在的吸附特征。此外,两种催化剂样品的孔结构参数如表4所示。由表4可知:4%Ni-10%Nb2O5/γ-Al2O3和4%Ni-20%Nb2O5/γ-Al2O3的比表面积分别为212 m2/g和213 m2/g,基本相同;但4%Ni-10%Nb2O5/γ-Al2O3的平均孔径和孔体积均略大于4%Ni-20%Nb2O5/γ-Al2O3,这可能是由催化剂制备过程中Nb2O5进入γ-Al2O3载体孔道所致。
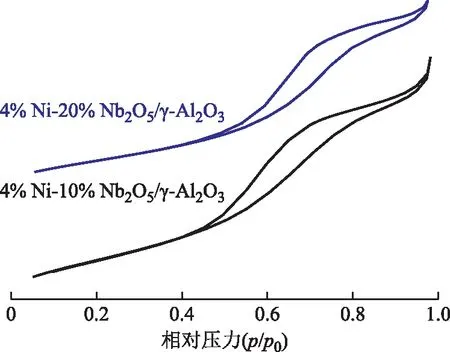
图3 4%Ni-10%Nb2O5/γ-Al2O3和4%Ni-20%Nb2O5/γ-Al2O3的N2吸附-脱附曲线

表4 4%Ni-10%Nb2O5/γ-Al2O3和4%Ni-20%Nb2O5/γ-Al2O3的孔结构参数
2.1.4 H2-TPR
根据XRD和N2吸附-脱附表征结果,随着Ni含量和Nb2O5含量的变化,Ni-Nb2O5/γ-Al2O3催化剂的晶相和孔结构参数没有明显变化。因此,为考察催化剂的H2还原温度,仅对4%Ni-20%Nb2O5/γ-Al2O3催化剂进行H2-TPR表征,结果如图4所示。由图4可知,催化剂分别在390 ℃和680 ℃前后出现还原峰,分别对应NiO和Nb2O5的还原特征峰。考虑到Nb2O5在加氢脱氧反应中活化断裂碳氧键的独特作用,优选的催化剂还原温度为400~600 ℃。

图4 4%Ni-20%Nb2O5/γ-Al2O3的H2-TPR曲线
2.1.5 SEM
为观察4%Ni-20%Nb2O5/γ-Al2O3催化剂的微观形貌,对其进行SEM形貌表征,结果如图5所示。由图5可以看出,催化剂整体呈形状不规则的块状结构,其中分布有疏松的孔道。

图5 4%Ni-20%Nb2O5/γ-Al2O3的SEM照片
2.1.6 TEM
为观察4%Ni-20%Nb2O5/γ-Al2O3催化剂中金属颗粒的分布情况,对其进行TEM表征,其TEM照片见图6,金属粒径分布见图7。由图6和图7可知:催化剂上主要分布着直径5~15 nm的金属颗粒,未出现明显结块现象;图片上的衬度差异可能是由金属的高度密集[25-26]所致。

图6 4%Ni-20%Nb2O5/γ-Al2O3的TEM照片
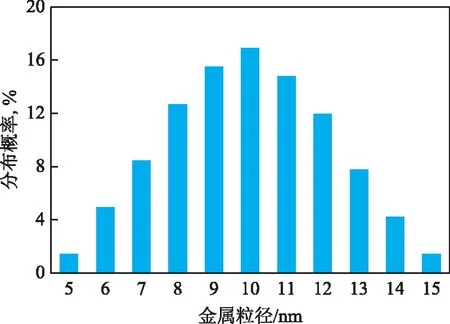
图7 4%Ni-20%Nb2O5/γ-Al2O3的金属粒径分布
2.2 Ni和Nb2O5含量对Ni-Nb2O5/γ-Al2O3催化剂加氢脱氧性能的影响
2.2.1 Ni含量的影响
采用等体积浸渍法分别制备x%Ni-10%Nb2O5/γ-Al2O3催化剂(x=1,2,3,4,5),应用于BTHFP加氢脱氧反应中。在反应温度为260 ℃、H2压力为5 MPa、反应时间为24 h的条件下,不同Ni含量催化剂作用下的C11~C13烷烃的碳摩尔收率如表5所示。由表5可以看出:随着x%Ni-10%Nb2O5/γ-Al2O3催化剂中Ni含量的增加,C11~C13烷烃的碳摩尔收率呈现增加的趋势;当Ni质量分数为4%时,C11烷烃、C12烷烃和C13烷烃的碳摩尔收率分别为4.1%,11.4%,64.9%,C11~C13烷烃的碳摩尔收率总和达80.4%;当Ni质量分数增大到5%时,C11~C13烷烃的碳摩尔收率总和基本不变。
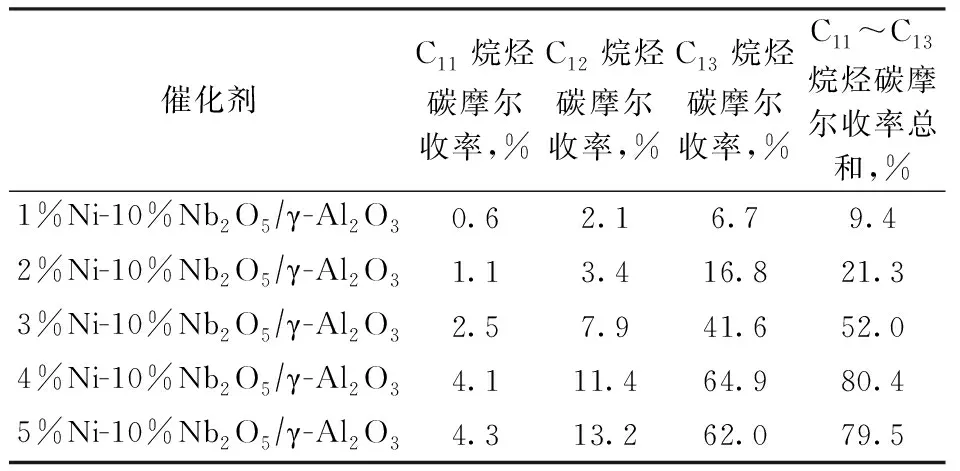
表5 不同Ni含量Ni-Nb2O5/γ-Al2O3催化剂的加氢脱氧反应性能
2.2.2 Nb2O5含量的影响
由于Nb2O5含量是影响Ni-Nb2O5/γ-Al2O3催化剂成本的关键因素,为降低催化剂成本,采用等体积浸渍法制备4%Ni-y%Nb2O5/γ-Al2O3催化剂(y=10,20),应用于BTHFP加氢脱氧反应中。在反应温度为260 ℃、H2压力为5 MPa、反应时间为24 h的条件下,不同Nb2O5含量催化剂的C11~C13烷烃的碳摩尔收率如表6所示。由表6可以看出,与4%Ni-10%Nb2O5/γ-Al2O3相比,4%Ni-20%Nb2O5/γ-Al2O3的催化加氢脱氧活性更佳,其作用下C11烷烃、C12烷烃和C13烷烃的碳摩尔收率分别为3.8%,8.9%,76.9%,C11~C13烷烃的碳摩尔收率总和高达89.6%,这验证了Nb2O5具有良好的活化断裂碳氧键的能力。
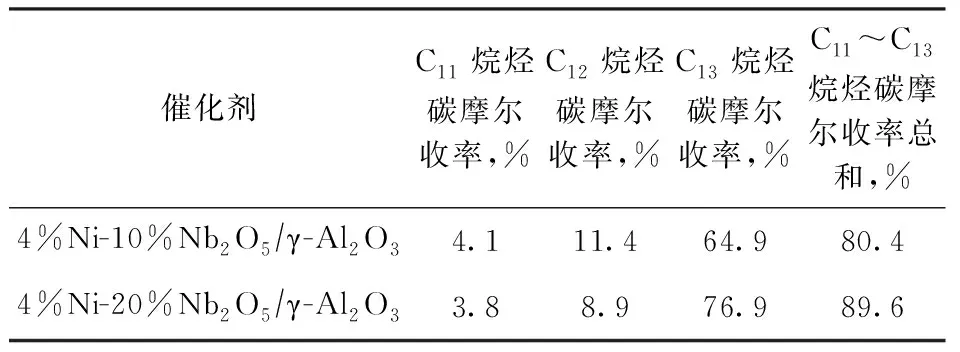
表6 不同Nb2O5含量Ni-Nb2O5/γ-Al2O3催化剂的加氢脱氧反应性能
2.3 工艺条件对加氢脱氧反应性能的影响
2.3.1 反应温度的影响
采用优化的4%Ni-20%Nb2O5/γ-Al2O3催化剂,在H2压力为5 MPa、反应时间为16 h的条件下,考察反应温度对BTHFP加氢脱氧反应的影响,结果如表7所示。由表7可以看出:当反应温度为220 ℃时,C11~C13烷烃的碳摩尔收率总和仅为9.6%,加氢脱氧反应程度较低;当反应温度升高至260 ℃,C11烷烃、C12烷烃和C13烷烃的碳摩尔收率分别为3.5%,8.1%,67.5%,C11~C13烷烃的碳摩尔收率总和达到79.1%;当反应温度继续升高至280 ℃,C11~C13烷烃的碳摩尔收率总和没有明显变化,但C11烷烃和C12烷烃的碳摩尔收率分别增加至9.1%和22.4%,C13烷烃的碳摩尔收率减少至47.5%。
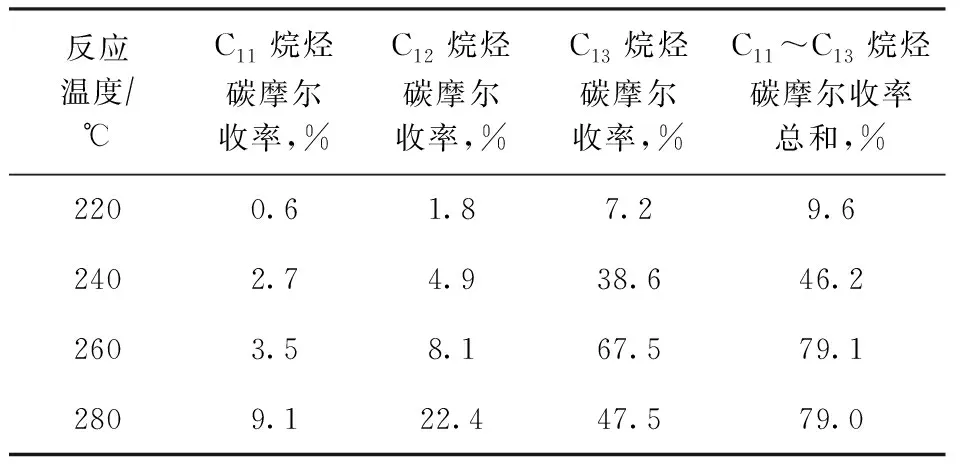
表7 反应温度对4%Ni-20%Nb2O5/γ-Al2O3催化剂加氢脱氧性能的影响
2.3.2 反应压力的影响
为研究反应压力对BTHFP加氢脱氧反应的影响,采用优化的4%Ni-20%Nb2O5/γ-Al2O3催化剂,控制反应温度260 ℃和反应时间24 h,考察H2压力分别为3,4,5 MPa时的C11~C13烷烃的碳摩尔收率,结果如表8所示。由表8可以看出,不同H2压力下,C11烷烃、C12烷烃和C13烷烃的碳摩尔收率没有明显变化,说明在一定的H2压力范围内反应压力对加氢脱氧性能的影响不大。
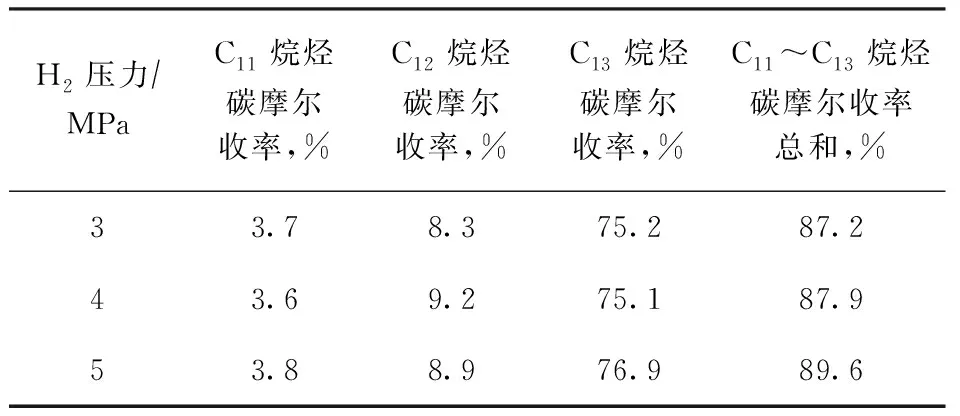
表8 反应压力对4%Ni-20%Nb2O5/γ-Al2O3催化剂加氢脱氧性能的影响
2.3.3 反应时间的影响
采用优化的4%Ni-20%Nb2O5/γ-Al2O3催化剂,在反应温度为260 ℃、H2压力为3 MPa的条件下,考察反应时间对BTHFP加氢脱氧反应的影响,结果如表9所示。由表9可以看出:当反应时间为8 h时,C11~C13烷烃的碳摩尔收率总和为37.3%;随着反应时间延长,C11~C13烷烃的碳摩尔收率总和不断提高,加氢脱氧反应愈加完全;当反应时间为24 h时,C11烷烃、C12烷烃和C13烷烃的碳摩尔收率分别为3.8%,8.9%,76.9%,C11~C13烷烃的碳摩尔收率总和达89.6%;继续延长反应时间至32 h,C11~C13烷烃的碳摩尔收率没有明显变化。
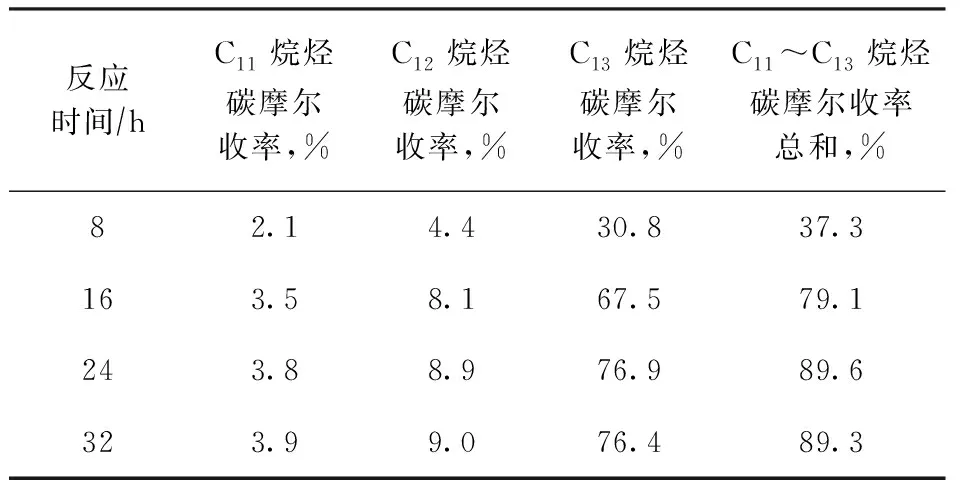
表9 反应时间对4%Ni-20%Nb2O5/γ-Al2O3催化剂加氢脱氧性能的影响
2.4 Ni-Nb2O5/γ-Al2O3催化剂的稳定性
催化剂良好的稳定性是保证装置稳定运行的关键,采用微型固定床反应装置对4%Ni-20%Nb2O5/γ-Al2O3催化剂的稳定性进行评价。在反应温度为260 ℃、H2压力为3 MPa、体积空速为2 h-1、氢油体积比为200的条件下,将以环己烷为溶剂、BTHFP质量分数为10%的混合溶液注入装置,反应后产物冷却,每隔2 h取出反应液进行定性和定量分析。稳定性评价结果如图8所示。由图8可以看出,4%Ni-20%Nb2O5/γ-Al2O3催化剂连续加氢脱氧70 h时,C11~C13烷烃的碳摩尔收率总和高达89.5%,其中C11烷烃、C12烷烃和C13烷烃的碳摩尔收率分别为4.1%,9.2%,76.2%,说明4%Ni-20%Nb2O5/γ-Al2O3催化剂具有良好的稳定性。
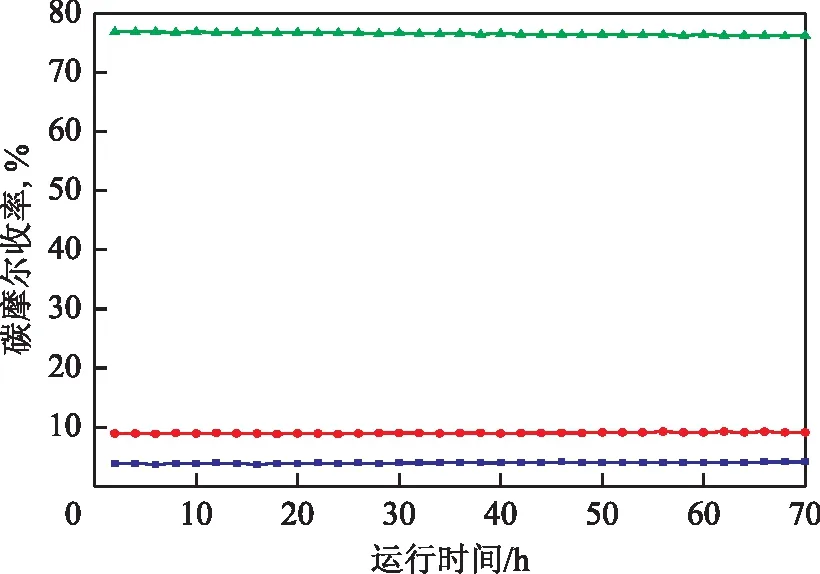
图8 4%Ni-20%Nb2O5/γ-Al2O3催化剂加氢脱氧稳定性评价结果▲—C13烷烃; ●—C12烷烃; ■—C11烷烃
3 结 论
设计了以γ-Al2O3为酸性载体、非贵金属Ni和Nb2O5为活性中心的Ni-Nb2O5/γ-Al2O3催化剂;以BTHFP为反应原料,考察了Ni含量、Nb2O5含量和反应工艺条件对催化剂的BTHFP加氢脱氧反应性能的影响。结果表明:在反应温度为260 ℃、H2压力为3 MPa、反应时间为24 h的条件下,4%Ni-20%Nb2O5/γ-Al2O3催化BTHFP加氢脱氧制备C11~C13烷烃的碳摩尔收率总和达89.6%,其中C11烷烃、C12烷烃和C13烷烃的碳摩尔收率分别为3.8%,8.9%,76.9%;同时,4%Ni-20%Nb2O5/γ-Al2O3催化剂具有良好的稳定性,连续反应70 h后,C11~C13烷烃的碳摩尔收率总和仍能保持在89.5%。
