西藏东北部热泉水中硫氧化菌的多样性及分布特征
2023-08-10寇祝卿纯袁昌果李平
寇祝,卿纯,袁昌果,李平
1.中国地质大学(武汉)/生物地质与环境地质国家重点实验室,湖北 武汉 430074;2.长江流域环境水科学湖北省重点实验室,湖北 武汉 430074
硫是生命物质的基本组分之一,是构成生物有机体的重要元素,在自然界中广泛分布。硫可通过物理化学以及微生物作用进行转化,因此硫循环在全球生物地球化学循环中具有重要作用(Zhao et al.,2020)。陆地热泉存在硫化物、单质硫、硫代硫酸盐、硫酸盐、硫化矿物等多种形态的硫,且具有温度高、有机质含量低、pH 值范围广,溶解氧含量低等特点(Shu et al.,2022),这些特征与早期地球环境相似。因此,研究热泉环境中硫的转化过程,对理解早期地球元素循环具有重要意义。
热泉中的硫能为微生物提供能源,而微生物在硫的形态转化中又起到重要作用。在好氧、微氧和厌氧条件下,微生物能够以氧气或硝酸盐作为电子受体进行硫氧化(刘阳等,2018)。由于硫元素价态较多,硫氧化菌(Sulfur-Oxidizing Bacteria,SOB)可能通过不同的氧化途径、酶和电子传递机制对不同价态的硫进行氧化。Paracoccus 硫氧化途径(Paracocus Sulfur Oxidation,PSO)介导硫代硫酸盐的氧化,该途径的sox基因簇包含soxRSVWXYZABCDEFGH 15 个基因,且该基因簇编码PSO 途径的重要蛋白,其中SoxB 是硫代硫酸盐氧化生成SO42−的关键蛋白(Wang et al.,2019)。由反向异化亚硫酸盐还原酶主导(reverse Dissimilatory sulfite reduction,rDsr)的单质硫氧化过程称为Dsr 途径,包含的主要基因有rhd、tusA、dsrE2和dsrAB,其中关键基因为dsrAB。除以上两种途径之外,sqr、aprA等基因也编码微生物不同硫氧化途径中的关键蛋白(Wu et al.,2021)。
以往的研究多使用soxB作为标记基因研究各种环境中的硫氧化菌,结果表明不同环境中优势SOB 可能存在差异。火山土壤(杨磊等,2020)与沿海沉积物(Alonso-Sáez et al.,2020)中基于soxB基因的优势硫氧化菌纲均为Alphaproteobacteria;而盐碱湖中soxB基因硫氧化菌多为Alphaproteobacteria、Betaproteobacteria 以 及Gammaproteobacteria(Tourova et al.,2013)。陆地热泉中也存在大量硫氧化菌,主要分布于Alphaproteobacteria、Gammaproteobacteria 和Betaproteobacteria、Aquificae 等菌纲(Jaffer et al.,2019;甄莉等,2019;Castelán-Sánchez et al.,2020)。除soxB基因外,其他硫氧化功能基因也用于各种环境中的硫氧化菌研究,某些研究还进行了功能基因丰度比较以及环境因子的影响分析。例如,aprA基因也用于热泉(Kubo et al.,2011)及海底热液沉积物(Wang et al.,2018)中硫氧化菌的研究,其中与热液喷口的距离影响着海底热液沉积物硫氧化菌的群落结构。在海洋高温油藏采出水(Zhou et al.,2020)硫氧化菌的研究中使用soxB、dsrA和aprA基因作为标记因子,qPCR(Real-time Quantitative PCR)结果表明aprA基因丰度最大,soxB与dsrA基因丰度较低且相差不大。soxB、sqr以及dsrA基因用于研究淡水湖(Kojima et al.,2014)和江河(Luo et al.,2018)中的硫氧化菌,珠江水体中,基于不同基因的主导硫氧化菌在纲水平均为Betaproteobacteria 与Alphaproteobacteria,但目水平上,基于soxB基因的主要SOB 为Burkholderiales,而Nitrosomonadales 是基于dsrA基因的优势SOB。此外,珠江水体中环境因子对不同功能基因硫氧化菌群落结构的影响也不同,基因丰度结果表明SoxB是该环境中的关键硫氧化酶(Luo et al.,2018)。前人研究表明,同一区域水体与沉积物中的硫氧化菌群落结构可能也不同,例如盐碱湖沉积物中Gammaproteobacteria 的相对丰度高于水体中Gammaproteobacteria 的相对丰度(Yang et al.,2013);存在于云南热泉沉积物与水体中的硫氧化菌也存在差异(Hou et al.,2013)。综上所述,前人已在盐碱湖、淡水湖、江河等环境中对硫氧化菌的多样性及分布特征方面开展了大量的研究,但在硫广泛分布的热泉水中,不同类型的硫氧化菌的相关研究还较为少见。
西藏地热区是世界上最活跃的地热区域之一,陆地热泉分布广泛。以往对西藏陆地热泉中的微生物研究多以16S rRNA 基因为主(韩天赐,2018;Ma et al.,2021),并发现如Thiobacillus等硫氧化菌群的存在。近年来,甄莉等(2019)采用硫氧化功能基因soxB克隆文库的方法,分析了西藏南部5 个地热区的25 个热泉沉积物样点中的硫氧化菌多样性。其研究采样点仅限于西藏南部,且该研究仅分析了热泉沉积物中基于soxB基因的硫氧化菌,而对于热泉分布众多的西藏东北地区,热泉水中不同硫氧化途径的SOB 多样性及分布特征的研究并未涉及。
因此,本研究旨在通过构建西藏东北地区热泉水中SOB 的soxB基因和dsrA基因克隆文库,并结合实时荧光定量PCR(Real-time Quantitative PCR,qPCR)技术,分析对比soxB与dsrA硫氧化途径SOB 在西藏东北部热泉水中的多样性、分布特征及其主控环境因子。本研究可完善对西藏热泉水体环境中SOB 多样性的认识,厘清影响不同硫氧化基因SOB 群落分布的关键环境因子,为全面理解热泉微生物硫循环及其环境意义奠定基础。
1 材料和方法
1.1 研究区概况
西藏处于喜马拉雅地热带,该地区热液系统分布广泛,且已发现340 余处热水(吕苑苑等,2014)。西藏地区地热水中砷含量普遍偏高,从10-126 mg·L−1,控制地热水砷含量的关键因素为岩浆流体的地质成因及其化学成分,其中硫化物的浓度也影响地热水中的砷含量(Guo et al.,2019)。本文研究区域位于西藏东北部的那曲市与昌都市,该区域处于亚东-谷露-那曲裂谷系,断裂带水热活动频繁(吕苑苑等,2014),拥有许多不同环境梯度的热泉。西藏北部的高温沸泉的水化学特征主要是HCO3-Na 型;西藏东部地区热泉的水化学特征以HCO3-Na 为主,也存在少量HCO3-Cl-Na 型热泉。热泉水化特征的不同可能与其形成方式相关,HCO3-Na 型的热泉水通常是大气降水通过大断裂深循环形成,而花岗岩岩体中的放射性元素可能是HCO3-Cl-Na型热泉的热量来源(王尚,2015)。
1.2 样品采集及理化参数测定
本研究采集的热泉水样来自西藏东北部的5 个地区:达巴、卓玛、滨达微、却色以及嘎弄,包括13 个热泉,分别为达巴热泉(DB1、DB41、DB45、DB5、DB6、DB7、DB8、DB10)、卓玛热泉(ZM1、ZM2)、滨达微热泉(BDW)、却色热泉(QS)和嘎弄热泉(GN)。采样点如图1。
图1 西藏热泉采样点分布图Figure 1 Distribution of hot springs water sampling sites in Tibet
采用过滤法收集热泉微生物样品。使用装有0.22 μm×142 mm 滤膜的Millipore 不锈钢过滤器过滤约10 L 热泉水,将用于实验室测量HCO3−、SO42−、As5+、AsT(总砷)质量浓度的水样分别收集到50 mL 酸洗聚丙烯瓶和棕色玻璃瓶中。过滤后含微生物的膜放入50 mL 无菌聚丙烯管,立即储存于干冰中。按照Jiang et al.(2016)的方法收集测砷的水样,将每个水样的10 mL 通过硅基强阴离子交换筒(Supelco,美国),用50%的甲醇和去离子水进行预处理。As5+保留在筒中,As3+保留在过滤后的溶液中。随后,用10 mL 1 mol·L−1HCl 洗脱,释放结合的As5+以洗脱样品。所有用于微生物群落分析的样品在野外和运输过程中保存在干冰中,然后在实验室−80 ℃的超低温冰箱中保存,直到进一步分析。每个热泉水样及微生物样品均平行采集3 份。
现场采集热泉水样,使用Thermo 水化测定仪(Hach Corp.美国)现场检测热泉水体温度、pH 和氧化还原电位(Oxidation-Reduction Potential,ORP)(Qing et al.,2023)。使用Hach DR850 分光光度计(美国)现场测试热泉水样中的S2−和FeT(总铁)的质量浓度,其中,S2−质量浓度的测定采用亚甲基蓝分光光度法(Qing et al.,2023),检测限为0.01 mg·L−1;FeT质量浓度的测定采用FerroZine 分光光度法(Viollier et al.,2000),检测限为0.03 mg·L−1。采用滴定法(DZ/T 0064.49—1993)测量HCO3−的质量浓度,检测限为5 mg·L−1。使用离子色谱仪(ICS1100,Dionex,USA)测量SO42−的质量浓度(姜舟,2016),测定时使用1.7 mmol·L−1碳酸钠+1.8 mmol·L−1碳酸氢钠溶液为流动相。As5+、AsT的质量浓度使用液相色谱-氢化物发生-原子荧光光谱仪(LC-HG-AFS,海光AFS-9780,北京)测定(姜舟,2016),分别配制质量浓度为10、20、40、80、100µg·L−1的As3+、As5+标准溶液,为测量时制作标准曲线使用;As3+和As5+的检出限分别为2×10−9和4×10−9;AsT的质量浓度为As3+、As5+质量浓度之和。测量各理化参数时均测量3 组平行样品,理化参数得到的数据为平均值±标准差。
1.3 DNA 的提取和硫氧化基因PCR 扩增
样品DNA 的提取采用FastDNA®SPIN Kit for Soil(MP BIO company,美国),提取过程参考试剂盒提供的操作步骤。以提取的总DNA 为模板,使用引物soxB-710F(5′-ATCGGYCAGGCYTTYCCS TA-3′)/soxB-1184R(5′-MAVGTGCCGTTGAARTT GC-3′)(杨磊等,2020)和dsrA-625F(5′-TTCAAG TTCTCCGGCTGCSCNAAYGACTG-3′)/dsrA-877R(5′-CGTTSANRCAGTGCATGCAGCG-3′)(Luo et al.,2018)进行西藏热泉水样中soxB和dsrA基因PCR 扩增,反应体系为2.5 µL 10×buffer,1 µL dNTP,19 µL ddH2O,正反向引物各1 µL,0.5 µL r-Taq DNA聚合酶以及1 µL DNA 模板,共计25 µL。扩增反应条件参照文献(Luo et al.,2018;杨磊等,2020),PCR 产物采用质量浓度为10 g·L−1的琼脂糖凝胶(1 g 琼脂糖粉溶于100 mL 1×TAE 缓冲液中)电泳检测,在紫外灯下观察,并切取目标条带,其中soxB基因目的片段长度为511 bp,dsrA基因目的片段长度为252 bp。用试剂盒E.Z.N.A®Gel Extraction Kit(Omega Bio-Tek,美国)纯化PCR 产物,回收DNA。
1.4 硫氧化基因克隆文库构建及系统发育分析
克隆文库的构建结合前人的方法(Wang et al.,2018)以及试剂盒操作步骤,将纯化后的目的片段连接到 pClone007 Versatile Simple Vector 质粒(TSINGKE,中国)载体上,并转化到感受态细胞Trelief5α(TSINGKE,中国)中。将转化后的细胞均匀涂布到含Amp(Ampicillin,氨苄青霉素)的LB固体培养基上,将平板倒置放于37 ℃培养箱过夜培养。针对每1 个采样点建立1 个克隆文库,每个克隆文库随机挑选克隆子,使用引物M13F(5′-TGTAAAACGACGGCCAG-3′ ) /M13R ( 5′-CAGGAAACAGCTATGACC-3′)进行PCR(反应程序为:94 ℃预变性10 min;35 次循环(94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min);72 ℃终延伸10 min)及凝胶电泳确定克隆子是否为阳性,得出结果后选择20-45 个阳性克隆子送往武汉艾康健生物技术公司测序。使用MEGA 7 软件裁剪测序获得的核苷酸序列;核酸序列对齐后,使用Mothur进行可操作分类单元(Operational Taxonomic Units,OTUs)的划分,cutoff 值为0.03;划分得到的每个OTU 选取1 个代表序列在NCBI(National Center for Biotechnology Information)数据库中进行blastx,得到与本研究OTU 相近的氨基酸序列;下载相似性最高的氨基酸序列为参考序列,导入MEGA 7 软件,与本研究的OTU 序列裁剪对齐后构建系统发育树。该研究中测定的克隆序列已经递交至GenBank 中,获得登录号为ON012851-ON012956。
1.5 qPCR 定量实验
从1.4 的克隆文库中挑选阳性克隆,在含Amp的LB 液体培养基培养后提取质粒,使用Nanodrop 2000(Thermo Fisher Scientific,美国)微量紫外分光光度计测定质粒DNA 浓度,得到的质粒DNA 用于标准曲线的绘制。标准曲线的制备采用7 个系列10 倍稀释,范围为每毫升102-108个基因拷贝。通过测定相关功能基因的拷贝数、浓度和碱基对组成对DNA 进行量化。
在ABI 7500 Fast real-time PCR 系统(Applied Biosystems)上使用 SYBR Premix ExTaq™Ⅱ(TaKaRa,大连,中国)进行了3 个重复的定量PCR。16S rRNA 基因的引物对为bac-515F ( 5′-GTGYCAGCMGCCGCGGTAA-3′)/bac-806R(5′-GGACTACNVGGGTWTCTAAT-3′),反应程序为:94 ℃预变性5 min;40 次循环(94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸30 s)。soxB基因的引物对为soxB-432F(5′-GAYGGNGGNGAYACNTGG-3′)/soxB-693B(5′-ATCGGNCARGCNTTYCCNTA-3′),反应程序为:95 ℃预变性15 min;40 次循环(95 ℃变性40 s,58 ℃退火40 s,72 ℃延伸40 s)。dsrA基因的引物对同1.3,反应程序为:95 ℃预变性5 min;40 次循环(95 ℃变性5 s,60 ℃退火34 s)。soxB、dsrA以及16S rRNA 基因的扩增效率(amplification efficiencies,%)分别为92.6、91.6 以及87.8。各个样点中soxB与dsrA基因的相对丰度为其在各个样点的基因拷贝数与16S rRNA 基因拷贝数的百分比。
1.6 统计学分析
硫氧化基因soxB与dsrA克隆文库的覆盖度使用公式计算:
其中:
C——覆盖度;
n——文库中只出现一次的克隆数量;
N——该文库克隆总数(Jiang et al.,2016)。使用R 4.1.0 进行环境因子与硫氧化菌群落组成和分布的RDA(Redundancy analysis)分析,使用SPSS软件进行环境因子之间的相关性分析、多样性指数差异分析、环境因子与多样性指数相关性分析。
2 结果与分析
2.1 热泉水体理化特征
西藏东北部5 个地区的热泉温度为 (25.0±0.1)-(69.8±0.2) ℃,pH 为 (6.59±0.01)-(8.37±0.01)(表1),除BDW 热泉为酸性热泉外,其余热泉均为中性或碱性热泉。西藏热泉硫离子质量浓度较低,为 (0.80±0.04)-(2.56±0.02) mg·L−1。除DB10样点外,其余达巴地区热泉水样中硫酸根质量浓度较高,为 (455.6±2.1)-(643.3±0.9) mg·L−1。此外BDW 样点也有较高的硫酸根质量浓度,为(620.7±1.3) mg·L−1。西藏东北部热泉中的砷多以五价砷的形式存在,其中达巴热泉中总砷含量普遍偏高,最高可达 (9 298.58±1.08) µg·L−1,其余热泉的总砷含量则较低。热泉水化参数的Spearman 分析表明,ORP 与温度(r= −0.648,t= −4.333,P=0.017)呈显著负相关,SO42−质量浓度与AsT质量浓度呈显著正相关(r=0.675,t= −1.564,P=0.029)。
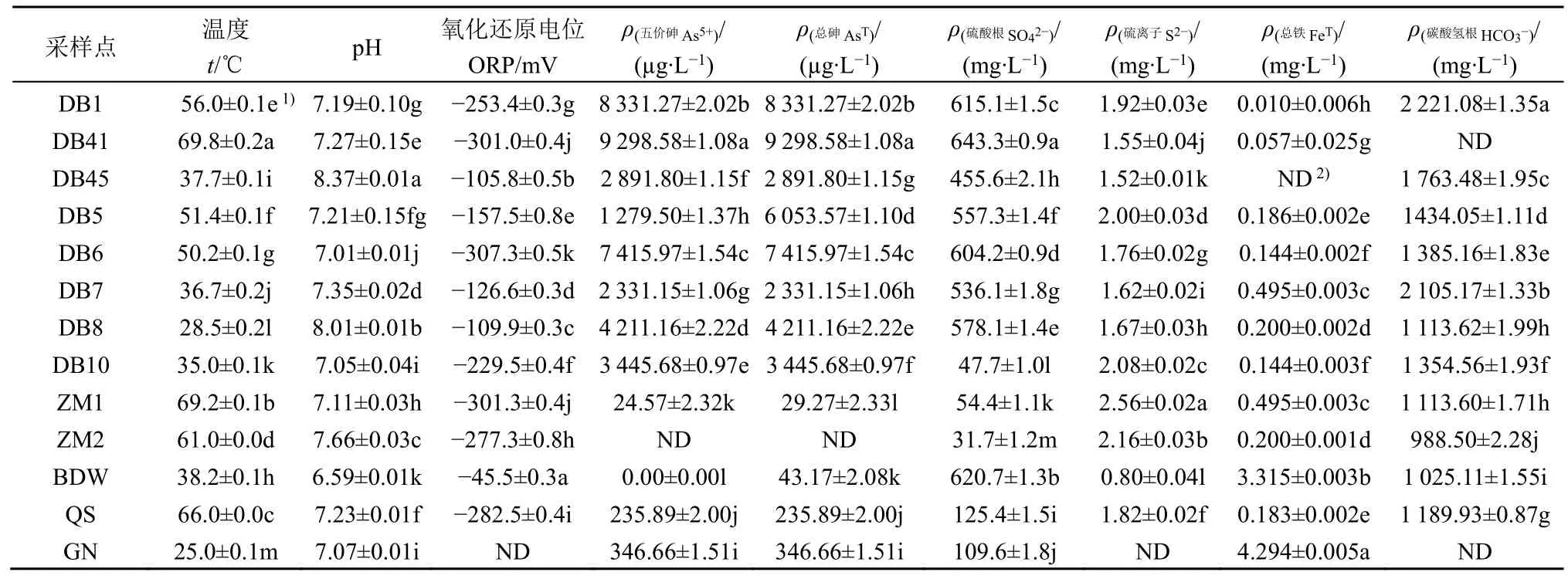
表1 采样点主要地球化学参数Table 1 Main geochemical parameters of hot spring water in Tibet
2.2 硫氧化菌群落α 多样性
从西藏东北部13 个热泉样品中扩增到541 条序列,其中dsrA基因共获得227 条阳性克隆序列,分属于47 个OTU;soxB基因共获得314 条阳性克隆序列,分属于61 个OTU(表2-3)。基于dsrA基因的克隆文库覆盖度为92%-100%(表2),基于soxB基因的克隆文库覆盖度为92%-97%(表3)。α 多样性指数(Chao 1、Shannon、Simpson_1−D)分析结果表明西藏东北部热泉水中基于dsrA基因的Chao 1 指数为3-7,Shannon 指数为1.0-2.6,Simpson_1−D 指数为0.4-0.8;soxB基因的Chao 1指数为3.0-12.0,Shannon 指数为0.9-2.9,Simpson_1−D 指数为0.3-0.8。通过统计学分析发现西藏东北部热泉中dsrA基因与soxB基因的Shannon 指数、Simpson_1−D 指数无明显区别,但Chao 1 指数呈现出显著差异(t=2.272,P=0.042)(图2),结果显示西藏热泉中基于soxB的Chao 1指数大于基于dsrA基因的Chao 1 指数(图2a),表示西藏东北部热泉水中基于soxB的SOB 物种丰富度较高,在热泉水体中可能发现更多种类的soxB基因型硫氧化菌。此外,探究环境因子对dsrA以及soxB基因α 多样性指数发现仅SO42−浓度与基于dsrA基因的Chao 1 指数显著呈负相关(r= −0.854,t= −3.792,P=0.002)(表4),表明西藏东北部热泉水中基于dsrA基因的SOB 的物种丰富度可能受到SO42−浓度的影响较大,SO42−浓度越高的热泉水体中dsrA基因型SOB 物种数量可能越少。

表2 硫氧化基因dsrA 克隆文库的多样性指数Table 2 Diversity indices of dsrA gene clone libraries

表3 硫氧化基因soxB 克隆文库的多样性指数Table 3 Diversity indices of soxB gene clone libraries
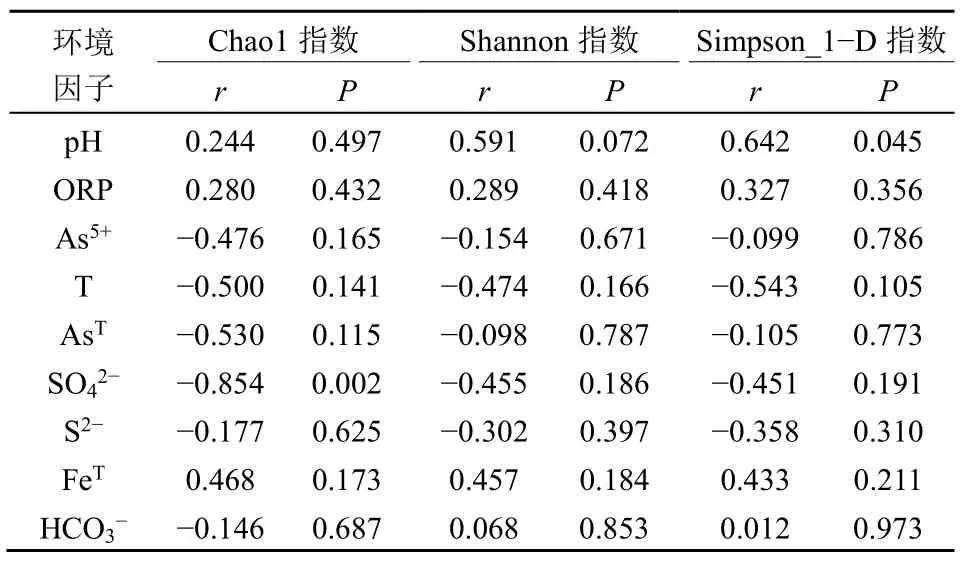
表4 环境因子与dsrA 基因α 多样性指数相关性分析Table 4 Correlation analysis between environmental factors and alpha diversity index of dsrA
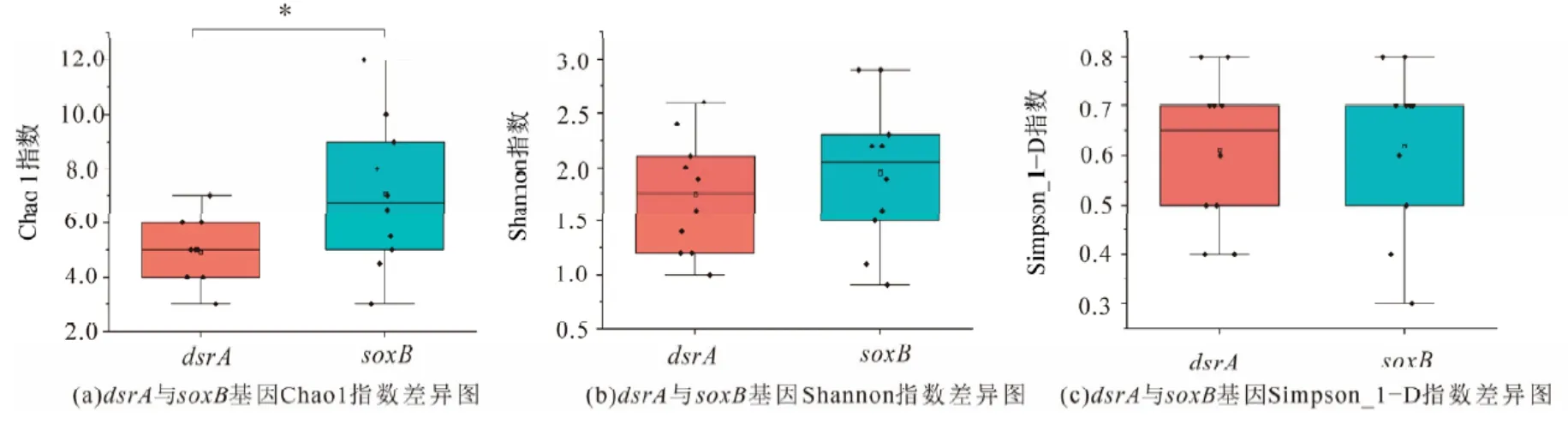
图2 soxB 与dsrA 基因α 多样性指数差异图Figure 2 Alpha diversity index difference between soxB and dsrA gene
2.3 硫氧化菌群落组成
对13 个热泉水体样本构建克隆文库后得到的序列进行系统发育分析,结果表明西藏东北部热泉水体中基于soxB基因的SOB 在纲水平上包含有Betaproteobacteria、Alphaproteobacteria、Gammaproteobacteria、Hydrogenophilalia(图3),而基于dsrA基因的 SOB 在纲水平上仅包含Betaproteobacteria、Gammaproteobacteria、Hydrogenophilalia(图4),表明在纲水平上,dsrA基因型SOB 物种丰富度低于soxB基因型SOB 物种丰富度。基于soxB基因的优势菌纲为Betaproteobacteria(图3),其相对丰度在各样点中占88.0%-100.0%。在基于soxB基因的系统发育中,达巴(DB)地区与卓玛(ZM)地区热泉样点的SOB 包含有Betaproteobacteria、Alphaproteobacteria、Gammaproteobacteria、Hydrogenophilalia,而滨达微(BDW)地区热泉样点 的 SOB 仅 含 有 Betaproteobacteria 与Alphaproteobacteria,表明纲水平上各地区热泉中基于soxB基因的SOB 群落结构存在差异。在属水平上,各热泉样点的硫氧化菌不同,属于Betaproteobacteria 的 OTU 多与Sphaerotilus、Sulfuricella、Sulfuriferula、Thiobacillus、Comamonas相近,存在于DB41、DB5、DB7、DB8、DB10 以及BDW 样点中。属于Gammaproteobacteria 的OTU仅在DB8 与ZM1 样点中发现,其中DB8 样点的OTU 与Thiocapsa相近,ZM1 样点的OTU 与Thioalkalivibrio相近。属于Alphaproteobacteria 纲soxB基因OTU 存在于DB1、DB41、DB5、DB8、DB10、ZM1 样点中,这些OTU 序列与Paracoccus、Roseinatronobacter相近。基于dsrA基因的优势菌纲也为Betaproteobacteria,除样点DB1、DB5、QS外,其余样点中Betaproteobacteria 的相对丰度在50.0%以上(图4)。在基于dsrA基因的系统发育中,达巴(DB)地区热泉样点的 SOB 包含有Betaproteobacteria、Gammaproteobacteria、Hydrogenophilalia,却色(QS)和嘎弄(GN)地区热泉样点的 SOB 含有 Betaproteobacteria 和Hydrogenophilalia,而滨达微(BDW)地区热泉样点中仅发现Betaproteobacteria,其 中Gammaproteobacteria 仅存在于DB7 样点中,表明各地区热泉水体中dsrA基因型SOB 在纲水平上群落结构也存在差异。在属水平上,GN 样点的1 个OTU 与Ideonella相近(相似度>90.0%),DB7 样点中7 个OTU 与Thiothrix(相似度为96.9%)相近。

图3 基于Neighbor-joining 方法构建的soxB 基因氨基酸序列系统发育树Figure 3 Neighbor-joining tree showing the phylogenetic relationships of the deduced soxB amino acid sequences translated from the soxB gene OTU clone sequences

图4 基于Neighbor-joining 方法构建的dsrA 基因氨基酸序列系统发育树Figure 4 Neighbor-joining tree showing the phylogenetic relationships of the deduced dsrA amino acid sequences translated from the dsrA gene OTU clone sequences
目水平上,西藏热泉基于dsrA与soxB基因的SOB 优势菌及群落结构存在差异。基于dsrA基因的SOB 属于Rhodocyclales、Nitrosomonadales、Burkholderiales、Hydrogenophilales以 及Thiotrichales,优势菌目为Rhodocyclales,除GN 样点外,其余样点中均存在Rhodocyclales,其相对丰度在各样点中为33.3%-96.0%。基于soxB基因的SOB 属于 Nitrosomonadales、Burkholderiales、Hydrogenophilales、Rhodobacterales、Chromatiales,优势菌目为Nitrosomonadales,除了BDW 样点外,Nitrosomonadales 相对丰度在各个样品中占30.0%及以上。
2.4 影响微生物群落结构的关键环境因子
通过环境因子与各样点硫氧化菌相对丰度的RDA 分析表明,温度、SO42−、S2−、pH、HCO3−等是影响西藏东北部热泉水中硫氧化菌分布的关键环境因子(图5)。基于dsrA基因的RDA 分析表明(图5a),GN、DB7 样点的群落结构分别明显区别于其他样点,其中影响DB7 样点群落结构的重要环境因子为HCO3−浓度,而FeT浓度可能对GN 样点群落结构的影响较大(图5a)。HCO3−是衡量碱度的离子之一,表明碱度可能对DB7 样点中SOB 的影响较大。在基于soxB基因的RDA 分析中(图5b),DB8 样点的群落结构区别于其他热泉样点,这可能是由于DB8 热泉的水温更低((28.5±0.2) ℃)以及pH 值较高(8.01±0.01)(表1)。除DB8 样点外,其他样点的SOB 群落结构的差异与SO42−浓度以及S2−浓度存在相关性(图5b),表明除DB8 样点外,其他样点中SO42−浓度和S2−浓度更能影响热泉中soxB基因型硫氧化菌的群落结构。S2−与SO42−分别为硫氧化的底物与产物,其在热泉中的含量影响SOB 的群落组成存在合理性。
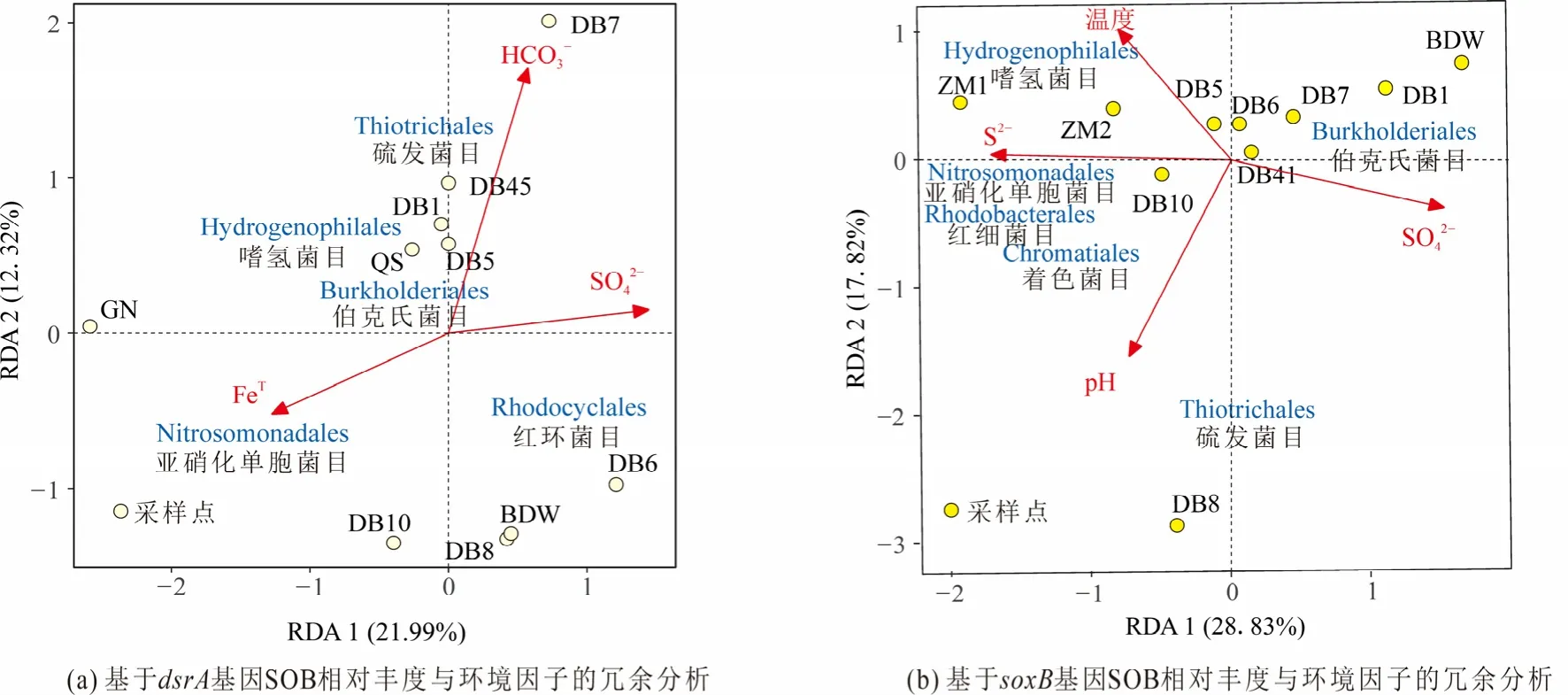
图5 基于各样点dsrA 基因(a)与soxB 基因(b)的SOB 相对丰度与环境因子的相关性分析Figure 5 Correlation analysis of SOB relative abundance and environmental factors based on dsrA gene (a)and soxB gene (b)
2.5 不同硫氧化途径微生物分布特征
通过qPCR 实验得到西藏热泉水体样品中soxB、dsrA以及16S rRNA 基因的拷贝数,并计算出各个样点中soxB与dsrA基因的相对丰度(表5),即样品中soxB基因相对丰度范围为 0.33%-11.80%,dsrA基因相对丰度范围为0.61%-30.25%。由图6 可以看出,虽soxB与dsrA基因相对丰度在各样点中存在差异,但总体来看,这两种基因的相对丰度在热泉水体环境中相差不大,表明PSO 以及Dsr 均为热泉水体中较为重要的硫氧化途径。通过RDA 分析热泉环境因子对硫氧化基因相对丰度的影响(图7),结果显示这两种硫氧化基因的分布与热泉水体的AsT浓度、ORP、SO42−浓度、S2−浓度等环境因子相关。RDA 分析显示soxB基因相对丰度与SO42−浓度、ORP 呈正相关关系,与S2−浓度呈负相关关系(图7),表明soxB基因型硫氧化菌更多地存在于偏氧化环境中,dsrA基因相对丰度与AsT浓度和HCO3−浓度呈正相关关系(图7),表明dsrA基因型SOB 可能分布于砷浓度、碱度相对偏高的热泉。

表5 各样点中soxB 基因、dsrA 基因、细菌 16S rRNA 基因拷贝数及比例Table 5 Abundance and proportion of total bacterial 16S rRNA, soxB and dsrA genes as determined by qPCR
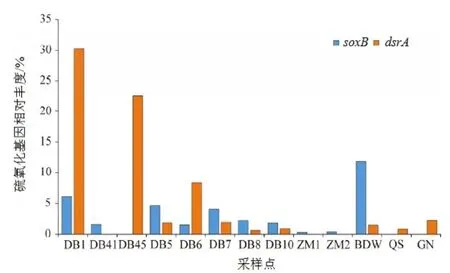
图6 soxB 基因与dsrA 基因的相对丰度Figure 6 Relative abundance of soxB gene and dsrA gene

图7 soxB 与dsrA 基因相对丰度与环境因子的RDA 分析Figure 7 RDA analysis of relative abundance of soxB and dsrA genes and environmental factors
3 讨论与结论
3.1 讨论
以往的研究表明西藏热泉沉积物基于soxB基因克隆文库的 Chao 1 指数值为 1.0-13.0,Shannon_H 值最高为2.1(甄莉等,2019),与西藏东北部热泉水体中基于soxB基因克隆文库的Chao 1 指数值(3.0-12.0)和Shannon 指数值(0.9-2.9)相差不大,表明西藏热泉的水体与沉积物中,基于硫氧化基因soxB的硫氧化菌群落α 多样性指数差异不大。与其他环境中基于硫氧化基因soxB的硫氧化菌群落α 多样性指数相比,该研究热泉水中硫氧化基因soxB基因文库的Chao 1 指数值(3.0-12.0)较小,Shannon 指数值(最大2.9)却与其他环境的无明显差异。例如海洋沉积物基于soxB基因的Chao 1 指数可达到104,但Shannon 指数最高只有4.46(张玉等,2018);盐碱湖基于soxB基因的Chao 1 指数可达25,而Shannon 指数最高也只有2.5(Yang et al.,2013);五大连池火山群水体基于soxB基因Chao 1 指数最高为2 165.5,Shannon指数最低也只有3.71。热泉基于soxB基因的Chao 1 指数值小于其他环境的Chao 1 指数值表明热泉环境的SOB 物种数较低,这可能是由于热泉具有有机物质含量低、温度高以及溶解氧含量低等特征(Shu et al.,2022)。甄莉等(2019)对西藏南部热泉沉积物的研究也表明溶解有机碳含量越高,基于soxB基因的硫氧化菌α 多样性越高。
该研究热泉水中的SOB 主要为Betaproteobacteria、Alphaproteobacteria、Gammaproteobacteria、Hydrogenophilalia,这与以往陆地热泉硫氧化菌研究的结果具有一定相似性,但还缺少热泉优势菌纲Aquificae。以往的研究发现Aquificae 广泛存在于60 ℃以上、高硫化物(12 mg·L−1)热泉中(Skirnisdottir et al.,2000),而本研究中西藏东北部热泉的温度普遍低于60 ℃且硫化物质量浓度较低[(0.80±0.04)-(2.56±0.02) mg·L−1]。西藏东北部热泉的SOB 优势菌纲(Betaproteobacteria)与深海热液的 SOB 优势菌纲( Gammaproteobacteria、Epsilonproteobacteria)(Wang et al.,2018)存在差异,虽然深海热液与陆地热泉同为热环境,但这两种环境的形成机制与化学成分的差异(Lu et al.,2021)可能导致两种热环境的优势SOB 不同。此外,Betaproteobacteria、Alphaproteobacteria 与Gammaproteobacteria 也是西藏南部热泉沉积物中发现的主要硫氧化菌纲(甄莉等,2019),这表明在纲水平上,西藏热泉水体与沉积物两种介质中的基于soxB基因的硫氧化菌具有一致性。热泉水中不同的硫氧化途径可能由不同的SOB 主导,结合前人研究还发现不同环境中主导相同硫氧化途径的SOB 也可能不同。例如本研究西藏东北部热泉中基于dsrA基因与soxB基因的优势菌目分别为Rhodocyclales 与Nitrosomonadales;而前人对珠江水体中硫氧化菌的研究表明基于dsrA基因与soxB基因优势菌目分别为 Nitrosomonadales 与Burkholderiales(Luo et al.,2018)。此外,在本研究的热泉水与前人研究的热泉沉积物这两种介质中均发现了 Rhodocyclales、Nitrosomonadales、Burkholderiales、Rhodobacterales 以及Chromatiales,但热泉水中未发现 Neisseriales、Rhizobiales、Rhodospirillales;沉积物中未发现Thiotrichales(甄莉等,2019),这可能是由于研究介质和区域的不同,温度、pH 等各种理化参数也存在较大差异。总的来说,结合以往的研究,可以发现,各环境中优势SOB 在纲水平上多为Alphaproteobacteria、Gammaproteobacteria、Betaproteobacteria、Deltaproteobacteria 和Epsilonproteobacteria,由此可见,Proteobacteria 门可能是各环境中硫氧化的主导微生物。
在属水平上,西藏东北部热泉水中基于soxB基因的硫氧化菌多是常见的硫氧化菌,如Thiobacillus、Sulfuricella、Sulfuriferula,Sphaerotilus、Comamonas的某些菌株能进行硫代硫酸盐的氧化(Pandey et al.,2009;Watanabe et al.,2016)。Paracoccus是常见的无色硫细菌属,在好氧条件下进行硫氧化。Thiocapsa与Thioalkalivibrio均为紫硫菌,在光照厌氧条件下进行硫代硫酸盐的氧化,并可能产生代谢中间产物单质硫(刘阳等,2018)。RoseinatronobacterthiooxidansALG1 是一个严格的有氧和专性异养菌,在硫代硫酸盐存在的情况下,其对有机碳的利用效率显著提高(Sorokin et al.,2000),表明西藏热泉中的硫循环与碳循环可能存在联系。在基于dsrA基因的硫氧化菌中,Thiothrix能将H2S 氧化为硫粒积累在菌体内,后又能将硫粒氧化为SO42−(Chernitsyna et al.,2020)。研究发现Thiothrix能在高碱度(750 mg·L−1)好氧颗粒污泥中存在,与碱度呈一定的正相关关系(Gao et al.,2019)且Thiothrix更适应低温环境(Abusam et al.,2019)。基于dsrA基因的硫氧化菌还包含有Ideonella,该菌属在热泉中并不常见,仅在2002 的一篇文章中发现热泉筛选到的某菌株的16S rRNA 基因与Ideonelladechloratans相似性较高(相似度92.1%)(Takeda et al.,2002),而Ideonella的硫氧化功能鉴定还未见相关报道。从结果来看,关于热泉dsrA基因型SOB 在属水平上的多样性有待进一步研究。
西藏东北部热泉水中硫氧化菌的群落结构受碱度、pH、温度、FeT、SO42−、S2−等环境因子的影响,这些环境因子在其他环境中也表现出对SOB 的影响。Gupta et al.(2022)的研究表明碱度影响着生物脱硫反应器中SOB 的群落组成。Luo et al.(2018)与杨磊等(2020)分别发现SO42−与S2−也对火山土壤、珠江中硫氧化菌的群落结构产生一定的影响。铁离子与硫氧化菌存在一定相关性,例如硫氧化菌Sulfobacillusthermosulfidooxidans能在有氧条件下氧化亚铁离子(Zhang et al.,2019);Zhao et al.(2020)的研究表明Thiobacillussp.还能在厌氧条件下通过异化Fe(III)还原获得能量,然后将单质硫氧化为硫酸盐。温度和pH 是影响温泉微生物分布的两个最重要的控制因素,例如,在滇西南热泉中,微生物的结构表现出与pH 以及温度的相关性(Guo et al.,2021)。研究表明细菌群落可能会随着pH 值的适度变动而变化,且pH 值可能通过直接生理机制影响细菌群落,也可能反映其他未测量因素的间接影响(Chen et al.,2020)。此外,在西藏南部热泉沉积物硫氧化菌的研究中,基于soxB基因的SOB 群落组成也受到温度、pH 以及硫化物浓度的影响(甄莉等,2019),表明温度、pH 以及硫化物浓度可能是影响西藏热泉水体以及沉积物中基于soxB基因SOB 群落结构的重要环境因子。
该研究热泉水中soxB基因型硫氧化菌更多地存在于偏氧化环境中,邵博(2019)的研究也显示氧气浓度的增加能提高水体中soxB基因的表达丰度。另外,微生物硫氧化PSO 途径的Sox 系统不仅能将硫代硫酸盐直接氧化为硫酸盐,而且还能将HS−和S0作为适当的中间体通过酶促或非酶促结合到载体蛋白SoxY 中氧化硫化物和硫(Wu et al.,2021),说明Sox 系统在热泉更多的硫氧化途径中起重要作用。砷在本研究热泉水中浓度较高且可能影响含dsrA基因SOB 的分布,除热泉外,前人的研究表明高砷地下水中dsrA基因丰度也与As 浓度存在关系,即呈正相关(Li et al.,2017),这可能是由于硫和砷往往共存于环境中,并具有相似的微生物氧化还原转化(Wang et al.,2018)。此外,dsrA编码的蛋白是一种双向蛋白酶,能进行亚硫酸盐的还原以及胞内单质硫的氧化,所以高砷地下水中基于dsrA基因的硫相关微生物不仅包括硫氧化菌,还发现典型硫酸盐还原菌Desulfovibrio、Desulfobulbus等(Li et al.,2017),表明在高砷(规定饮用水中砷含量≤10 μg·L−1)环境中,As 浓度可能还影响着硫酸盐还原菌,因此可看出砷可能是影响高砷环境中硫循环微生物的关键环境因子。反之,硫循环微生物又影响着高砷环境中砷形态和价态的转变,例如某些硫循环微生物可直接氧化三价砷;或氧化硫/还原硫酸盐造成亚砷酸盐与硫代硫酸盐之间的形态转变(Wang et al.,2018);或促进含砷硫化矿物的形成与溶解(Zecchin et al.,2019)。综上所述,硫循环微生物与高砷环境中的砷含量息息相关,了解环境中硫循环微生物与砷的关系有助于了解环境中砷的迁移转化以及对砷污染的修复。
3.2 结论
西藏东北部热泉水中硫氧化菌主要为Betaproteobacteria,此外,还包括Alphaproteobacteria、Gammaproteobacteria、Hydrogenophilalia。不同硫氧化途径由不同SOB 主导,其中基于dsrA基因的优势硫氧化菌目为Rhodocyclales(33.3%-96.0%),基于soxB基因的优势硫氧化菌目为Nitrosomonadales(30.0%-91.7%)。温度、SO42−、S2−、pH 等环境因子是影响西藏热泉水样中SOB 的分布的关键环境因子,soxB基因型SOB 主要分布于偏氧化的热泉,而dsrA基因型SOB 主要分布于砷浓度和碱度相对偏高的热泉。
