系统性红斑狼疮患者外周血AC007278.2、MX2表达水平与疾病活动度及补体水平的关联性分析
2023-08-10房丽,叶婷,刘睿
房 丽, 叶 婷, 刘 睿
系统性红斑狼疮(systemic lupus erythematosus,SLE)多发于女性,是一种以机体多组织、多器官损伤为特征的自身免疫性疾病,其主要病理特征为B细胞异常活化、自身抗体过度产生以及免疫复合物沉积[1]。目前,SLE主要根据患者临床症状、体征、血清学指标等进行诊断,但SLE临床表现复杂,早期诊断困难。深入研究SLE的发生机制,探寻能够早期、快速诊断SLE并能够评估SLE疾病活动度的客观指标,对SLE的临床诊治具有重要意义[2]。长链非编码RNA(long non-coding RNA,lncRNA)是一种非编码RNA分子,参与胚胎发育和分化、衰老和免疫应答等多种生物学过程[3]。AC007278.2是近年发现的lncRNA,其可通过顺式和(或)反式调节方式参与Ⅰ型干扰素等细胞因子的表达调控,影响SLE的发生、发展[4]。MX动力蛋白样GTP酶2(MX dynamin-like GTPase 2,MX2)蛋白是动态蛋白GTP酶家族的成员,定位于核膜下方的异染色质区域。研究表明,MX2能够通过激活Toll样受体,促进炎症相关通路的活化,在SLE的发生、发展中发挥重要作用[5]。另外,鉴于补体C3、C4是评估SLE疾病发生和疾病活动度的重要生物标志物[6],本研究通过检测外周血AC007278.2、MX2表达水平,探讨两者与SLE疾病活动度及补体水平的关系,现报道如下。
1 对象与方法
1.1研究对象 招募2018年11月至2020年2月武汉亚心总医院及中部战区总医院收治的SLE患者168例(SLE组)。其中男14例,女154例;年龄20~68(37.85±7.54)岁;体质量指数(body mass index,BMI)17.1~28.6(22.95±2.63)kg/m2。根据病史及体格检查,合并口腔溃疡48例,光过敏70例,浆膜炎44例。参考2002年干燥综合征国际分类标准[7],继发干燥综合征41例。纳入标准:(1)符合SLE的诊断、分类标准[8];(2)首次诊治;(3)年龄>18岁;(4)临床资料完整。排除标准:(1)合并类风湿关节炎、原发性干燥综合征等其他自身免疫性疾病;(2)合并感染、肿瘤等疾病;(3)近3个月有糖皮质激素或免疫抑制剂治疗史;(4)妊娠期或哺乳期妇女。选取同期于我院进行健康体检的健康人群80名作为对照组,其中男10名,女70名;年龄23~66(38.19±8.35)岁;BMI 18.3~28.8(23.14±2.54)kg/m2,均排除风湿免疫系统疾病、感染性疾病及恶性肿瘤等。本研究获医院医学伦理委员会审查批准(批号:M201804-F027)。
1.2外周血AC007278.2、MX2 mRNA水平检测 研究对象入院后次日抽取清晨空腹静脉血5 ml,EDTA-K2抗凝剂抗凝。采用密度梯度法分离外周血单个核细胞:将3 ml淋巴细胞分离液加入到15 ml离心管中,加入全血后以1 000 r/min条件离心25 min。液体由上而下分为4层,即血浆层、单个核细胞层、中性粒细胞层和红细胞沉淀层。小心吸取单个核细胞层转移到新的离心管中,加入1 ml磷酸缓冲盐溶液,反复吹打混匀待测。Trizol法提取外周血单个核细胞的总RNA,应用Narodrop2000(美国赛默飞)检测RNA浓度和纯度。通过实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)法检测AC007278.2、MX2 mRNA的相对表达量。引物由上海华大公司设计、合成,引物序列见表1。反应条件:95 ℃预变性5 min,95 ℃变性30 s,60 ℃退火40 s,70 ℃延伸30 s,变性退火延伸共40个循环。反应体系:SYBR Premix 10 μl,上、下游引物各1 μl,cDNA 1 μl和双蒸水7 ml。以GAPDH为内参,通过2-△△Ct法计算AC007278.2、MX2 mRNA的相对表达量。
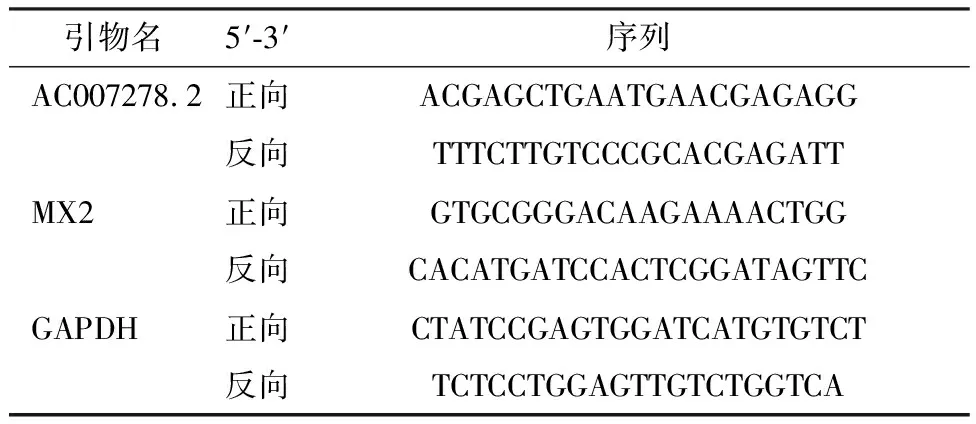
表1 引物序列
1.3临床资料收集 (1)一般资料:性别、年龄、临床表现等,通过医院电子病历系统收集。(2)实验室指标:白细胞(white blood cells,WBC)、淋巴细胞、血小板(platelets,PLT)、血红蛋白(hemoglobin,Hb)、补体C3、补体C4等。WBC、淋巴细胞、PLT及Hb采用日本希森美康公司Sysmex-XS-800i全自动血液分析仪进行检测。补体C3、C4水平采用Cobas e411全自动电化学发光免疫分析仪及其配套的试剂盒进行测定。
1.4SLE疾病活动度判断 于患者入院24 h内进行SLE疾病活动指数-2000(SLE disease activity index-2000,SLEDAI-2000)评分[9],以评估患者就诊前10 d的疾病情况,内容包括中枢神经系统、肾脏、关节、皮肤、浆膜、血液、全身症状等9个器官系统的共24项临床指标,总分105分,分值越高提示疾病活动度越重。SLEDAI-2000评分≤4分为基本无活动(无活动组,n=42);5~9分为轻度活动(轻度活动组,n=45);10~14分为中度活动(中度活动组,n=42);≥15分为重度活动(重度活动组,n=39)。
2 结果
2.1两组临床资料比较 SLE组AC007278.2、MX2水平高于对照组,补体C3、C4及WBC、淋巴细胞、PLT、Hb水平低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组临床资料比较
2.2不同SLE活动度组的临床资料比较 四组AC007278.2、MX2,以及补体C3、C4水平比较差异有统计学意义(P<0.05)。SLE疾病活动度越重,AC007278.2、MX2水平越高,补体C3、C4水平越低。见表3。
表3 不同SLE活动度组的临床资料比较
2.3SLE患者AC007278.2、MX2与补体C3、C4及SLEDAI-2000评分的相关性分析结果 Pearson相关性分析结果显示,SLE患者AC007278.2与补体C3、C4呈负相关(r=-0.624,P<0.001;r=-0.712,P<0.001);MX2与补体C3、C4呈负相关(r=-0.656,P<0.001;r=-0.723,P<0.001);AC007278.2、MX2与SLEDAI-2000评分呈正相关(r=0.662,P<0.001;r=0.789,P<0.001)。
2.4SLE疾病活动度影响因素的多元线性回归分析结果 以SLEDAI-2000评分为因变量,以AC007278.2、MX2、补体C3、补体C4为自变量进行多元线性回归分析,结果显示,AC007278.2、MX2与SLE疾病活动度呈正关联(P<0.05),补体C3、C4与SLE疾病活动度呈负关联(P<0.05)。见表4。
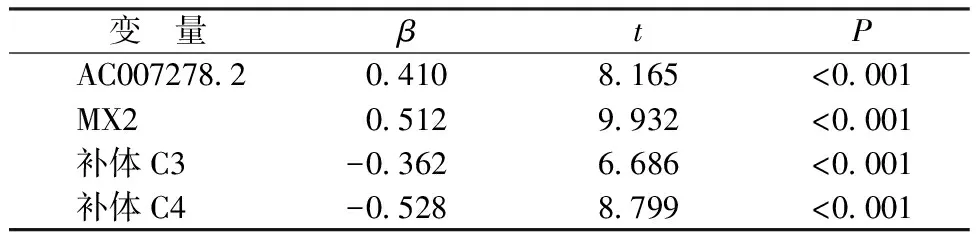
表4 SLE疾病活动度影响因素的多元线性回归分析结果
2.5SLE患者外周血AC007278.2、MX2水平与临床特征的关联性分析结果 有继发干燥综合征的SLE患者外周血AC007278.2、MX2水平高于无继发干燥综合征者,差异有统计学意义(P<0.05)。外周血AC007278.2、MX2水平与口腔溃疡、光过敏、浆膜炎发生情况无显著关联(P>0.05)。见表5。
表5 168例SLE患者外周血AC007278.2、MX2水平与临床特征的关联性分析结果相对表达量]
3 讨论
3.1SLE的病因及机制尚不清楚,目前认为与遗传、免疫及环境等因素有关。研究表明,SLE患者存在自身免疫耐受缺失,自身抗体与自身抗原结合形成免疫复合物。免疫复合物沉积在机体组织造成损伤的同时,激活补体系统造成低补体血症,表现为血清补体C3、C4水平降低,这是反映SLE疾病活动的重要指标。深入研究SLE自身免疫反应启动的分子机制,有助于发现新的SLE诊断和治疗靶点。有学者对外周血单个核细胞基因表达进行高通量测序,发现SLE患者,特别是重度活动度患者存在多种lncRNA异常表达,进而导致补体、干扰素等细胞因子表达异常,在SLE疾病的发生、发展中发挥重要作用[4]。
3.2lncRNA是长度超过200个核苷酸的RNA分子,其可作为信号或诱饵分子,参与先天性免疫及适应性免疫细胞的发育成熟,维持免疫系统稳态。研究表明,lncRNA可通过调控表观遗传,影响组蛋白修饰状态,参与SLE、类风湿关节炎等自身免疫性疾病的发生、发展[3-4]。AC007278.2是近年新发现的lncRNA,可通过促进Th1细胞和Th17细胞的激活及细胞因子的分泌,对多发性硬化等自身免疫疾病的复发有促进作用[10]。本研究结果显示,SLE患者外周血AC007278.2水平升高,且其表达与SLE疾病活动度呈正相关,提示AC007278.2参与SLE的发病及疾病活动。分析其机制,可能与AC007278.2促进炎症细胞因子表达有关。AC007278.2能够通过抑制转录因子结合到CC类趋化因子受体7(chemokine CC motif receptor 7,CCR7)基因的启动子区域,进而抑制CCR7的表达[4],而CCR7表达下调可导致辅助性滤泡T细胞分化障碍及B细胞成熟障碍,白介素21过度分泌,促进SLE的发生和疾病活动[11]。本研究结果显示,AC007278.2与补体C3、C4呈负相关。Chen等[12]研究表明,AC007278.2表达升高会激活Th1细胞,促进干扰素γ的分泌,诱导巨噬细胞和淋巴细胞活化,促进机体产生独特性自身抗体,包括IgG2a和IgG3等,进一步激活补体系统,参与促进狼疮性肾炎的发生。因此认为AC007278.2可能是通过补体系统参与SLE的发生和进展。本研究结果显示,SLE患者外周血AC007278.2水平与继发干燥综合征发生有关。分析原因可能是AC007278.2表达升高下调CCR7表达,导致唾液腺体中趋化因子配体19高表达而激活B淋巴细胞,从而促进干燥综合征等自身免疫性疾病的发生[13]。
3.3MX2编码基因位于21q22.3,编码蛋白位于细胞核,属于GTP酶的动态蛋白样家族成员,是一种对多种RNA和DNA病毒具有抑制活性的干扰素刺激基因,参与病毒感染及类风湿关节炎等疾病的发生、发展[5,14]。本研究结果显示,SLE患者外周血MX2水平升高,且与SLE疾病活动度呈正相关。分析其机制,可能是MX2表达升高通过激活NOD样受体信号通路促进SLE的发生和进展。Meng等[5]研究显示,MX2高表达的SLE患者存在NOD样受体信号通路过度激活的现象。NOD样受体热蛋白结构域相关蛋白3过度激活可诱导单核细胞和浆细胞样树突状细胞中NOD样受体2的表达,促进白介素10、白介素4等细胞因子的产生,加重SLE的病情[15-16]。也有研究发现,MX2主要表达于中性粒细胞中,通过增加组织中性粒细胞浸润和过度活化,导致活性氧、颗粒蛋白酶等细胞毒内容物释放到宿主组织,造成血管等局部组织损害,促进SLE进展[5,17]。本研究中,MX2与补体C3、C4呈负相关,提示MX2表达升高可能与补体系统激活有关。SLE患者存在Th1/Th2细胞平衡失调的现象,干扰素γ1b与细胞表面相应受体结合,不仅能够上调MX2等干扰素刺激基因的表达,还能够激活补体级联反应,造成自身免疫性病理损伤[18]。研究表明,活动性SLE患者中Ⅰ型干扰素能够诱导CD4+T细胞、CD19+B细胞中MX2表达,而MX2通过与寡腺苷酸合成酶2相互作用促进SLE的发生和进展[5,19]。本研究结果还显示,SLE患者MX2的表达水平与继发干燥综合征发生有关。分析其原因认为,MX2能够与干扰素调节因子7相互作用,促进唾液腺导管中巨噬细胞和树突状细胞中Toll样受体7的激活,导致继发干燥综合征的发生[20-21]。本研究多元线性回归分析结果显示,血清补体C3、C4是影响SLE疾病活动度的独立因素,与既往研究结论相似[22],提示检测SLE患者血清补体C3、C4有助于评估SLE疾病活动度。
综上所述,SLE患者外周血AC007278.2、MX2水平升高,与SLE患者的疾病活动度及补体C3、C4水平存在相关性,可用于评估SLE的进展情况,但其作用的具体分子机制尚有待进一步探讨。
