急性冠脉综合征患者血清miR-139-5p表达水平与短期预后的关联性分析
2023-08-10高彦琳朱梦宇刘定红
高彦琳, 成 威, 朱梦宇, 刘定红, 戎 李, 赵 胜
急性冠脉综合征(acute coronary syndrome,ACS)是冠心病的常见类型,发病机制主要是冠脉内斑块破裂或血栓形成引起急性心肌供血减少或中断,在临床中具有较高的发病率和致残率[1-2]。近年来,随着冠脉介入技术的应用,ACS患者预后得到显著改善,然而仍有部分患者在正规治疗之后发生主要心血管不良事件(major adverse cardiovascular events,MACE)[3-4]。目前,学者们还在对ACS的病理、生理学机制进行研究,探寻对本病诊断和预后评估敏感的预测指标,从而指导临床工作。微小RNA(micro ribonucleic acids,miRNAs)是由核苷酸组成的非编码单链小分子RNA,能与目标mRNA结合,通过调控蛋白质合成控制细胞的生长、发育、分化和凋亡[5]。有证据表明,miR-139-5p与内皮和平滑肌细胞增殖密切相关,在内皮和间充质干细胞中,miR-139-5p可通过CD44/miR-139-5p通路调控血管增殖[6]。在内皮细胞中,miR-139-5p过表达可抑制内皮细胞功能及定向分化[7]。Wang等[8]研究发现,miR-139-5p与急性心肌梗死(acute myocardial infarction,AMI)密切相关,其可通过血管内皮细胞生长因子受体-1(vascular endothelial growth factor receptor-1,VEGFR-1)调控内皮细胞功能,促进心肌梗死病程进展,但miR-139-5p和VEGFR-1在ACS患者中的表达水平及其预后风险的预测价值仍未得到阐明。鉴此,本研究通过检测ACS患者血清miR-139-5p、VEGFR-1的表达水平,分析两者在不稳定型心绞痛(unstable angina pectoris,UAP)和AMI中的表达水平及与患者预后的关联性,从而为ACS患者的病情评估、预后判断和个体化治疗提供理论基础。
1 对象与方法
1.1研究对象 招募2021年1月至2021年9月安徽省第二人民医院收治的因胸痛入院的ACS患者176例。根据患者病史、冠脉造影检查及其他临床检查结果将其分UAP组(100例)和AMI组(76例)。纳入标准:符合《急性冠脉综合征急诊快速诊治指南(2019)》中关于UAP或AMI的诊断标准,经冠脉造影检查明确诊断[9-10]。排除标准:(1)合并严重电解质紊乱及严重感染性疾病者;(2)合并急性脑出血或急性脑梗死者;(3)合并严重肝肾功能不全、恶性肿瘤者。选择同期因胸痛入院,并经冠脉造影检查排除冠心病的28例患者为对照组。研究获医院医学伦理委员会批准。
1.2治疗方法 根据《急性冠脉综合征急诊快速诊治指南(2019)》[9]中ACS的治疗原则进行治疗。本研究中,需急诊手术者仅处理梗死相关血管,血栓抽吸或糖蛋白Ⅱb/Ⅲa抑制剂的使用由医师根据术中情况决定。其余患者的手术治疗方案由具有造影资质的医师根据实际情况制定。
1.3一般临床资料收集 记录患者年龄、性别、慢性病史(高血压病、糖尿病、血脂异常等)等资料。冠状动脉造影由我院心血管内科专业医师操作完成,依据造影检查结果及血管病变狭窄程度计算Gensini评分[11-12]。
1.4血液检查及心脏彩超检查 于入院后次日清晨或急诊冠脉介入术前抽取患者肘静脉血送检验科检测。应用SYSMEX XN1000全血自动分析仪检测白细胞(white blood cell,WBC)、红细胞(red blood cell,RBC)水平;应用LABOSPECT 008AS全自动化学发光免疫分析仪检测血肌酐(serum creatinine,SCr)、尿酸(uric acid,UA)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)水平。应用ACUSON SC2000行心脏彩超检查,获取左室射血分数(left ventricular ejection fraction,LVEF)值。
1.5实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)法检测血清miR-139-5p水平 取冻存血清,解冻后采用Trizol法提取总RNA,通过反转录试剂盒(上海优选生物科技有限公司)将其逆转录为cDNA,并以cDNA为模板进行qRT-PCR。miR-139-5p引物序列[13]:上游,5′-GTACACTCTGTGACTCTCAG-3′;下游,5′-ATCGTAC-TTGATACAC-3′。以U6为内参,通过2-ΔΔCt法计算miR-139-5p的相对表达量。
1.6酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测血清VEGFR-1表达水平 取冻存血清,解冻后采用ELISA法检测血清VEGFR-1表达水平,试剂盒购自上海优选生物科技有限公司,实验操作严格按照试剂盒说明书进行。
1.7随访 患者出院后每月通过电话或门诊方式进行随访,记录MACE发生情况。AMCE包括再发胸痛、心力衰竭、脑卒中、再发心肌梗死、脏器出血、再次血运重建、支架内血栓、支架内再狭窄、死亡等事件[14-15]。随访时间6个月。
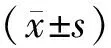
2 结果
2.1三组临床资料比较 三组WBC、SCr、TG、LDL-C和LVEF水平比较差异有统计学意义(P<0.05)。与对照组相比,AMI组WBC、SCr、TG、LDL-C水平更高,LVEF降低,差异有统计学意义(P<0.05)。AMI组WBC、TG、LDL-C和Gensini评分高于UAP组,LVEF水平低于UAP组,差异有统计学意义(P<0.05)。见表1。
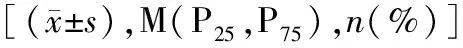
表1 三组临床资料比较
2.2三组血清miR-139-5p和VEGFR-1表达水平比较 与对照组比较,UAP组和AMI组血清miR-139-5p表达水平更高,VEGFR-1表达水平更低,差异有统计学意义(P<0.05)。且AMI组血清miR-139-5p表达水平较UAP组显著升高(P<0.05),但两组血清VEGFR-1表达水平比较差异无统计学意义(P>0.05)。见图1。
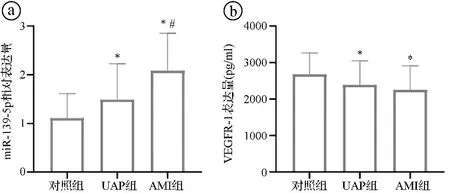
ⓐ三组血清miR-139-5p水平比较(F=42.594,P<0.001);ⓑ三组血清VEGFR-1水平比较(F=15.164,P<0.001);与对照组比较,*P<0.05;与UAP组比较,#P<0.05
2.3ACS患者血清miR-139-5p表达水平与VEGFR-1表达水平的相关性分析结果 Pearson相关性分析结果显示,ACS患者血清miR-139-5p表达水平与VEGFR-1表达水平呈负相关(r=-0.189,P=0.010)。见图2。
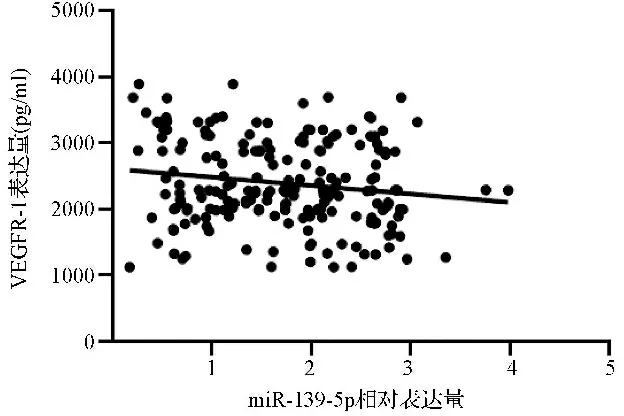
图2 ACS患者血清miR-139-5p、VEGFR-1表达水平的散点图
2.4MACE组与非MACE组临床资料比较 176例ACS患者失访2例。在随访期间,发生MACE 29例(MACE组),其中再发胸痛13例,心力衰竭6例,再次血运重建5例,卒中2例,脏器出血2例,支架后再狭窄1例;未发生MACE 145例(非MACE组),两组出院后的用药情况差异无统计学意义(P>0.05)。与非MACE组比较,MACE组血清miR-139-5p、Gensini评分、SCr升高,LVEF降低(P<0.05),但VEGFR-1水平比较差异无统计学意义(P>0.05)。见表2。
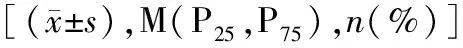
表2 MACE组与非MACE组临床资料比较
2.5血清miR-139-5p表达水平与MACE发生的关联性分析结果 以MACE发生情况为因变量(发生=1,未发生=0)进行Cox回归分析,经不同风险校正后结果显示,较高的血清miR-139-5p表达水平是促进MACE发生的危险因素(P<0.05)。见表3。

表3 血清miR-139-5p表达水平与MACE发生的Cox回归分析结果
2.6血清miR-139-5p表达水平预测ACS患者术后发生MACE的效能分析结果 ROC曲线分析结果显示,血清miR-139-5p表达水平能有效预测术后MACE发生[AUC(95%CI)=0.81(0.73~0.89),P<0.001],其最佳截断值为2.08,对应的灵敏度为82.83%,特异度为66.28%。见图3。进一步通过K-M曲线分析发现,血清miR-139-5p表达水平≥2.08的ACS患者的无MACE生存时间较血清miR-139-5p表达水平<2.08者更短,差异有统计学意义(P<0.001)。见图4。
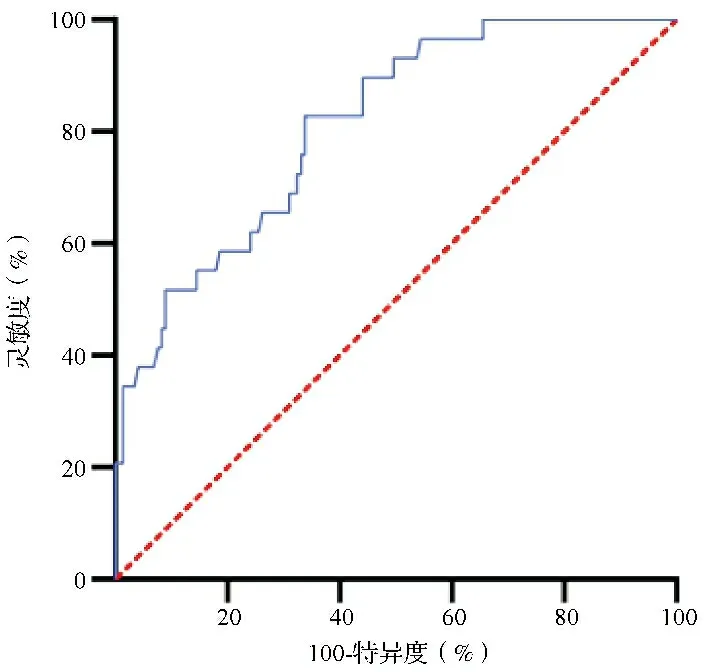
图3 血清miR-139-5p表达水平预测ACS患者术后MACE发生的ROC曲线图

图4 miR-139-5p表达水平≥2.08者与miR-139-5p表达水平<2.08者的K-M曲线图
3 讨论
3.1近年来,miRNAs在心血管疾病中的作用逐渐受到关注,研究不同疾病状态下相关miRNAs的表达情况及调控机制对心血管疾病的诊治及进展评估具有重要意义。大量研究证实miRNAs与冠心病的发生、发展有关[16-18]。作为其中的一员,miR-139-5p可调控肿瘤细胞增殖、凋亡[19],近期研究发现,miR-139-5p与内皮及平滑肌细胞增殖、迁移,以及心肌细胞凋亡、血管再生等心血管病理过程关系密切[5-7]。Zhang等[20]研究发现,miR-139-5p与血管生成密切相关。在平滑肌细胞模型中,miR-139-5p可抑制胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)表达而促进血管平滑肌细胞增殖并抑制其凋亡[6]。在缺氧诱导的心肌细胞凋亡模型中,孟宪玉等[21]发现,miR-139-5p可促进缺氧状态下心肌细胞凋亡。在颈动脉粥样硬化中,miR-139-5p水平与颈动脉厚度密切相关[22]。在心肌梗死患者中,Wang等[8]发现,miR-139-5p在AMI中呈高表达,并可通过抑制VEGFR-1表达调控内皮细胞功能,进而影响AMI病情进展。VEGFR-1作为一种跨膜蛋白,可与内皮细胞生长因子特异结合,在内皮和平滑肌细胞增殖、白细胞活化、血管生成等方面发挥重要作用。相关研究显示VEGFR-1可被miR-139-5p靶向激活并发挥功能[23]。
3.2目前,关于miR-139-5p在心血管疾病中的表达情况尚未定论。有研究发现,在大脑缺血再灌注损伤中,miR-139-5p表达水平升高能够减轻缺氧引起的脑损伤,从而发挥负向调控作用[24-25]。与既往研究相似,本研究结果显示ACS患者血清miR-139-5p表达水平升高,VEGFR-1表达水平降低,且两指标呈负相关。进一步分析发现,血清miR-139-5p表达水平对预测ACS患者术后发生MACE具有应用价值,当miR-139-5p表达水平≥2.08时,ACS患者发生MACE的风险显著升高。笔者猜测当冠脉血管狭窄或闭塞时,miR-139-5p被激活释放进入循环中,并可能通过以下途径来调控相关病理过程:(1)通过c-jun/血管内皮生长因子(vascular endothelial growth factor,VEGF)/血小板衍生生长因子-B(platelet-dervied growth factor-B,PDGF-B)通路降低内皮细胞增殖、迁徙和修复能力[26],未被修复的内皮细胞更容易受到级联反应影响,从而加重血管阻塞;(2)通过影响GLP-1和VEGFR-1功能而促进平滑肌细胞增殖、迁徙,加重动脉粥样硬化[6,8];(3)促进缺氧状态下心肌细胞凋亡,增加受损心肌面积,从而加重病情进展[21]。
3.3目前,关于miR-139-5p对ACS发生、发展的作用机制尚不明确。有关研究显示,在心肌缺血再灌注损伤中,miR-139-5p具有潜在的心脏保护作用[27],在心肌组织中高水平的miR-139-5p可通过蛋白激酶B(protein kinase B,AKT)/糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)信号通路消除细胞内氧化应激产物,并发挥抗凋亡作用[28]。而在H9C2心肌母细胞中,miR-139-5p可受lncRNA H19调控,通过调节转录因子Sox8的活性减轻心肌细胞损伤[29]。在大脑缺血再灌注损伤模型中,miR-139-5p也可通过调控叉头框蛋白O1/Kelch样ECH相关蛋白1/核转录因子红素2相关因子2轴发挥抗焦亡和血管保护作用[30]。因此,关于miR-139-5p在心血管疾病中的具体作用及调控机制仍有待进一步研究。
综上所述,血清miR-139-5p和VEGFR-1表达水平与ACS关系密切,可能是影响ACS患者预后的独立危险因素。但本研究也有一定的局限性:(1)本研究仅为单中心研究,纳入研究对象代表性有限;(2)未能根据患者的治疗方案进行分层分析;(3)随访时间较短;(4)miR-139-5p的具体作用机制尚需进一步研究。
