钌(Ru)修饰的锆基金属有机框架材料(Zr-MOF)催化酰胺化反应
2023-08-10黄飞鸿王乐张朋飞
黄飞鸿,王乐,张朋飞
(东华大学 材料科学与工程学院 纤维材料改性国家重点实验室,上海 201600)
含氮分子是大部分生物活性分子、药物合成中间体、天然产物和功能性材料的重要组成单元[1-3]。酰胺化反应作为最古老的有机化学反应之一,能够准确地在分子内引入氮原子,酰胺基团具有独特的氢键能力,其中普遍存在的酮互变异构体,酰胺基团中就存在两种不同类型的氢键位点,一部分是羰基,其可以作为氢键的受体,另一部分则是可以作为氢键供体的氨基。从而实现分子的生物活性和药化性质的导向转变[4-5]。据统计,市场上在售的医药药物分子排行榜中前200位中,有118种药物分子含有氮原子。早在2007年,全球制药公司就把如何实现酰胺键的构建列入到抢先研究的项目当中,至此以来,酰胺键的构建一直都是有机化学领域亟需解决的研究问题。然而传统酰胺化反应大多需要较高的反应温度来促进偶联反应的进行,但存在着酰氯储存易分解、化学废物多、反应条件严苛等限制因素[6-7]。而且会浪费大量的缩合试剂,成本过高。随着研究的不断深入,通过催化方法得到酰胺类产物,能够兼顾经济环保的同时,还能实现酰胺化产物的高效产出。于是愈来愈多的科研人员将目光转移到合成稳定高效的催化剂降低反应势垒来催化酰胺化反应进行[8-9]。目前酰胺化反应的催化剂主要是通过贵金属配合物或者氮杂环卡宾过渡金属配合物等金属催化剂催化醛类、醇类和酮类小分子酰胺化。这类方法由于底物范围较窄、存在金属离子残留、产物不易分离以及成本过高等因素大大限制了其在工业领域的应用。如何克服以上不足,构建一个稳定高效的催化反应体系实现酰胺的高效合成是一个亟需解决的研究问题。
金属有机框架材料(MOFs)是一类由金属离子/团簇和高度对称的有机配体,通过金属与配位原子的强配位作用生成的一类具有永久空隙的晶态多孔材料[10-12]。MOFs不仅有精确的微化学环境,明确的活性位点,还具有丰富的结构预设计性,可以通过对金属离子/团簇和配体的调控以及对MOFs的合成后修饰来得到一系列具有特定功能的MOFs。如今,人类日常生活中用到的各种化学产品95%以上(按体积计)是通过工业生产和加工出来的,而催化剂是工业生产和产品加工过程中最为关键的因素,这使得对更高效催化材料的研究成为一个激动人心且充满活力的研究领域。金属有机框架材料由于其前所未有的结构多样性、固有的有机杂化-无机性质、存在不协调的金属位置和易于接近的有机支柱、合理设计的可能性以及明确的孔隙度等特点,使成为了非均相催化剂设计的最佳平台。一般来说金属有机框架材料可以通过以下几个位置进行催化作用:1)当金属氧簇出现空配位点时,可以通过材料裸露的金属位点进行催化;2)通过配体的设计引入催化位点;3)利用杂化材料光电属性和配体与金属间电荷转移来触发光催化过程;4)作为其他催化位点(如纳米颗粒、酶或其他部分)封装的宿主;5)通过MOF支架的合成后改性;6)作为通过控制分解形成纳米颗粒或单中心催化剂的前体;以及通过结合上述几个方式进行催化剂的设计。因此,MOFs逐渐成为了非均相催化剂设计与构建的最佳平台,而锆基金属有机框架材料(Zr-MOFs)由于Zr-O键的强配位作用,使得Zr-MOFs表现出更加优异的热稳定性和化学稳定性[13]。光催化由于其清洁、无污染等优点,且光敏剂小分子能够在光激发下跃迁至激发态通过电子转移等方式实现小分子高效氧化。基于以上等优点,本文通过对锆基金属有机框架材料(Zr-MOFs)进行后修饰改性并作为非均相光催化剂,光催化氧化醛类分子原位生成酰氯活性中间体,通过简单的一锅法反应,高效合成酰胺衍生物。
1 实验部分
1.1 催化剂合成
光催化剂小分子[Ru(dcbpy)(bpy)2]Cl2的合成首先在装有冷凝器和磁力搅拌棒的100 mL的双颈圆底烧瓶中加入三氯化钌(RuCl3,400 mg,1.92 mmol)、2,2′-联吡啶(bpy,600 mg,3.85 mmol)和氯化锂(LiCl,800 mg,18.87 mmol)。循环抽真空通氮气三次后,加入13 mL DMF溶液。将反应混合物在N2下回流24 h,反应完成后加入丙酮(120 mL)。最后,将混合物放在冰箱中过夜,得到粗黑绿色晶体(cis-Ru(bpy)2Cl2·2H2O)。过滤混合物并用去离子水和乙醚洗涤。然后,160 mg,0.33 mmol产物和 2,2′-联吡啶-5,5′-二羧酸(H2dcbpy,101 mg,0.42 mmol)混合在20 mL EtOH/H2O(体积比)中,在N2条件下回流24 h,通过真空浓缩除去溶剂后,在甲醇/乙醚混合溶液中重结晶得到[Ru(dcbpy)(bpy)2]Cl2,如图1所示。1H NMR(600 MHz,DMSO-d6):δ9.05(d,J= 8.5 Hz,1H),8.91(dd,J= 24.5,8.1 Hz,2H),8.53(dd,J= 8.4,1.9 Hz,1H),8.24(td,J= 7.9,1.5 Hz,1H),8.18(td,J= 7.9,1.5 Hz,1H),8.01(d,J= 1.8 Hz,1H),7.88~7.84(m,1H),7.81~7.77(m,1H),7.61(dd,J= 7.5,5.8 Hz,1H),7.51(dd,J= 7.5,5.8 Hz,1H)。
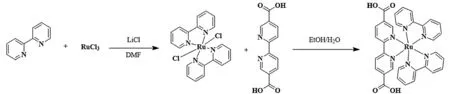
图1 [Ru(dcbpy)(bpy)2]Cl2的合成
MOFs的合成方法是根据已报道过的合成方法进行了适当的修改[14],PCN-808合成先称取四氯化锆(ZrCl4,60 mg,0.25 mmol)和配体(H4TPTB,30 mg,0.04 mmol),置于15 mL的耐高温玻璃瓶中。再加入酸性调节剂苯甲酸(2 g,16.39 mmol)和10 mLN,N-二甲基甲酰胺(DMF),放入90 Hz的超声波清洗机均匀分散20 min,待溶液完全澄清后移入到120 ℃高温烘箱中,3 d后,可以在常规光学显微镜下观察到针状无色透明晶体。待冷却至室温后,每天用10 mL DMF冲洗3次洗3 d,再用10 mL丙酮(Aceton)每天洗3次洗3 d,在80 ℃下抽真空10 h活化样品备用。
采用溶剂辅助的后修饰手法对合成后的MOFs材料进行光化学改性。取100 mg PCN-808于玻璃瓶中,另取40 mg的光催化剂小分子[Ru(dcbpy)(bpy)2]Cl2浸泡在20 mL的DMF溶液中 ,分别在装有MOFs的玻璃瓶中加入10 mL混合溶液,置于100 ℃的高温烘箱中,通过溶剂的动态吸附光催化剂小分子会与框架中未配位的Zr-O簇配位,从而固定在晶体框架内部,24 h 后取出。用新鲜的DMF溶液清洗3次后得到相应的PCN-808-Ru晶体有机框架材料,并对其进行下一步分析于表征。
1.2 催化剂表征
对合成的PCN-808以及后修饰的PCN-808-Ru进行了粉末X射线衍射分析(PXRD),从而确定样品的晶体构型,如图2a所示。通过实验得到的PXRD衍射图谱可以看出,实验合成的晶体以及通过溶剂辅助插入光催化剂小分子完成后修饰的晶体材料,与之前报道的晶体原型具有相同的结晶度,仅仅是相位发生了小小的偏移,由此可以证明,由后修饰法引入光催化位点并不会对晶体的结晶度产生过大的影响。为了进一步验证经过后修饰过程之后,光催化剂小分子[Ru(dcbpy)(bpy)2]Cl2是否成功地引入到晶体框架内部中,对后修饰后的材料进行了紫外近可见分析,首先根据相关报道,PCN-808晶体材料是没有光吸收的,如果成功地将配体分子引入的话,那么后修饰得到的PCN-808-Ru应该在[Ru(dcbpy)(bpy)2]Cl2对应的波长范围出现吸收特征峰,于是优先对光催化剂小分子[Ru(dcbpy)(bpy)2]Cl2,和MOFs材料进行了光谱分析(UV-vis),如图2b所示。由图可以明显看出,在经过后修饰处理得到的PCN-808-Ru相比与未处理的PCN-808在~475 nm左右出现了明显的吸收峰,而吸收峰的蓝移可能是因为晶体的空间结构和化学环境导致光敏剂分子构型发生改变。吸收峰的出现说明通过简单的溶剂法是可以很好地构建小分子[Ru(dcbpy)(bpy)2]Cl2与晶体框架上位配位的氧原子相互配位,从而通过配体的插入实现光催化位点的成功引入的。
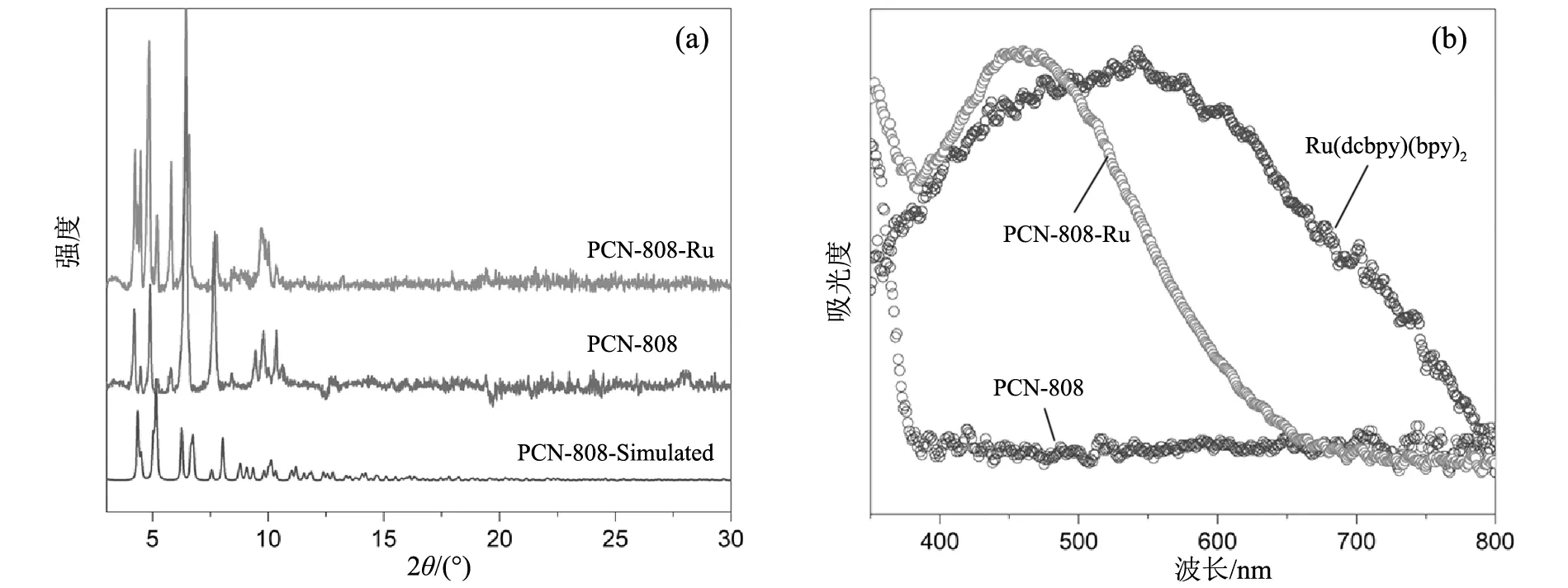
(a)PXRD图谱;(b)Uiv-vs图谱图2 PCN-808和PCN-808-Ru的PXRD图谱和Uiv-vs图谱
1.3 条件筛选
首先选取苯甲醛作为反应条件优化的模型底物,从反应时间,催化剂负载量,催化剂种类,氯源含量和光照等因素对最佳反应条件进行筛选,如表1所示。首先对反应时间进行了研究,分别在反应3,5,7 h分别取上清液做产率分析,结果表明在反应7 h效果最佳,如条目1~3所示。之后对催化剂用量和种类进行了对比分析,选取合成的小分子均相催化剂Ru(dcbpy)(bpy)2和PCN-808-Ru进行对比实验,实验结果表明当PCN-808-Ru的用量减少到5 mg(物质的量分数约3%时)的酰氯产率高达95%,而相同比例的传统均相小分子催化剂仅为88%,如条目3~5、8、9所示。其次对氯代试剂NCS的用量进行了研究,根据实验结果表明NCS的用量在1.5和3 mmol时,产率相当,但出于成本和环保角度考虑NCS用量在1.5 mmol最佳,如条目3、6~7所示。之后对有无光照,有无催化剂进行对比分析,发现几乎无产物生成,如条目10,11所示。综上所述,PCN-808-Ru催化酰胺化反应的最佳条件是:底物0.5 mmol,PCN-808-Ru(物质的量分数3%),NCS(1.5 mmol),MeCN(2 mL)反应7 h后旋干反应液,加入苄氧胺盐酸盐(3 mmol)和K2CO3(3 mmol)在4 mL DCM中反应16 h得到最终产物苄氧酰胺类衍生物。
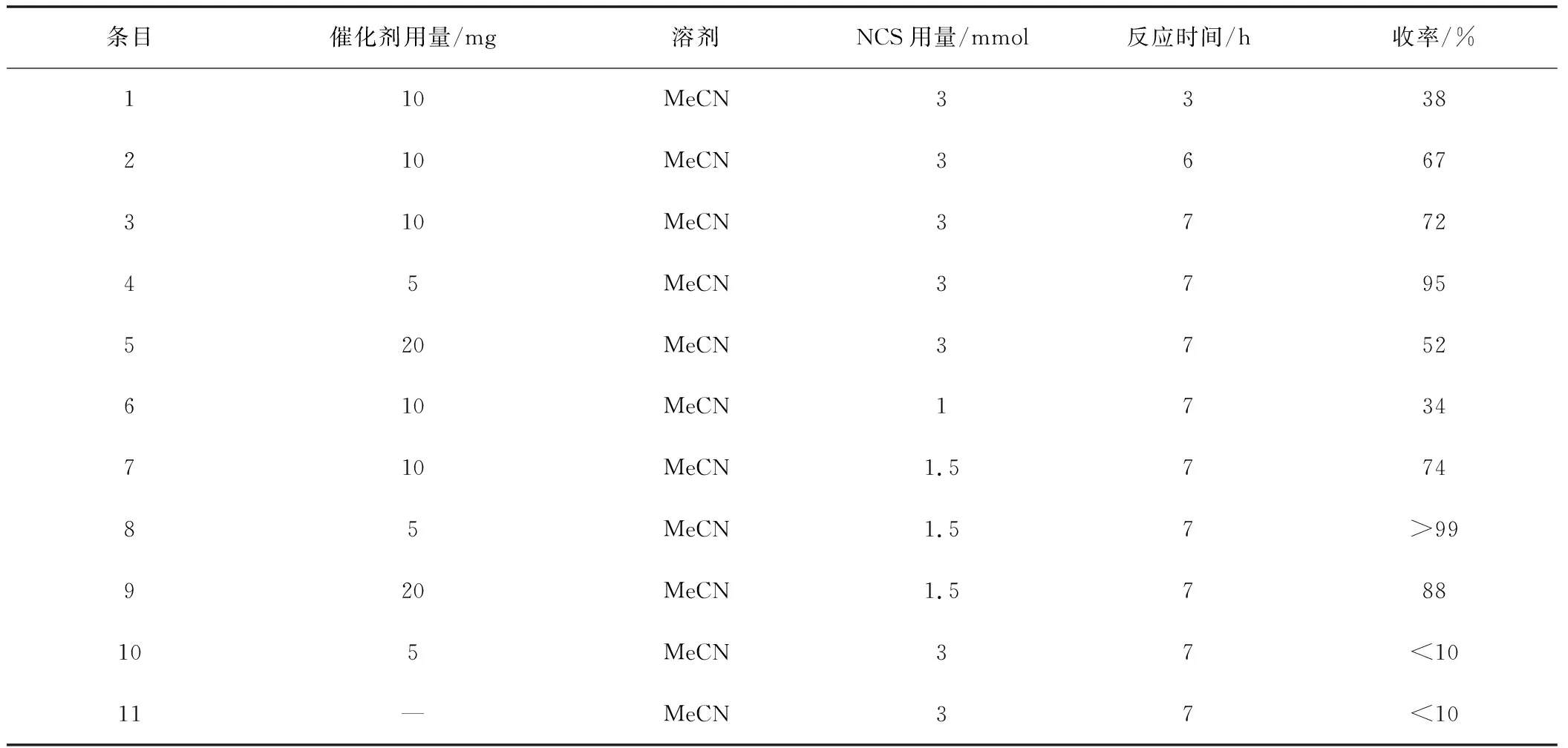
表1 PCN-808-Ru催化酰胺化反应条件优化图
2 结果与讨论
通过反应条件筛选得到最优反应条件之后,进一步对底物适用范围进行了拓展,包括杂原子邻位、富电子基团、缺电子基团取代的芳香醛类底物进行了反应研究,都取得较高的产率,底物范围拓展如图3所示。该反应体系对具有富电子基团取代的芳香醛类底物具有较高的产率,其中苯甲醛(1)和对甲基苯甲醛(2)的产率都高于80%,而具有缺电子基团取代的芳香醛的产率稍低于富电子基团。而对于缺电子基团的强弱对该反应体系的产率没有过大的影响。对氰基苯甲醛(4)、4-F-苯甲醛(5)、3-三氟甲基苯甲醛(6)和4-氯苯甲醛(7)的产率分别为73%,75%,62%和68%。综上所述,实验结果表明该反应体系对苄氧胺类盐酸盐和芳香醛的酰胺化反应具有高反应活性和官能团耐受性。
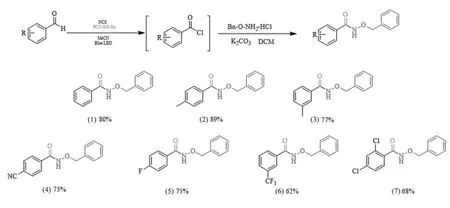
图3 底物范围拓展图
N-(benzyloxy) benzamide(1):由快速柱色谱纯化系统分离得到白色固体(洗脱剂:V正己烷∶V乙酸乙酯=8∶2)。1H NMR:δ11.81(s,1H),7.79~7.75(m,2H),7.57~7.52(m,1H),7.50~7.44(m,4H),7.43~7.38(m,2H),7.38~7.34(m,1H),4.95(s,2H)。13C NMR:δ164.44,135.94,132.37,131.63,128.95,128.48,128.35,128.33,127.13,77.03,40.06。
N-(benzyloxy)-4-methylbenzamide(2):由快速柱色谱纯化系统分离得到白色固体(洗脱剂:V正己烷∶V乙酸乙酯=8∶2)。1H NMR:δ8.84(s,1H),7.57(d,J= 8.0 Hz,2H),7.45~7.40(m,2H),7.40~7.32(m,3H),7.18(d,J= 7.9 Hz,2H),5.00(s,2H),2.37(s,3H)。13C NMR:δ142.71,135.46,129.45,129.43,129.13,128.86,128.73,127.18,78.43,21.61。
N-(benzyloxy)-3-methylbenzamide(3):由快速柱色谱纯化系统分离得到白色固体(洗脱剂:V正己烷∶V乙酸乙酯=8∶2)。1H NMR:δ8.12(s,1H),7.43(d,J= 7.2 Hz,3H),7.39~7.36(m,3H),7.35~7.30(m,1H),7.29~7.23(m,1H),7.18(d,J= 7.5 Hz,1H),5.22(s,2H),2.37(s,3H)。13C NMR:δ149.40,138.53,137.64,132.22,130.84,128.70,128.58,128.51,128.09,127.59,124.61,76.49,21.44。
N-(benzyloxy)-4-cyanobenzamide(4):由快速柱色谱纯化系统分离得到白色固体(洗脱剂:V正己烷∶V乙酸乙酯=8∶2)。1H NMR:δ12.04(s,1H),8.10~7.79(m,4H),7.49~7.29(m,5H),4.95(s,2H)。13C NMR:δ162.86,136.37,135.73,132.58,129.01,128.42,128.38,127.98,118.26,114.00,77.10。
N-(benzyloxy)-4-fluorobenzamide(5):由快速柱色谱纯化系统分离得到白色固体(洗脱剂:V正己烷∶V乙酸乙酯=8∶2)。1H NMR:δ8.87(s,1H),7.71~7.66(m,2H),7.44~7.40(m,2H),7.40~7.34(m,3H),7.06(t,J= 8.6 Hz,2H),5.00(s,2H)。13C NMR:δ165.97,164.29,135.29,129.63,129.46,128.99,128.80,128.18,115.93(d,J= 22.0 Hz),78.54。
N-(benzyloxy)-3-(trifluoromethyl) benzamide(6):由快速柱色谱纯化系统分离得到白色固体(洗脱剂:V正己烷∶V乙酸乙酯=8∶2)。1H NMR:δ8.16(s,1H),7.85(s,1H),7.75(d,J= 7.8 Hz,1H),7.61(d,J= 7.8 Hz,1H),7.49(t,J= 7.8 Hz,1H),7.44~7.41(m,2H),7.41~7.37(m,2H),7.36~7.32(m,1H),5.24(s,2H)。13C NMR:δ147.69,137.32,133.24,131.47,131.25,130.33,129.32,128.65,128.58,128.26,126.41(d,J= 3.5 Hz),123.81(d,J= 3.9 Hz),76.89。
N-(benzyloxy)-2,4-dichlorobenzamide(7):由快速柱色谱纯化系统分离得到白色固体(洗脱剂:V正己烷∶V乙酸乙酯=8∶2)。1H NMR:δ8.51(s,1H),7.85(d,J= 8.5 Hz,1H),7.47~7.38(m,6H),7.28~7.21(m,1H),5.25(s,2H)。13C NMR:δ145.20,137.23,136.15,134.43,129.72,128.72,128.63,128.56,128.25,128.04,127.54,76.93。
3 结论
采用溶剂辅助的后合成修饰法,对PCN-808进行光化学改性,并将PCN-808-Ru作为非均相光催化剂催化苯甲醛和苄氧胺盐酸盐的酰胺化反应。实验结果显示,该反应体系具有较高的产率以及对富电子和缺电子基团的芳香醛都具有较好的耐受性。该项研究结果拓宽了酰胺化产物的合成方法,后合成改性可以很好地对MOFs材料进行导向改性,从而得到具有特定功能的MOFs材料,对推动MOFs材料在催化化学方面的应用具有重大意义。
