lncRNA717对胃癌细胞生物学行为的影响及调控机制研究
2023-08-09周善学陆蓉丹朱春霞邵永富倪超余筱燕严嘉宁郑四鸣
周善学 陆蓉丹 朱春霞 邵永富 倪超 余筱燕 严嘉宁 郑四鸣
胃癌是世界上第四大常见的恶性肿瘤,在胃肠道恶性肿瘤中最为多见,严重威胁人类生命和健康[1-2],尤其是晚期胃癌患者,预后相对较差[3-4]。胃癌发病和转移机制具有多因素性和复杂性,研究胃癌分子机制十分必要[5]。长链非编码RNA(long non-coding RNA,lncRNA)是一种不具备编码蛋白质功能、长度超过200 bp 的RNA 分子[6],在多种恶性肿瘤中异常表达,参与肿瘤的发生、发展[7-8]。研究发现,lncRNA 可通过与微小RNA(microRNA,miRNA)互相作用来调节基因表达,是调控转录因子和miRNA 作用的关键内源性RNA[9]。lncRNA 在胃癌中异常表达,与肿瘤-淋巴结-转移分期(tumor node metastasis classification,TNM)、肿瘤浸润,淋巴和远处转移相关[10]。如lncRNA Linc01270在胃癌中高表达,通过上调肝配蛋白A3(ephrin A3,EFNA3)表达加速细胞增殖、迁移和侵袭[11];lncRNA CASC11 在胃癌中过表达,可有效抑制胃癌细胞凋亡,加速细胞周期[12];lncRNA Linc01133 在胃癌中高表达,诱导上皮-间充质转化(epithelial-mesenchymal transition,EMT)相关蛋白表达下调,从而抑制胃癌肿瘤的转移[13];lncRNA MT1JP 在胃癌细胞中低表达,通过下调F-框WD 重复域蛋白7(recombinant F-Box and WD repeat domain containing protein 7,FBXW7)表达来抑制肿瘤的生长[14]。目前lncRNA717 在胃癌发生、发展中的功能和调控机制尚不清楚。本研究拟分析lncRNA717 对胃癌细胞生物学行为的影响及调控机制,以期为胃癌的治疗提供新的潜在靶点。
1 材料和方法
1.1 主要试剂 TRIzol 试剂购自美国Ambion 公司,批号:350102;NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix 试剂盒、NovoStart®SYBR qPCR SuperMix plus 试剂盒均购自中国Novoprotein 公司,批号分别为0520891、05229413;Lipofectamine 2000 试剂盒购自美国Invitrogen 公司,批号:2220839;细胞增殖和毒性检测(cell counting kit-8,CCK-8)试剂盒、聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)胶购自中国NCM Biotech 公司,批号分别为20220814、20220713;4%多聚甲醛购自中国Biosharp 公司,批号:70071800;结晶紫染液、RIPA 细胞裂解液、TBST 缓冲液购自Solarbio 公司,批号分别为20220508、20221013、20220615;Pierce Renilla 荧光素酶双检测试剂盒购自美国Thermo 公司,批号:ML165248;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自中国Beyotime 公司,批号:092221220517;干扰素调节因子(interferon regulatory factor,IRF)7 和甘油醛-3-磷酸脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)抗体购自英国Abcam 公司,批号分别为GR3368578-12、GR3107462-11;电化学发光(electrochemical luminescence,ECL)液购自美国Advansta 公司,批号:210414-73。
1.2 组织标本 收集2021 年1 至12 月宁波大学附属第一医院手术切除或活检的31 例胃癌组织及配对癌旁组织标本,液氮冻存。纳入标准:手术前未接受任何治疗;经病理检测证实。排除标准:无行为能力或不完全行为能力者,妊娠期或哺乳期妇女,患有心肌梗死、肌肉组织病变患者,剧烈运动和强体力劳动者,意识障碍或严重精神疾病者,重要脏器功能衰竭不能耐受全麻者;急性感染合并高热、感染性休克患者。本研究经本院医学伦理委员会审查通过(批准文号:2020KY52)。所有患者均签署知情同意书。
1.3 细胞系 胃癌细胞系AGS、HGC-27 购于中国科学院上海生命科学研究所,人正常胃黏膜细胞系GES-1 购于中国医学科学院肿瘤医院。使用含有10% FBS 和1%青霉素/链霉素的DMEM 培养基,在5% CO2,37 ℃细胞培养箱中培养,常规传代。取对数生长期AGS、HGC-27 细胞接种于6 孔板,待长至50%~60%融合度后,对细胞进行分组,并使用Lipofectamine 2000试剂盒方法处理细胞。分组(1):分为过表达对照组和lncRNA717 过表达组,分别转染过表达对照质粒和lncRNA717 过表达质粒;分组(2):分为miR-762 过表达组、miR-762 敲低组和对照组,分别转染miR-762模拟物、miR-762 抑制物和模拟物对照;分组(3):分为敲低对照组、lncRNA717 敲低组、过表达对照组和lncRNA717 过表达组,分别转染敲低对照干扰miRNA、lncRNA717 敲低miRNA、过表达对照质粒和lncRNA717过表达质粒;分组(4):分为对照组、miR-762 过表达组和共表达组,分别转染模拟物对照、miR-762 模拟物和miR-762模拟物+lncRNA717过表达质粒。质粒用100 μL DMEM培养基静置培养5 min,转移到含有Lipofectamine 2000 的培养基中,轻柔混匀,静置20 min;混合后的培养基加入到用无血清DMEM 培养基培养的6 孔细胞板中,十字混匀后培养4 h,换成含血清的DMEM 完全培养基。5% CO2,37 ℃培养箱中培养,用于后续实验。
1.4 检测方法
1.4.1 不同组织和细胞中lncRNA717 表达的检测 采用qRT-PCR 法。使用TRIzol 试剂从组织标本(胃癌组织、癌旁组织)和3 种细胞、分组(1)和分组(2)各组细胞中提取总RNA。使用NovoScript®Plus All-in-one 1st Strand cDNA Synthesis SuperMix 试剂盒将RNA 反转录为cDNA,然后用NovoStart®SYBR qPCR SuperMix plus 进行qRT-PCR 检测。qRT-PCR 反应体系:模板1.0 μL,上、下游引物各0.4 μL,SYBR 5.0 μL,用DEPC水补足10.0 μL。qRT-PCR 反应程序:90 ℃,2 min 变性;95 ℃,15 s;60 ℃,30 s;72 ℃,30 s。循环40 次。以GAPDH 为内参,根据2-ΔΔCt法计算各样本中lncRNA717 相对表达量。引物序列见表1。
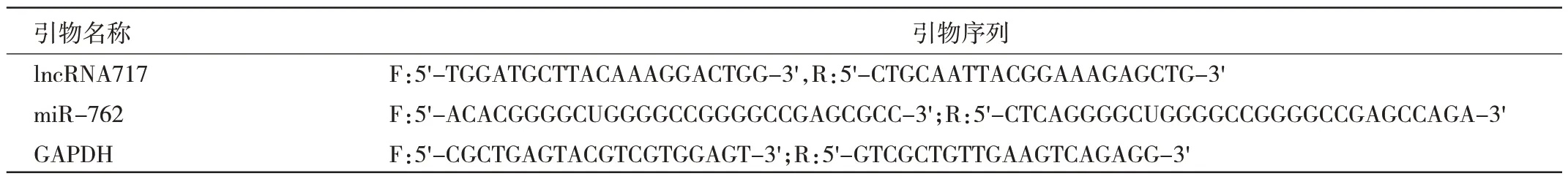
表1 引物序列
1.4.2 转染细胞中miR-762 表达的检测 采用qRTPCR 法。取分组(3)各组细胞提取总RNA,逆转录为cDNA,并进行qRT-PCR 检测。反应体系:模板1.0 μL,miR-762 上、下游引物各1.0 μL,SYBR 10.0 μL,用DEPC 水补足20.0 μL。反应程序:90 ℃,3 min 变性;95 ℃,12 s;62 ℃,40 s;72 ℃,30 s。循环40 次。以U6为内参。根据2-ΔΔCt法计算各样本中miR-762 相对表达量。引物序列见表1。
1.4.3 细胞活力检测 采用CCK-8 法。取分组(1)和分组(4)各组细胞,调整密度为5×104个/mL,接种于96 孔板,100.0 μL/孔,分别培养0、24、48、72 和96 h,每孔加入10.0 μL CCK-8 溶液,继续孵育2 h,测定各组细胞在450 nm 波长处的吸光度,吸光度值越高表明活细胞数目越多,即细胞活力越强。
1.4.4 细胞增殖能力检测 采用克隆形成实验。取分组(1)和分组(4)各组细胞,调整密度为1×104个/mL,接种于6 孔板,100.0 μL/孔,每隔4 d 更换培养基,连续培养14 d。待观察到明显的细胞集落后,每孔加入1 mL 4%多聚甲醛固定15 min,再用1 mL 结晶紫染液染色15 min,对细胞集落直接拍照记录,对蓝色细胞集落进行计数分析。
1.4.5 细胞迁移能力检测 采用划痕试验。取分组(1)和分组(4)各组细胞,接种于6 孔板,待各组细胞培养至铺满孔底,使用200.0 μL 黄色枪头在孔底划1 条笔直的线,用PBS 洗去脱落细胞;加入无血清培养基培养。在0、24 h 时取出细胞,使用倒置光显微镜4×镜下观察并拍照,用Image J 分析细胞迁移面积,计算相对迁移率。
1.4.6 细胞侵袭能力检测 采用Transwell 试验。取分组(1)和分组(4)细胞,调整密度为5×104个/mL,加入到细胞上室中,同时加入200.0 μL 无血清培养基;下室中加入750.0 μL 含有10%FBS 的DMEM 培养基。孵育48 h 后取出小室,加入750.0 μL 4%多聚甲醛固定15 min,再用750.0 μL 结晶紫染液染色15min,用湿棉签擦去表面细胞,使用倒置光显微镜10×镜下观察拍照,统计并比较穿过小室的细胞数目。
1.4.7 细胞荧光素酶活性检测 采用荧光素酶报告基因实验。通过工具网站TargetScan预测分析lncRNA717与miR-762 的碱基结合位点,构建lncRNA717-野生型和lncRNA717-突变型双荧光素酶载体。取分组(2)中的miR-762 过表达组和对照组细胞,使用Lipofectamine 2000 试剂盒分别对lncRNA717-野生型、lncRNA717-突变型共转染,培养48 h 后取出细胞,裂解液裂解后根据荧光素酶双检测试剂盒说明书方法测定共转染的4 组细胞相对荧光素酶活性。
1.4.8 细胞IRF7 蛋白表达的检测 采用Western blot法。收集分组(2)和分组(4)各组细胞,PBS 洗涤2 次后加入RIPA 裂解液,4 ℃,12 000 r/m 离心20 min,收取上清液,使用BCA 法测量蛋白浓度;经SDS-PAGE 120 V 恒压电泳、湿法转膜,TBST 清洗后将膜置于5%脱脂奶粉中封闭1 h,分别加入稀释好的IRF7 和GAPDH 抗体,4 ℃水平摇床孵育过夜。加入稀释的二抗,室温孵育1 h,用ECL 化学发光液显色,拍照记录。使用Image J 软件分析蛋白灰度值,以GAPDH 为对照计算IRF7 蛋白相对表达水平。
1.5 统计学处理 使用GraphPad Prism 9 统计软件。计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t检验。各项实验均进行3 次独立重复。P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 lncRNA717 在2 种组织和3 种细胞中表达的比较 相比癌旁组织,胃癌组织中lncRNA717 显著低表达(P<0.01);相比人正常胃黏膜细胞系GES-1 细胞,胃癌细胞系AGS、HGC-27 中lncRNA717 显著低表达,差异均有统计学意义(均P<0.01),见图1。

图1 lncRNA717 表达的比较(A:胃癌组织和癌旁组织中;B:人正常胃黏膜细胞和胃癌细胞系中)
2.2 过表达lncRNA717 对胃癌细胞生物学行为的影响 相比过表达对照组,lncRNA717 过表达组细胞lncRNA717 表达水平上调3~5 倍,差异均有统计学意义(均P<0.05),见图2A(插页)。细胞活力检测结果显示,与对照组相比,lncRNA717 过表达组细胞培养96 h 时吸光度值显著降低,差异均有统计学意义(P<0.01),提示过表达lncRNA717 抑制细胞生长,见图2B(插页)。细胞克隆实验表明,lncRNA717 过表达组细胞集落数显著减少(P<0.05),提示过表达lncRNA717 抑制细胞增殖,见图2C(插页)。细胞迁移和侵袭能力检测结果显示,相比过表达对照组,lncRNA717 过表达组细胞相对迁移率显著降低,穿过小室的细胞数显著减少,差异均有统计学意义(均P<0.05),提示过表达lncRNA717 有效抑制了细胞的迁移和侵袭,见图2D、E(插页)。

图2 lncRNA717 对胃癌细胞生物学行为的影响(A:两组细胞lncRNA717 表达的比较;B:两组细胞活力的比较;C:两组细胞增殖能力的比较;D:两组细胞迁移能力的比较;E:两组细胞侵袭能力的比较)
2.3 lncRNA717 与miR-762 靶向结合的预测和验证TargetScan 预测发现,lncRNA717 与miR-762 存在高度保守的碱基结合位点,见图3A。与对照组相比,miR-762 过表达组的野生型相对荧光素酶活性显著降低(P<0.01),而突变型无显著变化,提示lncRNA717 和miR-762 存在直接相互作用,见图3B。相比对照组,miR-762 敲低组lncRNA717 相对表达量显著上调,miR-762 过表达组lncRNA717 相对表达量显著下调;同时,lncRNA717 敲低组miR-762 相对表达量显著高于敲低对照组,lncRNA717 过表达组miR-762 相对表达量显著低于过表达对照组,差异均有统计学意义(均P<0.05),见图3C。Western blot 检测结果显示,miR-762 过表达组IRF7相对表达量低于对照组,差异有统计学意义(P<0.05),见图3D。可见lncRNA717 可以负调控miR-762 和正调控IRF7 的表达,提示lncRNA717/miR-762/IRF7调节轴抑制胃癌的进展。
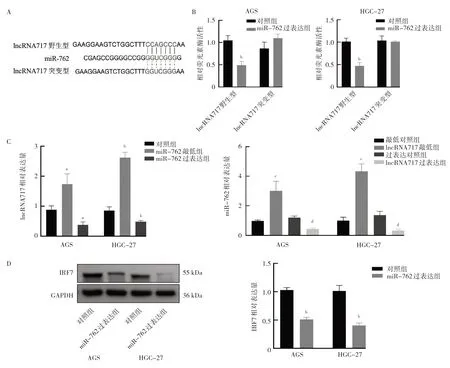
图3 lncRNA717 与miR-762 靶向结合的预测和验证(A:miR-762 与lncRNA717 的结合位点;B:突变型和野生型相对荧光素酶活性比较;C:miR-762 干扰下的lncRNA717 的表达和lncRNA717 干扰下的miR-762 的表达比较;D:IRF7 蛋白相对表达量比较)
2.4 过表达miR-762 和lncRNA717 对胃癌细胞生物学行为的影响 相比对照组,miR-762 过表达组在培养96 h 时细胞吸光度值显著升高,细胞集落数显著增多,相对迁移率和侵袭细胞数显著增加,IFR7 蛋白相对表达量显著降低,差异均有统计学意义(均P<0.05),提示过表达miR-762 可促进细胞生长、增殖,提高迁移和侵袭能力;相比miR-762 过表达组,共表达组在培养96 h 时细胞吸光度值显著降低,细胞集落数显著减少,相对迁移率和侵袭细胞数显著降低,IFR7 相对表达量显著升高,差异均有统计学意义(均P<0.05),提示lncRNA717 过表达逆转了miR-762 对细胞生长、增殖、迁移和侵袭的促进作用。见图4(插页)。
图4 miR-762 和lncRNA717 对胃癌细胞生物学行为的影响(A:3 组细胞吸光度的比较;B:3 组细胞增殖的比较;C:3 组细胞迁移能力的比较;D:3 组细胞侵袭能力的比较;E:3 组细胞IRF7 表达的比较)
3 讨论
lncRNA 是一种通常情况下不编码蛋白质的单链RNA 分子,近年来被证实在胃癌中起到重要调控作用[15-17]。如Zhang 等[18]发现lncRNA CRNDE 通过富含丝氨酸/精氨酸剪接因子6(rich in serine/arginine splicing factor 6,SRSF6)调节的磷脂酰肌醇结合网格蛋白装配蛋白(phosphatidylinositol binding network protein assembly protein,PICALM)替代拼接削弱了胃癌的抗药性。lncRNA LINC00942 通过抑制武藏RNA 结合蛋白2(RNA-binding protein Musashi homolog 2,MSI2)降解提高了细胞性骨髓细胞增多病毒癌基因(cellular-myelocytomatosis viral oncogene,c-Myc)mRNA 的稳定性,从而促进胃癌的耐药性[19]。本研究结果显示,敲低lncRNA717 能显著促进胃癌细胞增殖、迁移和侵袭,过表达lncRNA717 则显著抑制胃癌细胞的增殖、迁移和侵袭,这表明lncRNA717 可能在胃癌的发展中起到重要作用。
竞争性内源RNA(competing endogenouse RNA,ceRNA)假说认为,lncRNA 可以作为miRNA 的海绵负向调节miRNA 的活性,减弱其对靶基因的抑制作用[20-21]。已有研究发现miR-762 在肿瘤中具有调节作用。如miR-762 通过靶向假定肿瘤抑制亮氨酸拉链蛋白1(leucine zipper putative tumor suppressor 1,LZTS1)调节参与胃癌发展的磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,又称AKT)和Hippo 通路的激活[22],活化miR-762 可赋予非小细胞肺癌吉非替尼的抗性[23]。Tarager-Scan 数据库预测分析,lncRNA717 可能与miR-762 存在相互结合的位点。本研究发现miR-762 与lncRNA717 的表达量成负相关,双荧光素酶实验验证了miR-762 与lncRNA717 的靶向作用。即lncRNA717 通过靶向结合miR-762 来抑制胃癌发展。
IRF7 是一种多功能转录因子,能调控Ⅰ型干扰素,而Ⅰ型干扰素的异常与癌症等疾病有关[24]。Xing等[15]筛选了miRDIP、TargetScan 和miRTarBase 等3 个成熟的数据库,发现IRF7 是共享的唯一靶基因;荧光素酶报告测定显示,miR-762 显著抑制了野生型的IRF7活性,但突变型不受影响。IRF7 蛋白表达水平在miR-762 表达下降后反而增加,提示miR-762 能靶向结合IRF7 基因,抑制IRF7 的抗癌作用。本研究结果证明IRF7 的表达与miR-762 负相关,过表达miR-762会显著降低IRF7 表达水平,从而促进胃癌细胞的增殖、迁移和侵袭,而共转染lncRNA717 使得这一现象被显著逆转,表明IRF7 是lncRNA717/miR-762 的下游靶标,lncRNA717 结合miR-762 来促进IRF7 表达起到抑制癌细胞的作用。
本研究还存在一定局限,后续可开展以下深入探索,一是检测lncRNA717 在胃癌患者血清中的表达水平,比较其在胃癌患者和健康对照之间的差异表达。二是结合临床病理数据进行分析,探讨lncRNA717 表达水平与胃癌分期、患者预后及临床病理资料的关系。本研究仅在体外验证了lncRNA717/ miR-762/IRF7 轴在细胞中的作用,但缺乏体内动物数据。因此,后续可通过构建动物模型验证lncRNA717 在胃癌模型动物中的调节机制。
综上所述,lncRNA717 在胃癌发生、发展中存在重要作用。lncRNA717 通过竞争miR-762,抵消miR-762对IRF7 的抑制作用,从而抑制胃癌细胞侵袭、增殖和迁移。
