米曲霉固态发酵铁皮石斛叶工艺条件的优化
2023-08-07徐哲萱杨海龙
◎ 徐哲萱,杨海龙
(温州大学 生命与环境科学学院,浙江 温州 325035)
在微生物发酵过程中,微生物可能对植物源基质中的活性物质进行一系列氢化、去糖基化、脱脂等反应,从而实现对功能活性物质的转化和利用[1]。真菌固态发酵常用来增加植物源材料的营养价值,如提高总酚、黄酮类化合物含量[2-3],水分、温度和发酵时间等发酵工艺参数直接影响着发酵产物中功能性成分含量及其生物活性[4-5]。梅玉立[6]在研究中发现,桑叶经最优发酵条件处理后生物碱含量和黄酮含量与发酵前相比分别增加了26.53%和29.56%,为桑叶活性成分的开发利用提供了参考。曹璐蕾[7]将由最优发酵工艺获得的大豆加工副产物制作成饲料饲喂肉鸡,增强了肉鸡的免疫力。夏雨等[8]采用酿酒酵母等多种益生菌复合发酵苦荞和铁皮石斛叶两种原料,以酒精度和总酸含量为指标,通过单因素试验及正交试验优化苦荞石斛叶发酵酒的生产工艺,结果表明其最优发酵条件为发酵时间9 d,接种量1.5%,发酵温度32 ℃,白砂糖添加量18%,在此条件下开发出了风味独特、营养丰富的苦荞石斛叶发酵酒 。因此,发酵工艺优化是一种最大化提升发酵效果的有效手段。
米曲霉是传统发酵和食品加工中的重要菌种[9],应用于酱油[10]、大豆酱[11]和白酒等传统食品生产中[12]的历史较为悠久。近些年,随着人们健康意识的增强,研究者开始关注米曲霉发酵在提升发酵产物功能活性方面的应用,如抗氧化[13]、降血糖[14]等。研究表明,米曲霉在固态发酵过程中能产生多种水解酶,如纤维素酶和果胶酶等[15],产生的酶可降解植物细胞壁从而促进有效成分的释放,并可能对其中的成分进行生物转化,提高其生物活性。本研究通过单因素试验,确定初始含水率(v/w)、发酵温度、发酵时间的适宜范围,再以α-葡萄糖苷酶抑制活性为指标,设计响应面试验获得米曲霉发酵铁皮石斛叶的最优条件,以期为高活性铁皮石斛叶制剂的开发提供基础。
1 材料与方法
1.1 试验材料
铁皮石斛叶,采收于浙江省乐清市绿丰铁皮石斛种植专业合作社,55 ℃干燥后压碎;米曲霉(Aspergillus oryzae)CGMCC 23295,温州大学发酵工程研究室筛选,保存于中国普通微生物菌种保藏管理中心。p-硝基苯酚葡萄糖苷(4-Nitrophenyl-α-D-glucopyranoside,pNPG)、α-Glucosidase,购自美国Sigma公司。
1.2 仪器与设备
BT124S型电子天平,北京赛多利斯仪器系统有限公司;KQ-300VDV超声波清洗器,昆山市超声仪器有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;FW80粉碎机,江阴市保利科研仪器有限公司;HH-4A数显恒温水浴锅,金坛市杰瑞尔电器有限公司;TDL-80-2B低速离心机,上海优浦科学仪器有限公司;GXZ-260A光照培养箱,宁波市科技园区新江南仪器有限公司;Telstar LyoQuest-85冷冻干燥机,泰事达科技公司。
1.3 发酵方法
1.3.1 米曲霉菌种活化和种子制备
将保藏的米曲霉菌种接种于豆芽培养基(新鲜豆芽20 g蒸煮取汁、葡萄糖2 g、蛋白胨0.2 g、磷酸二氢钾0.06 g、硫酸镁0.03 g、琼脂2 g、水100 mL),30 ℃培养3 d。活化后的菌种接种于液体豆芽培养基,30 ℃、160 r·min-1培养3 d制成种子液。
1.3.2 铁皮石斛叶的固态发酵
称取干燥铁皮石斛叶碎片20 g置于三角瓶内,加入葡萄糖0.8 g,水20 mL,配制成固态发酵培养基,灭菌冷却后按12.5%的接种量接入米曲霉种子液,搅拌均匀,置于30 ℃恒温培养箱内培养。
1.3.3 发酵条件的优化
(1)单因素试验。以铁皮石斛叶醇提物对α-葡萄糖苷酶抑制活性为考察指标,以初始含水率、发酵温度、发酵时间为单因素变量进行试验。发酵温度固定在30 ℃,发酵时间固定在4 d,设置初始含水率为40%、50%、60%、70%、80%;初始含水率固定在70%,发酵时间固定在4 d,设置发酵温度为22 ℃、26 ℃、30 ℃、34 ℃、38 ℃;初始含水率固定在70%,发酵温度固定在30 ℃,设置发酵时间为2 d、4 d、6 d、8 d、10 d。
(2)响应面优化试验。结合单因素试验结果选择初始含水率、发酵时间和发酵温度的优化范围,以铁皮石斛叶对α-葡萄糖苷酶抑制活性为响应值,优化铁皮石斛叶发酵工艺参数。根据Box-Behnken试验设计原理,采用3因素3水平的响应面分析法进行试验设计,各因素水平编码见表1。

表1 Box-Behnken 试验因素水平表
1.3.4 α-葡萄糖苷酶抑制活性测定
发酵样品取样后进行冷冻干燥、粉碎、过40目筛。称取干燥粉末0.5 g,加入80%乙醇25 mL,50 ℃超声提取2 h。离心取上清液,真空条件下旋转蒸发至干,然后加入7.5 mL二甲基亚砜(Dimethyl Sulfoxide,DMSO)溶解,用于α-葡萄糖苷酶抑制活性分析。
α-葡萄糖苷酶抑制活性的测定参照FRANCO等[16]的试验方法并稍进行修改。用磷酸缓冲液(0.1 mol·L-1,pH值为6.8)配制活性为2.419 U·mL-1的α-葡萄糖苷酶溶液和5 mmol·L-1的pNPG溶液。取PBS缓冲液3 mL、样品溶液0.2 mL、α-葡萄糖苷酶液0.1 mL加入试管中,充分混匀,37 ℃孵育10 min后,加入PNPG 0.2 mL,充分混匀,37 ℃反应30 min后,加入0.2 mol·L-1Na2CO3溶液1 mL终止反应,然后在405 nm处测定吸光度,记为A1。相同条件下,用缓冲液代替酶溶液测定吸光值,记为A2,再取0.2 mL DMSO代替铁皮石斛样品测定吸光值,记为A3。抑制率按照公式抑制率=[1-(A1-A2)/A3]×100%进行计算,以阿卡波糖(Acarbose,ACE)作为阳性对照并以阿卡波糖浓度为横坐标,α-葡萄糖苷酶抑制率为纵坐标制作标准曲线,线性回归方程为y=1 154x+1.736 8,R2=0.998 7,通过标准曲线将样品的抑制率转化成阿卡波糖当量,单位为mg ACE·g-1。
1.3.5 数据处理
单因素试验数据采用GraphPad Prism 8.0进行统计处理。结果以平均值±标准差表示,统计分析采用方差分析(One-way ANOVA)、Tukey检验,P<0.05为差异显著。Design Expert 12用于响应面试验设计和数据处理。
2 结果与分析
2.1 单因素试验结果
2.1.1 培养基初始含水率
水分对微生物的生长、生物转化和代谢产物的产生及分泌具有重大影响[17]。培养基的含水率通常在30%~85%,较低的浓度会导致微生物产生孢子,而较高的浓度会限制氧气供应并增加细菌污染的风险[18]。如图1所示,随着培养基中初始含水率的增加,米曲霉发酵铁皮石斛叶样品的α-葡萄糖苷酶抑制活性呈现出先增强后减弱的趋势,最适初始含水率为70%,在此条件下,发酵样品的α-葡萄糖苷酶抑制活性最强。

图1 初始含水率对铁皮石斛叶α-葡萄糖苷酶抑制活性的影响图
2.1.2 发酵温度
温度是真菌生长和次生代谢产物产生的至关重要因素之一[19]。米曲霉属于中温菌,在30 ℃左右的环境下生长最好,过高或过低的温度均会对其产生抑制作用[20]。由图2所示,当发酵温度处于22~26 ℃时,发酵样品对α-葡萄糖苷酶抑制活性较低。在培养过程中可以观察到,相较于更高的温度,米曲霉处于低温时菌丝生长速度较为缓慢,表明较低的发酵温度对米曲霉的生长代谢有抑制作用。当温度达到30 ℃时,铁皮石斛叶样品的α-葡萄糖苷酶抑制活性达到最大值。随着发酵温度的升高,在34 ℃和38 ℃条件下,发酵过程初期米曲霉生长速度较快,但发酵后期可能由于温度高,抑制了米曲霉生长,最终导致发酵样品对酶抑制活性减弱。

图2 发酵温度对铁皮石斛叶α-葡萄糖苷酶抑制活性的影响图
2.1.3 发酵时间
发酵时间是影响固态发酵的重要因素之一[21]。图3展示了铁皮石斛叶经米曲霉不同时间的发酵后对α-葡萄糖苷酶抑制活性的影响。随着发酵时间的延长,该指标呈现出先上升后下降的趋势,在第2天后开始急剧上升,在第4天时达到峰值,此后逐渐下降。发酵初期,铁皮石斛叶对α-葡萄糖苷酶抑制活性逐步提升,可能是由于微生物生长代谢活动旺盛,产生的一系列水解酶可以将植物细胞壁的纤维成分或者多酚、黄酮物质与其他物质之间结合的共价键破坏掉,促进这类物质的释放和转化[22],活性成分含量增加,从而提高了发酵样品对α-葡萄糖苷酶的抑制活性。发酵后期,微生物生长进入消亡期,加上底物中的营养物质被不断消耗,导致发酵样品对α-葡萄糖苷酶抑制活性下降。

图3 发酵时间对铁皮石斛叶α-葡萄糖苷酶抑制活性的影响图
2.2 响应面试验结果
2.2.1 Box-Behnken试验设计结果及方差分析
本试验在前期米曲霉发酵铁皮石斛叶单因素试验基础上,选取了各因素的优化范围,进一步确定米曲霉发酵铁皮石斛叶的最优发酵条件。试验设计及结果见表2。利用Design Expert 12软件,通过表2中葡萄糖苷酶抑制活性试验数据进行多元回归拟合,获得铁皮石斛叶酶抑制活性对编码自变量初始含水率、发酵温度和时间的二次多项回归方程为
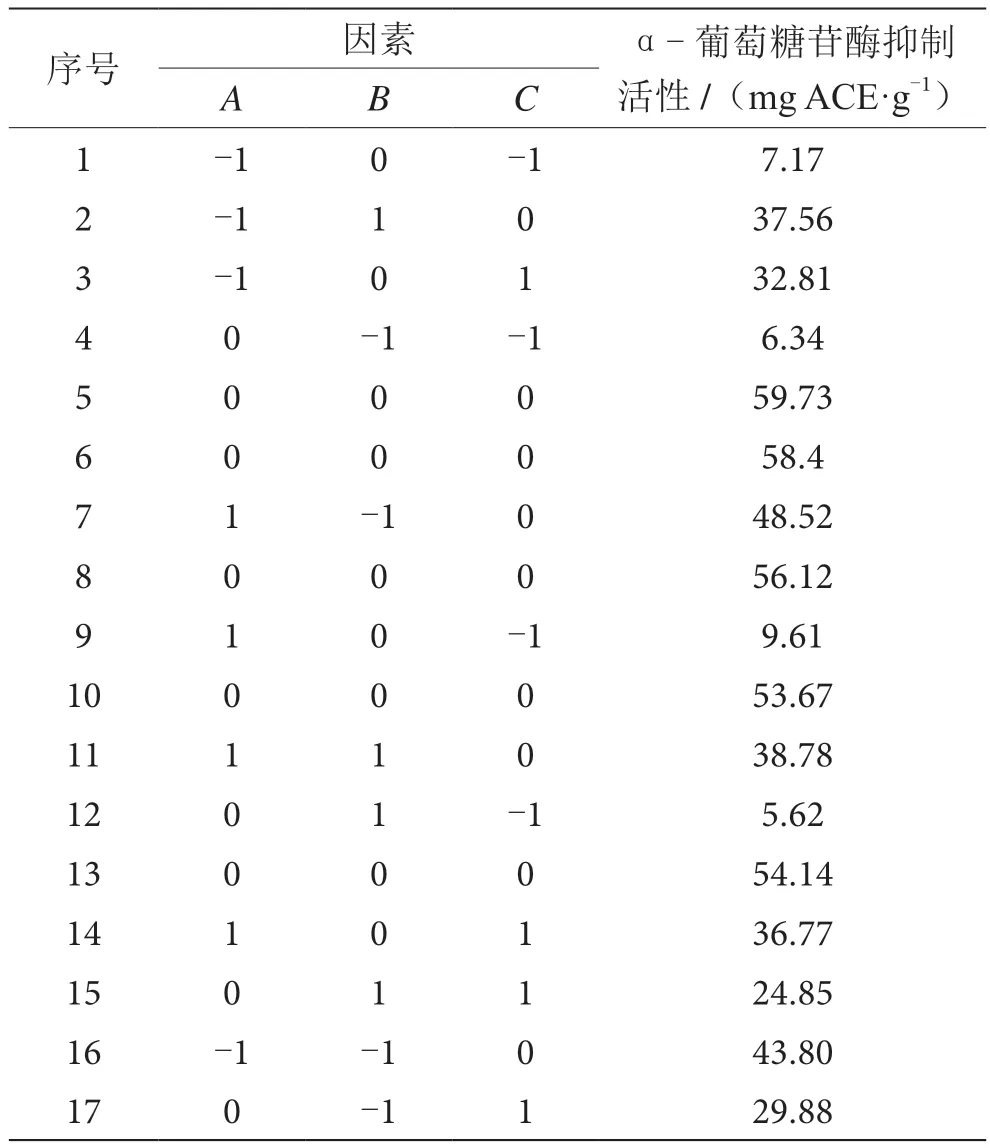
表2 Box-Behnken试验方案及结果表
从该模型的方差分析(表3)可见,本试验所选用的二次多项模型具有高度的显著性(P<0.000 1),失拟项不显著(P=0.406 9),表明模型是可靠的,未知因素对试验结果的影响较小。通过数据分析获得的模型决定系数R2为0.990 9,表明样品对α-葡萄糖苷酶抑制活性的实测值与预测值之间具有较好的拟合优度,可用于铁皮石斛叶发酵条件优化的分析和预测。校正决定系数(R2adj=0.979 1)与预测决定系数(R2Pred=0.922 2)差值<0.2,模型信噪比为25.1703>4,表明该模型具有较好的相关性,可信度高,有良好的稳定性与足够的分辨力。

表3 响应面回归模型的方差分析结果表
由表3可知,因素B(发酵温度)、因素C(发酵时间)、二次项A2、B2和C2的P<0.05,表明这些都是模型的显著项,都对米曲霉发酵铁皮石斛叶样品的α-葡萄糖苷酶抑制活性有显著影响。根据F值,3种因素对发酵铁皮石斛叶体外降血糖活性的影响大小依次为发酵时间(C)>发酵温度(B)>初始含水率(A)。综上可知,该模型可用于铁皮石斛叶发酵条件优化试验的理论预测。
2.2.2 响应面分析
基于回归模型分析,通过各因素的两两相互作用,对米曲霉发酵铁皮石斛叶降血糖能力进行3D响应面和等高线图分析,建立三维模型图,如图4、图5和图6所示。响应面开口向下凹越明显,曲面越陡,表示响应值对于因素的敏感性越高,因素间的交互作用越显著,反之则交互作用不显著;等高线图的形状差异代表各因素之间的相互作用的强度不同,等高线越接近圆形,相应的因素之间的相互作用越弱。相反,等高线图越近似椭圆形,各因素之间的相互作用越强[23]。由图4可知,等高线接近圆形,说明初始含水率与发酵温度的交互作用不显著,对铁皮石斛叶α-葡萄糖苷酶抑制活性的影响不显著。如图5所示,在初始含水率为70%~80%和发酵时间为4~6 d的条件下,米曲霉发酵铁皮石斛叶α-葡萄糖苷酶抑制活性更高。如图6所示,当初始含水率不变时,随着培养温度的升高和发酵时间的延长,发酵铁皮石斛叶体外降血糖活性先增强后减弱。通过3D响应面的曲面陡峭程度可以发现发酵时间对于发酵后铁皮石斛叶α-葡萄糖苷酶抑制活性影响最为显著。
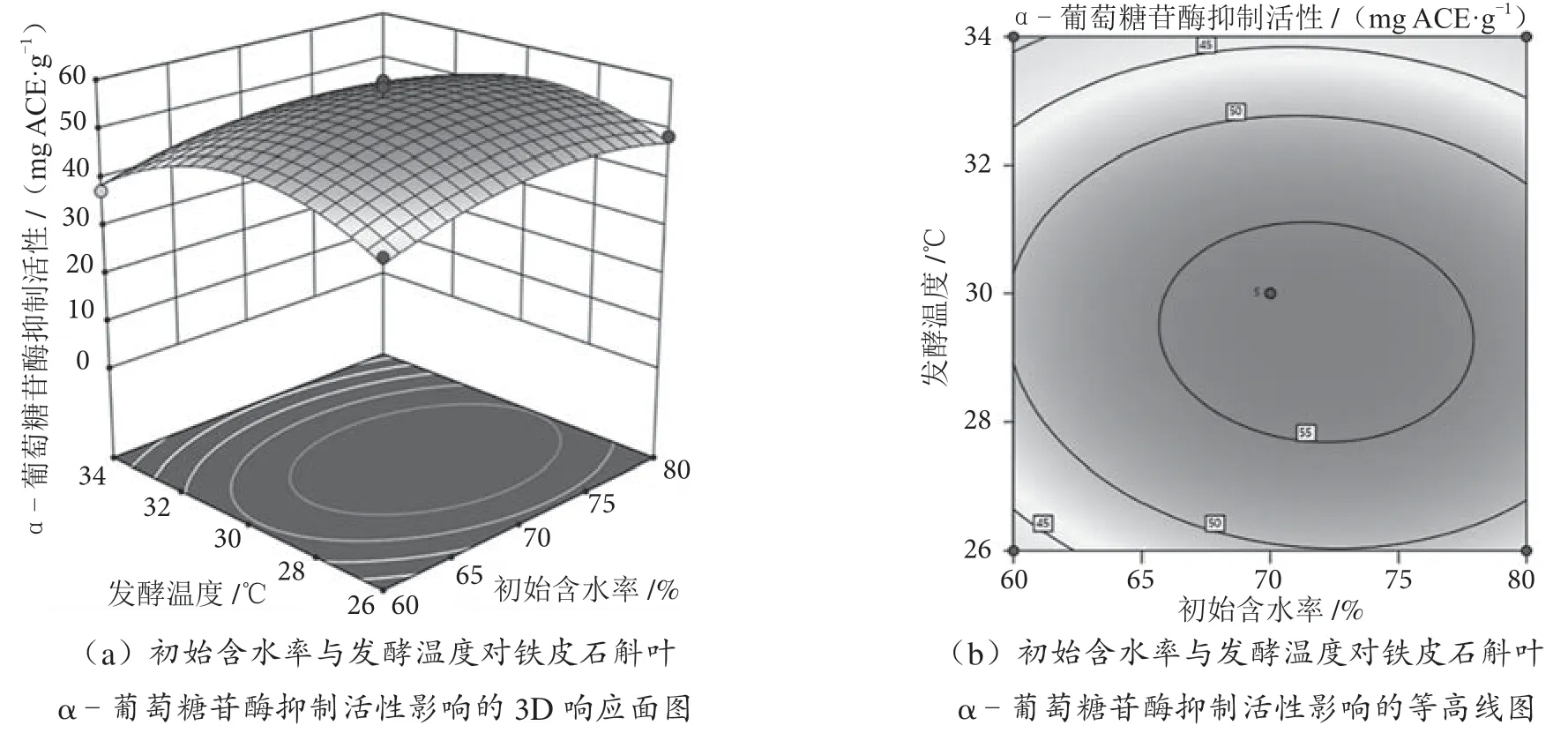
图4 初始含水率与发酵温度的交互作用对铁皮石斛叶α-葡萄糖苷酶抑制活性的影响图

图5 初始含水率与发酵时间的交互作用对铁皮石斛叶α-葡萄糖苷酶抑制活性的影响图
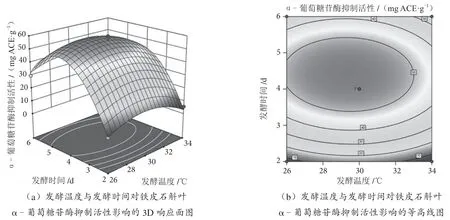
图6 发酵温度与发酵时间的交互作用对铁皮石斛叶α-葡萄糖苷酶抑制活性的影响图
2.2.3 发酵最优工艺参数预测与模型验证
应用Design-Expert 12软件对二次多项式回归方程进行分析,得到米曲霉发酵铁皮石斛叶最优工艺为初始含水率71.90%,发酵温度29.35 ℃,发酵时间4.40 d。在此条件下,预期的α-葡萄糖苷酶抑制活性为57.99 mg ACE·g-1。因考虑到实际操作情况,将其调整为初始含水率72%,发酵温度29 ℃,发酵时间4 d。按照前述调整后的条件,开展5次平行验证试验,铁皮石斛叶的α-葡萄糖苷酶抑制活性平均为(56.69±0.14)mg ACE·g-1,与理论预测值相比相对误差为2.24%,表明该最优工艺参数可靠。
3 结论
α-葡萄糖苷酶的抑制是治疗Ⅱ型糖尿病的策略之一,采用米曲霉CGMCC 23295固态发酵铁皮石斛叶,可显著提升其对α-葡萄糖苷酶的抑制活性,从而使其具有开发降血糖功能产品的潜力。米曲霉发酵铁皮石斛叶的最佳发酵工艺参数为初始含水率72%,发酵温度29 ℃,发酵时间4 d,铁皮石斛叶的α-葡萄糖苷酶抑制活性达(56.69±0.14)mg ACE·g-1,较优化前的样品提升了31.3%。
