2020年湖北省医用口罩类产品监督抽检情况分析
2023-08-07吴欢梅享林湖北省医疗器械质量监督检验研究院湖北武汉430075
吴欢 梅享林 湖北省医疗器械质量监督检验研究院 (湖北 武汉 430075)
内容提要: 目的:通过医用口罩类产品监督抽检情况,分析医用口罩类产品在生产、质量检测方面出现的问题,为提升医用口罩质量及监管服务提供技术支持和参考。方法:依据湖北省监督抽检方案,根据医用口罩类产品相应的强制性行业标准和企业制定技术要求,对湖北省内抽检口罩产品进行检测。结果:2020年4月~12月医用口罩共抽检104批次产品,占总批次的35%,共有20批次不合格,占医用口罩批次的19%,不合格项目主要集中在口罩带和细菌过滤效率上。结论:本省医用口罩类产品存在一定的问题,企业应加强对产品质量的控制以及完善质量体系的建设。
医用口罩是临床工作及日常生活中必不可少的防护用品,口罩不仅能阻挡患者喷射的飞沫,也能防止佩戴者自身飞沫的喷射。为了加强医用口罩上市后产品质量监管,国家市场监督管理总局提出要持续监管口罩等防疫物质的质量,切实保障人民群众生命健康安全,推动医用口罩行业健康有序发展。因此,2020年湖北省医疗器械监督抽检工作中强调要对医用口罩等防疫产品生产企业实现全覆盖抽检。本文将针对一次性使用医用口罩和医用外科口罩在监督抽检(2020年4月~12月)中发现的问题进行剖析,进一步规范医用口罩的生产以提高医用口罩的质量。
1.样品来源
为加强上市后医疗器械产品质量监管,根据《医疗器械监督管理条例》《医疗器械质量监督抽查检验管理规定》,由湖北省各市、州、直管市、神农架林区市场监督管理局在经营和使用环节抽样,湖北省药品监督管理局各分局在生产环节抽样,对本省医用口罩等防疫产品生产企业实现全覆盖抽检。
2.抽检方案
2.1 一次性使用医用口罩
检验依据:YY/T 0969-2013《一次性使用医用口罩》[1]注册产品标准、产品技术要求。
检验项目及试验方法见表1。
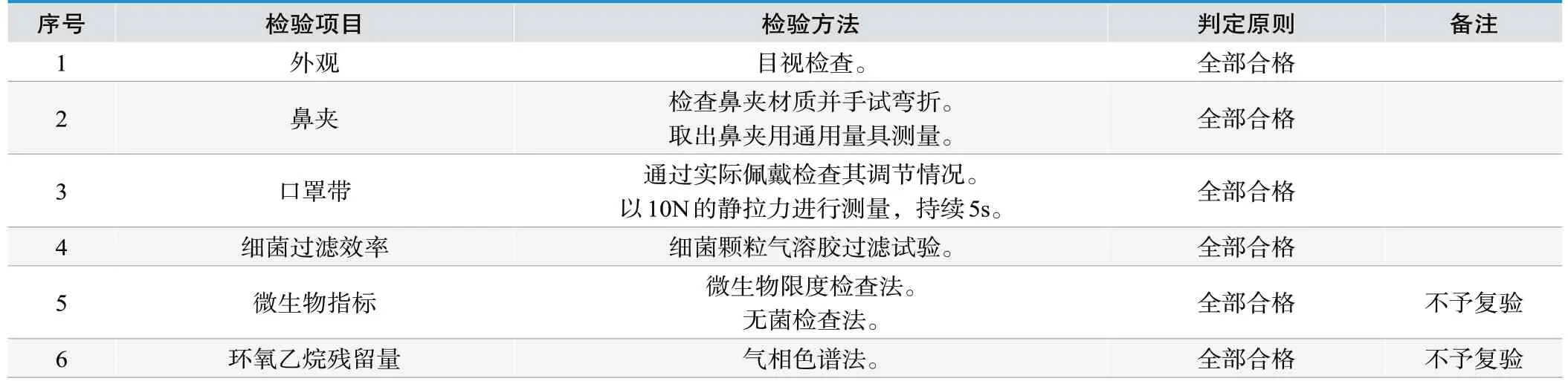
表1 .一次性使用医用口罩检验项目及试验方法
2.2 医用外科口罩
检验依据:YY 0469-2011《医用外科口罩》[2]注册产品标准、产品技术要求。
检验项目及试验方法见表2。

表2 .医用外科口罩检验项目及试验方法
2.3 判定原则
任意项判定不合格,本次抽验综合结论为不合格。微生物指标和环氧乙烷残留量项目不予复验。
3.检验结果
2020年度湖北省监督抽检产品总共有290批次有效样品,其中一次性使用医用口罩类共49批次,医用外科口罩类共47批次,医用防护口罩类共8批次。口罩类产品共计104批次,占到总批次数的35%,可以看出2020年湖北省监督抽检无源医疗器械重心在防疫产品质量监督管理上。
其中,一次性使用医用口罩49批次,占比17%,不合格12批次,具体不合格项目见表3;医用外科口罩47批次,占比16%,不合格8批次,具体不合格项目见表4。
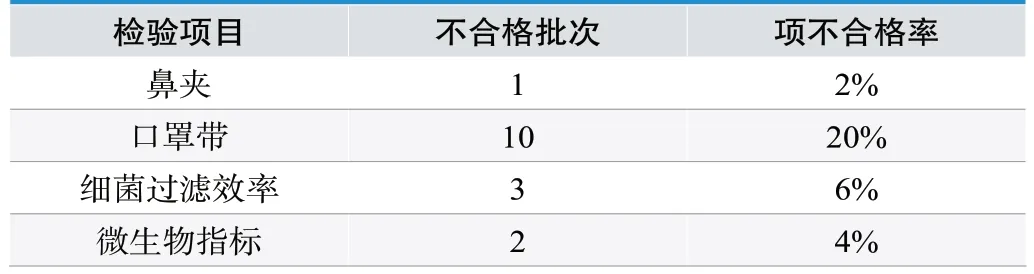
表3 .一次性使用医用口罩不合格项检测结果

表4 .医用外科口罩不合格项检测结果
从表3、表4中可以看出,医用口罩不合格项目主要是口罩带和细菌过滤效率。医疗器械产品的重要性能指标达不到标准规定的要求,将直接危害患者的生命健康,如一次性使用医用口罩细菌过滤效率不合格,可能导致在使用过程中不能有效过滤细菌病毒,使用者将面临感染的风险,口罩带断裂强力不合格,可能让使用者突然失去防护,让使用者处于危险环境中,甚至造成生命危险,产品微生物不合格,可能会让使用者存在被感染的风险。
4.讨论
4.1 生产企业管理
由于新型冠状病毒肺炎疫情的突发,口罩等防疫物资需求量激增,促使一些高新科技企业、卫生用品企业、服装纺织品企业等纷纷加入到医用口罩生产企业大军中,开始跨界生产医用口罩,导致出现了医用口罩生产企业资质良莠不齐的情况。一次性使用医用口罩和医用外科口罩作为Ⅱ类医疗器械管理的产品,须按照《医疗器械监督管理条例》《医疗器械注册管理办法》[3]的规定经药品监管部门注册,在取得医疗器械注册证和医疗器械生产许可证后才能生产和销售。
《中华人民共和国标准化法》中明确规定了强制性标准是必须执行的,国家鼓励采用推荐性标准。生产企业是否执行国家现行有效的强制性标准的要求,不是一个技术问题,而是守不守法的问题。国家规定医疗器械生产企业必须建立质量体系并有效运行,部分企业,尤其是跨界生产的企业,对医疗器械行业不熟悉,对标准化工作认识还不到位,对自己生产的产品安全性、有效性管控不清楚,往往容易降低标准要求或者部分性能指标不采用,以致在使用过程中存在较大风险。部分企业由于频繁变动技术人员,而且不少技术人员是从其他行业转行过来,且内审员不足,对国家现行有效的强制性标准并不熟悉,企业对他们的要求也主要在设计产品性能上,对于国家现行有效的强制性标准的培训力度不大,企业质量体系的运行难以坚持。
部分企业对于医用口罩的原材料采购、生产管理、质量控制、厂房设施、检验检测等环节不熟悉,并且大部分生产企业都急于快速生产,希望尽快投入到销售中[4]。比如,在原材料采购中,熔喷布是口罩中最为关键的原材料,可以说是口罩的“心脏”,熔喷布具有良好的过滤性、绝热性、吸油性和屏蔽性,若熔喷布的采购出现问题则会直接导致口罩细菌过滤效率、颗粒过滤效率、通气阻力等项目不符合要求。生产企业在原材料检验过程中应该严格把关,不能以次充好或者随意更换原材料供应商。本次抽检中发现的一次性使用医用口罩细菌过滤效率指标不合格,分析认为,应该是企业在日常生产过程中更换了主要原材料,没有对原材料质量进行有效控制。在生产工艺过程中,生产企业应该依据《医疗器械注册管理办法》和《医疗器械生产质量管理规范》[3]以及《医疗器械生产质量管理规范无菌医疗器械附录》,明确关键工序、特殊过程等,对生产工艺参数、生产设备等进行验证确认。为了减少人工及加快生产效率,大部分生产企业的口罩机为全自动一体化型,口罩带的焊接点处的牢固性就与工艺参数以及口罩带材质密切相关,焊接热合的温度、时间、功率等以及焊接接触面积等对焊接点都有影响,有些企业为了提高生产效率,在后续生产过程中改变工艺参数,导致在抽检过程中,口罩带不合格率增加,往往会出现口罩带焊接点接触面积不均匀、个别点焊漏掉、甚至脱落、点焊太过穿透、不在焊接范围内等。生产企业应按照《医疗器械生产质量管理规范》和《医疗器械生产质量管理规范无菌医疗器械附录》对发生改变的工艺参数、设备等进行重新验证和确认;由于部分企业是跨界生产,对医疗器械生产和检验环境的理解还停留在原产品上,普通级和无菌级的医用口罩的生产都需要在洁净车间内,有些企业认为洁净即干净即可,这就需要对生产环境进行加强理解;因辐照灭菌对口罩滤材过滤效率有一定影响,目前医用口罩的生产企业大多采用环氧乙烷灭菌,各厂家口罩的包装材质、包装装量、口罩材质等有所不同,灭菌工艺参数也会有所不同,因此,灭菌工艺的参数也是需要经过验证确认的,如环氧乙烷的剂量、温湿度、灭菌时间、样品装载量等都可能对灭菌效果有影响,而且厂家要在满足灭菌效果的前提下还要控制环氧乙烷残留量,保证环氧乙烷残留量性能指标满足要求。
4.2 医用口罩标准理解
在日常注册检测中,与医用口罩生产企业沟通过程中发现,一些生产企业质量检验员对医用口罩标准的理解存在一定的误区,导致整个产品在原材料检、过程检、出厂检等环节出现问题。
目前我国医用口罩执行标准为YY 0469-2011《医用外科口罩》、YY/T 0969-2013《一次性使用医用口罩》。医用外科口罩为强制性标准,产品技术要求中性能指标不能少于、低于标准中要求,一次性使用医用口罩为推荐性标准,建议企业采用标准要求中条款。从性能指标和检验方法对比,医用外科口罩性能指标除了一次性使用医用口罩中性能指标要求外,还有对医用外科口罩合成血液穿透性、颗粒过滤效率、阻燃性能有要求。对于相同的性能指标,医用外科口罩和一次性使用医用口罩检验方法基本相同。从日常注册检测和监督抽检中可以发现,医用口罩的口罩带不合格率较高,生产企业对口罩带性能指标理解也有所不同。标准中规定:每根口罩带与口罩体连接点处的断裂强力应≥10N。检验方法为:以10N的静拉力进行测量,持续5s。在检测过程中发现,口罩带有三种常见类型,第一种是耳挂式弹性口罩带,沿着使用方向焊接,口罩带在口罩体外侧;第二种是耳挂式弹性口罩带,与使用方向反向焊接,口罩带在口罩体内侧;第三种是绑带式口罩带,沿着口罩带宽度方向。3种口罩带常见类型见图1。

图1 .口罩带常见类型
生产企业在过程检和出厂检测过程中对检验方法理解一般有两种错误,一是对整根口罩带进行测试,也就是对每个连接点实际上只用了5N的力进行检测;二是对第二种口罩带进行测试时,是顺着口罩带的方向进行施力检测。这两种错误理解往往会降低对口罩带这一性能指标的要求,导致在注册或监督抽检中不合格率增加。目前执行的标准YY 0469-2011《医用外科口罩》和YY/T 0969-2013《一次性使用医用口罩》中并没有明确施力方向,但检验方法的制定应符合临床使用要求。医用外科口罩和一次性使用医用口罩标准征求意见稿中也明确了对口罩带四个连接点处均需进行测试,而且明确了口罩带的施力方向。因此,建议企业在测试过程中对每个焊接点进行单独测试,施力方向按照使用方向,沿着口罩长度方向施力。
医用口罩产品的细菌过滤效率是医用口罩的关键性指标之一,国家行业标准对细菌过滤效率有明确的规定,也是对临床使用中有重要影响的一个指标。选用一定直径的细菌气溶胶,通过气溶胶发生器以规定速度冲击口罩体,穿透过口罩的细菌气溶胶被收集到胰蛋白酶大豆琼脂上,将琼脂平板进行培养,然后对形成的菌落计数,按照标准要求计算细菌过滤效率。在测试过程中,气体流速、样品状态调节温湿度、菌液的制备、仪器设备消毒等都会对细菌过滤效率测试有影响,因此,建议企业检验员具备相应的工作经验和专业知识,严格按照标准中规定的操作进行实验,减少和避免测试结果误差[5]。
4.3 其他
医疗器械生产企业作为产品质量的第一责任人,固然应该在产品的设计、生产方面严格按国家的规定执行,注册部门在注册审评审批过程中做好审核工作。本次抽验中发现部分企业的注册产品标准或产品技术要求低于国家、行业标准的要求,或者缺少国家行业标准要求的指标。部分企业的技术要求中要求部分与检验方法不对应,或者检验项目/方法缺失或不具有可操作性。
本次抽样主要是中小企业的产品出现问题,分析原因,认为规模较小的企业抱有侥幸心理,认为自己产品销量小,出现问题的概率小,在生产过程中为提高生产效率降低成本更改工艺参数或者更换原材料等,导致产品存在一定风险。抽样还同时存在由于大企业产品销路广,容易被反复抽样,消耗了检测资源,今后应重点加大对中小企业产品的监督抽检力度。
建议审评注册人员和检验检测机构人员加强与标准归口单位和起草单位的沟通交流,省局可组织审评人员、检验检测机构检验人员、企业人员进行技术交流,在标准理解上统一尺度。同时,省局可面向企业人员进行全方位培训,包括企业研发人员、生产人员、检验人员等,从产品设计开发、原材料采购、生产管理、质量控制、厂房设施、设备、销售及售后等方面系统化地进行培训。企业内部也应该多方位培养人才,负责生产的人员要了解产品设计开发过程、了解产品标准,产品研发人员要了解整个生产过程及检验过程,避免形成产品后再整改。还要鼓励企业将产品技术要求/标准编写与修订纳入到企业质量管理体系中,加快产品的标准化进程。
