Neurospora crassa LY03菌株在客家“红菌豆渣”营养物质转化中转录组及转化产物分析
2023-08-05林标声陈冠羲张清霁陈小红
林标声,陈冠羲,张清霁,林 彬,陈小红,,黎 英,
(1.龙岩学院生命科学学院,福建 龙岩 364012;2.龙岩学院生物科技与健康产品工程技术研究中心,预防兽医学与 生物技术福建省高等学校重点实验室,福建 龙岩 364012;3.龙岩市科技局农村与社会发展科,福建 龙岩 364000)
客家“红菌豆渣”主产于福建省武平县,是以豆渣为原料,经过霉制、发酵,分解出游离氨基酸,去除了豆腥味,加工制成的一种产品表面布满橙红色菌丝、风味独特、口感鲜美,富含膳食纤维、蛋白质和氨基酸等营养成分的当地传统美食[1]。但“红菌豆渣”不易保存,只能在当地售卖,受到很多不可控的非人为因素所制约,如不能有杂菌的出现、不能密封保存等。红菌只能在自然环境下生长,一旦装入瓶中,即失去鲜活的“生命”,成为死菌就不能食用[2]。此外,到目前为止,有关“红菌豆渣”在发酵过程中营养物质转化及代谢机制的科学研究较少,成为“红菌豆渣”提高产量、质量,走向标准化、工业化生产的重要制约因素。因此,对“红菌豆渣”微生物发酵特性、主要营养成分的变化及发酵机理机制等亟待进一步深入分析。
本团队前期采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基从“红菌豆渣”中已分离得到其主要的发酵菌株LY03,通过形态学观察、18S rDNA鉴定、重测序及框架图测序,已确定其为Neurospora crassa[3]。此外,研究还发现,Neurospora crassaLY03菌株基因组中存在着丰富的纤维酶基因(cellulase),该基因的转录表达对纤维构成为主的豆渣发酵及营养成分的转化具有重要的意义[4-5]。因而,本研究在不同发酵时间“红菌豆渣”营养成分分析的基础上,进一步采用RNA-seq转录组学测序[6]、实时聚合酶链反应(real-time polymerase chain reaction,real-time PCR)技术[7]、超高效液相色谱-串联质谱(ultra-high performance liquid chromatographytandem mass spectrometry,UPLC-MS/MS)非靶标代谢组学[8]等现代生物技术寻找影响菌株发酵的主要差异表达基因、关键代谢物和代谢通路,探究cellulase基因的转录表达,对“红菌豆渣”的发酵特性进行深入分析,以获得科学、量化的数据,为提高“红菌豆渣”发酵转化效率及探究其营养成分转化的分子机理提供理论基础,使“红菌豆渣”这一具有地方特色的发酵食品得到更为广泛的发展。
1 材料与方法
1.1 材料与试剂
新鲜豆渣 市购;Neurospora crassaLY03菌株由龙岩学院生命科学学院微生物发酵科研室分离,并于中国普通微生物菌种保藏管理中心保藏(保藏号:CGMCC3.19233)。
真菌总RNA提取试剂盒 美国Omega公司;反转录试剂盒、Real time PCR试剂盒、DL2000 DNA Marker 日本TaKaRa公司;引物由北京奥维森基因科技有限公司合成;双缩脲、酪蛋白、石油醚、硼酸、苯酚、冰醋酸等均为国产分析纯;甲醇、乙腈、乙酸铵、氨水等为色谱级。
1.2 仪器与设备
LDZF-30L-I高压蒸汽灭菌锅 上海申安医疗器械厂;XMTD-8222电热恒温鼓风干燥箱 上海金宏实验设备有限公司;NanoDrop 2000分光光度计、Vanquish超高效液相色谱仪、Q Exactive HFX高分辨质谱仪 美国Therno Scientific公司;Tanon 1600凝胶成像系统 上海 天能科技有限公司;ABI7500荧光定量PCR仪 美国 Applied Biosystems公司;JXFSTPRP-24研磨仪 上海净信科技有限公司;PS-60AL超声仪 深圳市雷德邦电子有限公司。
1.3 方法
1.3.1 不同发酵时间“红菌豆渣”产品的营养成分分析
新豆渣炒熟冷却至40 ℃;装盒压紧;按0.1%量撒Neurospora crassaLY03菌种孢子粉混匀,28 ℃培养,分别收集未接种的豆渣及发酵1、2、3 d和4 d(d1、d2、d3、d4表示,下同)的培养产品样本各3 份进行营养成分的分析。其中水分含量的测定采用GB 5009.3—2016《食品中水分的测定》;纤维素含量的测定参照GB 29946—2013《食品添加剂 纤维素》;蛋白质含量测定采用GB 5009.5—2016《食品中蛋白质的测定》;总糖含量的测定参照蒽酮法;脂肪含量测定采用GB 5009.6—2016《食品中脂肪的测定》;灰分含量测定参照GB 5009.4—2016《食品中灰分的测定》;总酸含量测定参照GB 12456—2021《食品中总酸的测定》。
1.3.2 不同发酵时间“红菌豆渣”菌株总RNA样本的提取及转录组测序分析
收集发酵d1、d2、d3和d4不同时间“红菌豆渣”菌丝生长样本各3 份,混合均匀后采用真菌总RNA提取试剂盒提取各样本总RNA,通过NanoDrop和Agilent 2100检测RNA纯度(OD260/280、OD260/230)及RNA片段长度,各样本检测合格后委托北京奥维森基因科技有限公司完成文库的构建和测序工作,建好的测序文库采用Illumina HiSeq 4000高通量测序平台进行转录组测序。去除测序接头和低质量序列数据过滤原始数据后,采用star软件将测序序列和转录组序列进行比对,随后采用Cufflinks软件组装比对结果,对测序结果进行RNA-seq相关性检查。采用HTSeq软件对各样本进行基因表达水平的分析,使用每千个碱基的转录每百万映射读取的碎片(fragments per kilobase of exon model per million mapped fragments,FPKM)值为1作为判断基因是否表达的阙值,只分析FPKM>1的基因)[9],并使用DESeq进行差异表达分析,筛选条件为q值小于0.05[10]。通过GOseq软件对差异表达基因(differentially expressed genes,DEGs)进行基因功能(gene ontology,GO)富集分析[11],将测序结果与京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库比对进行通路显著性富集分析,对差异表达基因进行功能注释和分类[12]。
1.3.3 不同发酵时间“红菌豆渣”菌株cellulose基因的real-time PCR分析
将上述研究中经检测合格并定量的不同发酵时间“红菌豆渣”菌株总RNA样本各取1.0 µg用于反转录成cDNA,操作按试剂盒说明进行。反转录总体系20 µL,其中Master Mix 10 µL(包括5×gDNA Eraser Buffer 2.0 µL、gDNA Eraser 1.0 µL、Total RNA 1.0 µg,RNase-free H2O补至10 µL)、PrimeScript RT Enzyme Mix I 1.0 µL、RT Primer Mix 1.0 µL、5×PrimeScript Buffer24.0 µL、RNase-free H2O 4.0 µL。将各样本的反转录产物作为模板,设计cellulose(目的基因)及18S(内参)两对引物分别做PCR。
引物序列分别为:cellulose-F :5′-ATGAGTGAATGGTGGAAAGAAG-3′;cellulose-R:5′-TCATATACTAATGCCCATCACAG-3′;18SF:5′-GTAGTCATATGCTTGTCTC-3′;18S-R:5′-TTCCCCGTTACCCGTTG-3′。
PCR 反应总体系18 µL,其中2×Master Mix 10.0 µL、Primer F(10 µmol/L)0.5 µL、Primer R(10 µmol/L)0.5 µL,加水至总体积18 µL。将18 µL混合液加到96-PCR板对应的每个孔中,再加入对应的反转录成各样本cDNA 2.0 µL,短暂离心混合后置于冰上,real-time PCR仪上进行PCR反应,按以下程序进行:95 ℃,30 s;40 个PCR循环(95 ℃,5 s;60 ℃,40 s(收集荧光))。建立PCR产物的熔解曲线,扩增反应按如下温度、时间进行:95 ℃、10 s,60 ℃、60 s,95 ℃、15 s);并从60 ℃缓慢加热到99 ℃(仪器自动进行Ramp Rate为0.05 ℃/s)。选取cDNA样本模板进行10 倍梯度稀释,各5 个梯度,每个样本检测3 个复孔,各样本的目的基因(cellulose)和内参(18S)分别进行real-time PCR反应,反应结束后,保存扩增曲线、溶解曲线及对应循环阈值(cycle threshold,Ct)[13]。数据采用2-ΔΔCt法进行分析,计算公式为:ΔCt=Ctcellulose基因-C t18S内参基因;ΔΔ Ct=Δ Ct不同发酵时间菌株样本的cellulose基因-ΔCt发酵1d菌株样本的cellulose基因,本实验选定发酵d1作为对照;2-ΔΔCt表示目的基因的相对表达量,即不同发酵时间菌株样本的cellulose基因相对于发酵d1的cellulose基因变化的倍数。测定值Ct≥2作为高表达的标准[14]。同时将所得real-time PCR结果与转录组测序结果按相同相对表达量计算方式换算后进行对比分析,验证cellulose基因在转录组测序结果中的可靠性[15]。
1.3.4 不同发酵时间“红菌豆渣”产品的代谢物的提取及UPLC-MS/MS分析
分别收集未接种的豆渣及接种后发酵d1、d2、d3和d4不同时间的“红菌豆渣”产品样本各3 份,混合均匀后,每份产品样本取50 mg放入1.5 mL EP管中,加入1000 μL提取液(甲醇-乙腈-水,2∶2∶1,V/V,含同位素标记内标混合物)提取。提取样本经研磨仪35 Hz下研磨处理4 min,再超声处理5 min(冰水浴),重复3 次;然后样本放入-40 ℃静置1 h,再采用12000 r/min高速离心机离心15 min,将离心后上清液置于LC-MS/MS进样瓶中进行上机检测。所有样本另取等量上清液混合成质控样本上机检测。
进行UPLC-MS/MS分析,通过Waters ACQUITY UPLC BEH Amide液相色谱柱(2.1 mm×100 mm,1.7 μm)对目标化合物进行色谱分离。流动相A为水,含25 mmol/L乙酸铵和25 mmol/L氨水(pH 9.75),B相为乙腈[16]。采用梯度洗脱:0~0.5 min,5% A、95% B;0.5~7 min,5%~35% A、95%~65% B;7~8 min,35%~60% A、65%~40% B;8~9 min,60% A、40% B;9~9.1 min,60%~5% A,40%~95% B;9.1~12 min,5% A、95% B。流动相流速0.5 mL/min,柱温30 ℃,样本盘温度4 ℃,进样体积3 μL。
质谱仪在控制软件Xcalibur(Thermo)控制下进行一级、二级质谱数据采集,Xcalibur软件持续评估全扫描MS光谱。电喷雾离子源;鞘气流速30 arb,辅助气流速25 arb,毛细管温度350 ℃,全MS分辨率60000,MS/MS分辨率7500,碰撞能量归一化模式下的碰撞能量为10、30、60 eV,离子源喷射电压3.6 kV(正)或-3.2 kV(负)。
UPLC-MS/MS分析获得的原始数据经ProteoWizard软件转成mzXML格式后,使用自主编写的R程序包(内核为XCMS)进行峰识别、峰提取、峰对齐和积分等处理,然后与自建二级质谱数据库匹配进行物质注释[17]。根据所得注释结果,利用MetaboAnalyst和KEGG在线分析软件对所获得代谢产物的不同代谢途径进行分析,揭示Neurospora crassaLY03菌株在不同发酵时间“红菌豆渣”产品营养物质生成的转化机理[18]。
2 结果与分析
2.1 不同发酵时间“红菌豆渣”产品营养成分分析
如图1所示,发酵d1,菌丝缓慢生长,豆渣表面开始出现少量菌丝;发酵d2,菌丝开始大量生长,产品表面已布满橙红色菌丝,还出现了少量孢子粉;发酵d3,产生大量孢子粉;发酵d4,菌丝开始老化,颜色变深。

图1 不同发酵时间“红菌豆渣”产品Fig.1 Hongjundouzha with different fermentation times
如表1所示,未接种豆渣中主要成分为碳水化合物(纤维素、淀粉和多糖)和蛋白质,接种菌株发酵后各营养成分发生了明显的变化,其中水分含量先降低后增加,纤维素、总糖含量明显下降,蛋白质、脂肪、灰分、总酸含量明显增加,且发酵后产品各营养成分含量均与发酵前差异显著(P<0.05)。研究表明,菌丝在生长过程中,大量利用豆渣原料中的碳水化合物生成各种单糖,因而纤维、总糖含量降低;但相对而言,菌株利用蛋白能力较弱,蛋白质分解较少,蛋白相对含量增加。同时,随着发酵的进行,豆渣中的一些营养物质被分解利用生成了醇类物质、游离氨基酸、脂肪酸和有机酸等,这些醇类物质与酸性物质再通过酯化反应生成脂类物质,造成了产品中脂肪含量、有机酸含量明显增加。此外,发酵过程中菌株生长消耗原料中的有机物质,干物质含量降低,因而灰分所占比例增加。研究还发现,总体上发酵d2各项营养指标与发酵前、发酵d1差异显著(P<0.05),而与发酵后d2、d3差异不太显著,表明发酵d2可能是“红菌豆渣”营养物质转化的关键时期。

表1 不同发酵时间“红菌豆渣”产品营养成分测定Table 1 Nutritional components of Hongjundouzha with different fermentation times
2.2 Neurospora crassa LY03菌株在“红菌豆渣”不同发酵时间转录组分析
2.2.1 不同发酵时间“红菌豆渣”菌丝总RNA提取及检测
不同发酵时间“红菌豆渣”菌丝收集获得的各样本总RNA提取质量较好,其OD260/280为2.021~2.157,OD260/230为1.2~2.316,RNA为140~562 ng/µL,样本质量满足建库测序要求。RNA样本反转录成cDNA,将构建好的cDNA文库,通过Illumina HiSeqTM4000测序平台进行转录组测序。测序得到的下机数据去除带有接头(adapter)、N(不确定碱基)含量不小于10%和低质量碱基(Q≤20)含量超过50%的reads,得到分析数据。12 个样本均获得了5.0 G以上容量的原始数据,鸟嘌呤-胞嘧啶(guanine-cytosine,GC)含量占比都在54%以上,平均错误率均为0.03%,Q20与Q30分别在97%及91%以上(表2),表明转录组测序所获数据的质量较好,可用于后续分析。两样本之间的相关系数(R2)大于0.80,表明结果可靠且样本选择合理(图2)。

表2 各样本测序数据统计及质量检验结果Table 2 Sequencing data and quality test results of each sample
2.2.2 DEGs筛选
对基因表达量进行表转化处理后,根据|log2FC|大于1且q值小于0.05的原则筛选DEGs。d2 vs.d1筛选出2814 个DEGs(图3a),有1254 个基因上调表达(包括cellulose基因,ID1007),占总差异表达44.56%;1560 个基因下调表达,占总差异表达55.44%。d3 vs.d2筛选出69 个DEGs(图3b),有57 个基因上调表达,占总差异表达82.61%;12 个基因下调表达(包括cellulose基因),占总差异表达17.39%。d4 vs.d3筛选出1034 个DEGs(图3c),有649 个基因上调表达,占总差异表达62.77%;385 个基因下调表达(包括cellulose基因),占总差异表达37.23%。结果表明d2菌株大量生长、基因表达活跃,与d1差异较大;d3相对于d2差异变化不大;d4与d3差异又增加,表明d4菌株开始老化,基因表达差异明显。以FPKM>1作为判断基因表达的标准,4 个样本共获得16 个共同表达基因,d2 vs.d1特有表达基因2379 个,d3 vs.d2特有表达基因20 个,d4 vs.d3特有表达基因612 个(图3d),进一步验证了豆渣发酵菌群功能发生明显变化主要在发酵d2。

图3 4 组样本DEGs火山图和Venn图Fig.3 Volcano pot and Venn diagram of DEGs among four groups of samples
2.2.3 上调DEGs的KEEG富集
根据上调差异表达基因KEEG富集分析,分别对富集最显著的20 条KEGG代谢通路分析,富集差异表达基因富集数目最多的信号通路均为“次生代谢物的生物合成”(图4)。其中,d2 vs.d1中,“碳代谢和淀粉和蔗糖代谢”DEGs的富集最显著(P<0.05),表明d2为菌体进行糖类代谢的主要阶段(图4a)。d3 vs.d2中,主要富集到各类的氨基酸代谢,包括“组氨酸代谢”、“色氨酸代谢”、“β-丙氨酸代谢”、“酪氨酸代谢”、“精氨酸和脯氨酸代谢”、“缬氨酸、亮氨酸和异亮氨酸降解”、“甘氨酸、丝氨酸和苏氨酸代谢”和“氨基酸生物合成”,表明d3为菌体进行各类氨基酸代谢的主要阶段(图4b)。d4 vs.d3中,DEGs富集显著的代谢途径是“氧化磷酸化”、“淀粉和蔗糖代谢/过氧化物酶体”和“次生代谢物的生物合成”,表明d4菌丝体老化变色可能与其产生的氧化酶类及淀粉代谢生成的深色物质有关[19],该阶段生成了大量的次生代谢产物(图4c)。
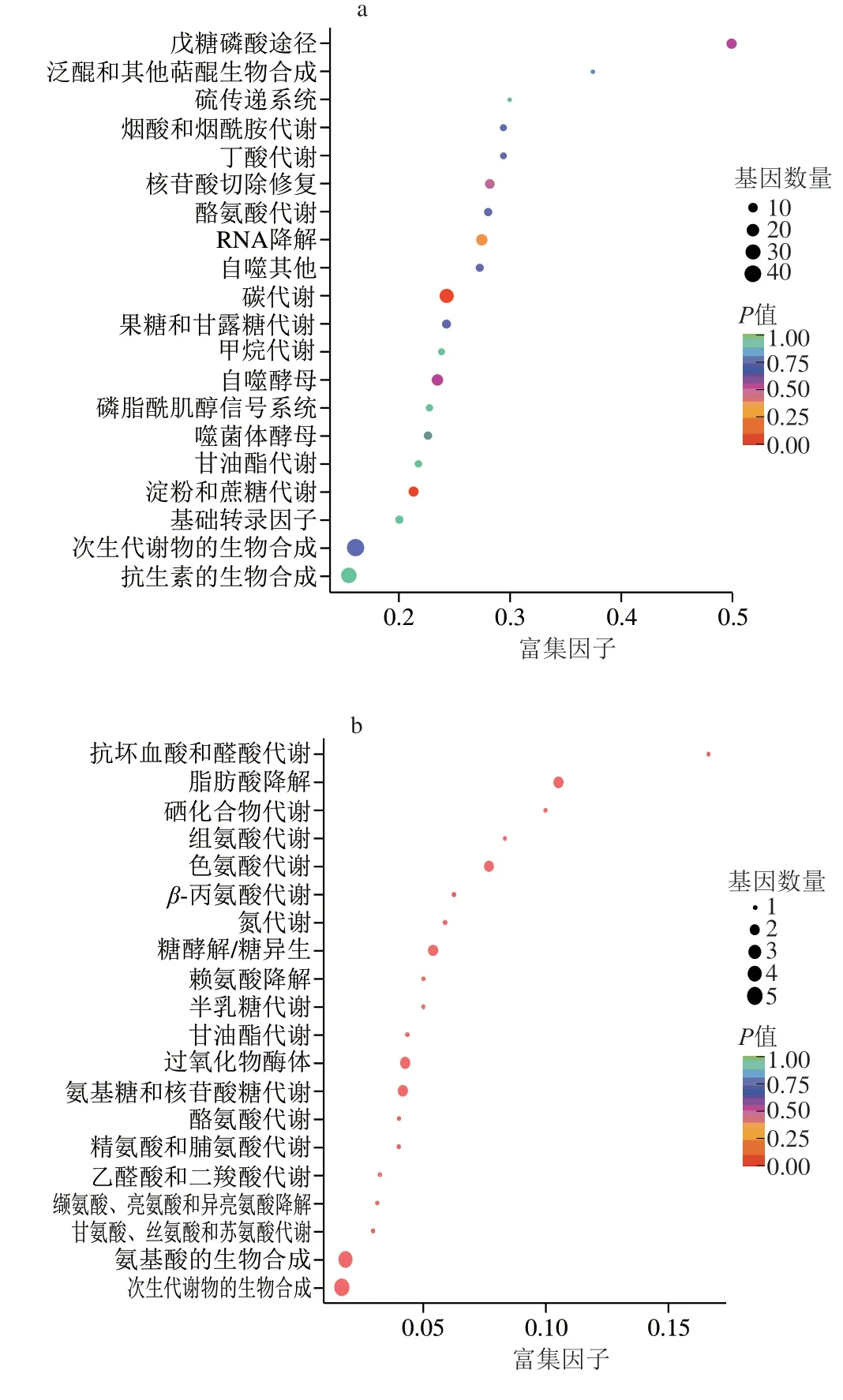
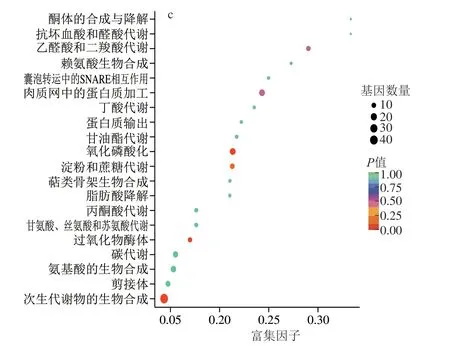
图4 上调DEGs的KEGG功能归类Fig.4 KEGG functional classification of up-regulated DEGs
2.3 Neurospora crassa LY03菌株在 “红菌豆渣”不同发酵时间cellulose基因的表达分析
1%琼脂糖凝胶电泳检验表明12 个样本总RNA提取质量较高,12 个样本cellulose基因的real-time PCR的表达水平分析表明,各样本溶解曲线均为单一尖锐峰,表明各扩增产物单一、稳定、复性较好,结果较为准确可靠。cellulose基因与18S基因的real-time PCR扩增效率测定表明,目标基因cellulose和内参基因18S扩增效率一致,实验结果可应用2-ΔΔCt法进行相对定量分析。结果表明,不同发酵时间样本的cellulose基因在转录水平上的表达2-ΔΔCt值分别为d11.00、d23.46、d32.15、d40.19(图5),cellulose基因的表达呈现出先增加后下降的趋势。其中,d2和d3cellulose基因的相对表达量均达到过表达水平(≥2),且均与d1相比差异达到显著水平(P<0.05)。此外,cellulose基因real-time PCR测定的变化趋势与转录组测序结果一致,表明转录组筛选出的DEGs具有可靠性。

图5 不同发酵时间cellulose基因的相对表达量分析Fig.5 Analysis of relative expression of cellulose at different fermentation time
2.4 Neurospora crassa LY03菌株在“红菌豆渣”不同发酵时间转化产物分析
2.4.1 “红菌豆渣”不同发酵时间产品代谢物的聚类分析
将“红菌豆渣”未接种豆渣及接种后不同发酵时间共15 个产品样本通过UPLC-MS/MS平台进行分析检测到1910 个代谢物。主成分分析(principal component analysis,PCA)和正交偏最小二乘(orthogonal partial least squares,OPLS)分析[20]结果基本一致(图6)。d2、d3和d4样本能更好地聚类在一起,与d0和d1差异较大。

图6 不同发酵时间样本的PCA(a)和OPLS分析(b)图Fig.6 PCA (a) and OPLS analysis (b) of samples at different fermentation times
2.4.2 “红菌豆渣”不同发酵时间产品代谢物的差异化合物热图分析
将不同发酵时间产品的差异代谢化合物前60 位(变量投影重要性(variable importance in projection,VIP)大于1,P<0.05)进行热图聚类分析(图7)[21],结果表明所筛选出的差异化合物主要可分为糖和糖醇、氨基酸、有机酸以及其他代谢物4 大类,其中糖和糖醇类14 个,随着发酵时间的延长,样品中相对含量最高的三乙酸纤维素和纤维二糖逐渐下降,D-阿拉伯糖、山梨醇、D-木糖和L-岩藻糖相对含量逐渐上升再下降,总体上主要糖醇类相对含量变化发生在d2。氨基酸类13 个,随着发酵时间的延长,大部分氨基酸的相对含量明显上升,其中d3为各氨基酸相对含量明显增长的时期,d4氨基酸含量开始降低。有机酸类16 个,总体上发酵前期d1~d3各类有机酸相对含量均较高,发现许多具有保健作用的有机酸如苹果酸、绿原酸、亚油酸、γ-亚麻酸、花生四烯酸、4-羟基丁酸等,但随着发酵时间的延长,d4有机酸的相对含量降低。在其他代谢物类17 个,随着发酵的进行,豆渣中原有的糖苷类化合物、黄酮类化合物如大豆苷、6-染料木苷、染料木素等分解转化成新橙皮苷、番木鳖碱、尿囊素、十四酸乙酯、溶血磷脂酰胆碱(18:4/18:1)、溶血磷脂酰胆碱(18:1)、次黄嘌呤、角鲨烯、2-羟基腺嘌呤等具有特殊生理活性的物质,总体上d4是各次生代谢物生成的主要时期。

图7 不同发酵时间差异代谢物相对含量的热图Fig.7 Heatmap of relative contents of differential metabolites at different fermentation times
2.5 Neurospora crassa LY03菌株在“红菌豆渣”不同发酵时间转录组与转化产物关联分析
通过KEGG富集分析,把转录组、转化产物分析共同富集到的通路进行整理归纳,挑选出共同富集通路的前10[22]。结果表明,发酵前期d2关键基因和代谢物主要富集在“淀粉和蔗糖代谢”、“碳代谢”和“代谢途径”(图8a),表明该阶段主要进行糖类的代谢;d3主要进行氨基酸和有机酸的代谢,关键基因和代谢物主要富集在“氨基酸生物合成”、“柠檬酸循环”和“丙酮酸代谢”(图8b);d4关键基因和代谢物主要富集在“次生代谢物的生物合成”和“氨基酸生物合成”,表明该阶段主要进行氨基酸和一些次生代谢物的合成(图8c)。

图8 基因与代谢物共同参与数最多的前10 个代谢通路Fig.8 Top 10 pathways with the largest number of genes and metabolites involved together
3 讨论
研究不同发酵时间“红菌豆渣”产品的营养成分,并对其进行转录组测序和转化产物分析,结果表明“红菌豆渣”发酵后其营养成分发生了明显的变化,豆渣原料中的碳水化合物、蛋白等成分转化成了糖类、醇类物质、脂肪酸、有机酸和游离氨基酸等,其中发酵2 d是“红菌豆渣”营养物质转化的关键时期。转录组测序及real-time PCR分析表明,d2基因表达最活跃,主要进行糖类代谢,其中DEGcellulase表达最为活跃;d3主要进行氨基酸代谢;d4主要进行次生代谢产物的生成。转化产物分析表明,d0、d1与d2、d3、d4样品差异较大,而d2、d3和d4样本可以较好地聚类在一起。总体上,d2生成糖醇类和有机酸类化合物,d3生成氨基酸和有机酸,d4生成次生代谢产物及部分氨基酸,另外还生成氧化酶类产生深色物质促使“红菌豆渣”菌丝老化。转录组与转化产物关联分析表明,转录组、转化产物分析共同富集通路主要是“淀粉和蔗糖代谢”、“碳代谢”、“氨基酸生物合成”和“丙酮酸代谢”。
“红菌豆渣”发酵的主要原料为豆渣,其主要成分为碳水化合物(纤维素、淀粉、多糖等)和蛋白质[23]。Neurospora crassa菌株是优良的纤维素酶产生菌,本研究证实,豆渣接种Neurospora crassa进行发酵,能对豆渣原料中的纤维素进行较好地分解,产物为葡萄糖,其中cellulase基因的表达起了重要的作用。real-time PCR测定表明cellulose基因的表达呈现先增加后下降的趋势,其表达量变化趋势与样品中纤维素成分的分解变化及转录组测序结果一致。豆渣中淀粉分解产物为葡萄糖,而多糖则主要为水溶性、非淀粉还原性多糖[24-25],经“淀粉和蔗糖代谢”、“碳代谢”途径代谢后分解成葡萄糖、阿拉伯糖、木糖、甘露糖、岩藻糖等单糖。豆渣中碳水化合物还有糖醇和寡糖,经代谢后分解成山梨醇、甘露醇、木糖醇、麦芽糖醇。各种糖类和糖醇类物质再进行“柠檬酸循环”、“丙酮酸代谢”、“次生代谢物的生物合成”生成多种具有保健作用的有机酸,如用于贫血症、尿毒症、高血压等多种疾病治疗的苹果酸;具有抗菌、抗病毒、抗肿瘤、降“三高”、清除自由基及增香、护色、防腐功效的绿原酸[26];大多数人需要补充的多不饱和脂肪酸亚油酸、γ-亚麻酸和γ-花生四烯酸;具有预防老年痴呆症发生、改善神经机能、抗衰老、减肥、改善脂质代谢等功效的4-羟基丁酸(又称γ-羟基丁酸)[27]。豆渣中蛋白质通过“氨基酸生物合成”途径分解生成了谷氨酸、丙氨酸、缬氨酸等各类氨基酸。此外,豆渣原料中原有的大豆苷、染料木苷、染料木素等成分通过“次生代谢物的生物合成”途径生成一些具有特殊生理功能的活性物质,如具有降血脂、降血糖作用的天然 黄酮化合物新橙皮苷[28];具有提高体内超氧化物歧化酶活性、增强机体的免疫能力、抗疲劳、抗衰老、抗肿瘤等多种生理功效的角鲨烯[29]及天然神经毒素番木鳖碱[30]等,但同时也生成了一些指示食品腐败的油脂溶血磷脂酰胆碱(18:4/18:1)和溶血磷脂酰胆碱(18:1)[31]。
4 结论
“红菌豆渣”接种Neurospora crassa菌株进行发酵,发酵2 d,菌丝生长旺盛,豆渣原料中的碳水化合物、蛋白质等营养物质转化强烈,cellulase基因的表达起了重要的作用;发酵3 d,营养物质转化基本平稳,糖醇、氨基酸、脂类等风味物质生成,产品发酵成熟;发酵4 d,菌丝开始老化,产生了一些具有特殊功能的生理活性物质,但同时产品开始出现腐败。本研究从分子水平上全面分析“红菌豆渣”营养物质转化的机制,可为提高“红菌豆渣”的发酵效率,提升产品品质,促进其产品精深加工和高值化利用提供理论基础。
