自然发酵与接种发酵“户太8号”葡萄酒品质及真菌微生物多样性分析
2023-08-05王志磊袁佳璐线芷晨袁春龙
文 栩,王志磊,袁佳璐,线芷晨,袁春龙,2,
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.西北农林科技大学 宁夏贺兰山东麓葡萄酒实验示范站,宁夏 永宁 750104)
“户太8号”葡萄属于欧美杂交种,由陕西西安葡萄研究所选育而得,是陕西主栽葡萄品种之一。近年来,陕西“户太8号”葡萄的种植面积与产量逐年增长,存在成熟期集中及季节性相对过剩等问题,影响了“户太 8号”葡萄种植的经济效益。“户太8号”作为鲜食葡萄,并不常用来酿酒,梁艳英等[1]以“户太8号”作为原料酿造冰酒,但涉及到真菌微生物多样性方面的发酵研究很少。使用“户太8号”葡萄酿酒既可以避免因滞销及雨热同季气候造成的腐烂浪费,又可以增加产品附加值,提高果农的经济效益。
葡萄酒的发酵主要有两种方式:一种是酿造过程中不人为添加商业酵母、SO2等辅料,依靠葡萄携带的本土微生物进行发酵的自然发酵;以及接种活性酵母进行发酵的控制性发酵方式。自然发酵能够产生具有地域特色的风味复杂的特色葡萄酒,展现葡萄酒的地域风格[2]。同时,自然发酵也会给酿造过程带来不可预测的风险[3],且不同的栽培管理方式也会对葡萄酒真菌菌落结构产生影响[4]。近年来,国内外对自然发酵葡萄酒的研究越来 越多[5]。且研究方向主要集中于挥发性香气物质[6-7]与真菌菌落组成的关系[8]。葡萄酒有机酸通常随着酿造过程中从葡萄转移至葡萄酒中,其种类、浓度都与葡萄酒品质有着很大关系[9]。本研究以“户太8号”葡萄为原料,使用自然发酵与接种发酵两种方式进行葡萄酒酿造,研究两种发酵方式“户太8号”葡萄酒中基本理化指标、有机酸成分、挥发性风味物质和真菌微生物多样性的变化,深入研究“户太8号”发酵过程中真菌微生物多样性变化与葡萄酒品质的相关性,旨在为“户太8号”葡萄酒发酵方式选择及风味改良提供科学依据。
1 材料与方法
1.1 材料
葡萄品种“户太8号”,采自陕西西安鄠邑区崔家湾村(东经108.6°,北纬34.1°),采收时间为2020年 10月,原料含糖量170 g/L,可滴定酸3.60 g/L(以酒石 酸计)。
1.2 仪器与设备
GC-2014C气相色谱仪 日本岛津公司;1260 infinity II高效液相色谱仪 德国安捷伦公司;IQ7000超纯水机 密理博中国有限公司;SBA-40D生物传感分析仪 山东科学院生物研究所。
1.3 方法
1.3.1 发酵方法
采用小容器酿造法进行葡萄酒的发酵。将“户太8 号” 葡萄除梗破碎,并调整葡萄醪糖质量浓度为216 g/ L,分装于5 L发酵罐中分别用于自然发酵和接种酵母。发酵罐提前进行高温高压灭菌处理,每组用3 个发酵罐进行发酵。自然发酵组(记为ZF):直接进行发酵;接种发酵组(记为SF)直投接种200 mg/L的商业酵母(酿酒酵母SY,安琪酵母股份有限公司)进行发酵。预实验表明,发酵温度为20 ℃的葡萄酒表现出良好品质,因此确定发酵温度为20 ℃。
每天测定葡萄酒基本理化指标以监测葡萄酒发酵过程。并在两种发酵方式的除梗破碎阶段、发酵初期(葡萄醪中糖含量刚开始明显降低)、发酵中期(葡萄醪中糖含量变为原来的一半)、发酵末期(葡萄醪中糖质量浓度<4 g/L)进行取样。分别记除梗破碎阶段、发酵初期、发酵中期、发酵末期为发酵0、1、2、3阶段,自然发酵葡萄酒在1、2、3阶段的取样分别记为Z1、Z2、Z3,接种酵母葡萄酒在1、2、3阶段的取样分别记为S1、S2、S3。由于在除梗破碎阶段两种发酵方式未进行差异化处理,因此统一计为Z0。
取样前先将每个发酵罐中的发酵液搅拌混匀,后从发酵罐上中下3 个不同位置取15 mL酒样装入离心管立刻用液氮冷冻,并贮存于超低温冰箱中(-80 ℃)用于有机酸含量、挥发性风味物质及真菌多样性测定。
1.3.2 发酵过程中葡萄酒样品的高通量测序
葡萄酒发酵过程中真菌微生物的高通量测序工作委托深圳华大基因股份有限公司完成。取质量合格的基因组DNA样品30 ng及对应的融合引物配制聚合酶链式反应(polymerase chain reaction,PCR)体系,设置PCR参数进行PCR扩增,使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于Elution Buffer,贴上标签,完成建库。使用Agilent 2100 Bioanalyzer对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq平台进行测序。
下机数据过滤,剩余高质量的clean data用于后期分析;通过reads之间的overlap关系将reads拼接成tags;将tags聚类成可操作分类单元(operational taxonomic units,OTU)并与数据库比对、物种注释;基于OTU和注释结果进行样品物种复杂度分析,组间物种差异分析,以及关联分析与模型预测等。
序列拼接使用软件FLASH(v1.3.11),利用重叠关系将双末端测序得到的成对reads组装成一条序列,得到高变区的tags。利用软件USEARCH(v7.0.1090)将拼接好的tags聚类为OTU。
1.3.3 葡萄酒基本理化指标测定
指标测定基于王华[10]方法,葡萄酒中还原糖含量采用菲林试剂热滴定法测定;可滴定酸采用酸碱滴定法测定;pH值使用pH计进行检测;可溶性固形物采用手持糖量计进行测定;乙醇体积分数采用SBA-40C生物传感器测定。所有指标均重复测定3 次。
1.3.4 发酵过程中葡萄酒有机酸的测定
使用高效液相色谱法。取一定量发酵液,加入离心管中,5000 r/min离心10 min,取上清液用超纯水稀释至2 倍,过0.22 μm滤膜,并收集滤液进行分析。
色谱柱:BIO-RAD Aminex HPX-87H(300 mm× 7.8 mm);色谱柱温55 ℃;流速0.5 mL/min;进样量为20 μL;紫外检测器;检测波长215 nm。流动相:5 mmol/L硫酸溶液。
1.3.5 发酵过程中葡萄酒挥发性风味物质的测定
使用顶空固相微萃取-气相色谱-质谱对发酵液的挥发性风味物质测定[11],每个样品重复测定3 次。
固相微萃取:将待测发酵液10000 r/min离心5 min,取2 mL上清液加入20 mL顶空瓶中,用超纯水将发酵液稀释4 倍,加入2 g NaCl,再加入40 μg/L 2-辛醇溶液作为内标,拧紧瓶盖,于40 ℃磁力搅拌15 min,然后插入已活化或解析过的萃取头,于40 ℃搅拌30 min,待挥发性物质在三相(顶空、萃取头和液体部分)中分布达到平衡,取下萃取头,立即送至气相色谱进样口,230 ℃热解吸5 min。
色谱条件:载气为高纯度氦气(纯度>99.999%),流速为1 mL/min;温度控制程序为:先升温至40 ℃并持续5 min,再以2 ℃/min速率升至130 ℃,随后以5 ℃/min 速率升至220 ℃并持续10 min。质谱条件:采用不分流模式进行,电子电离源;全扫描模式,扫描范围35~350 u;离子源温度为200 ℃;进样口温度为230 ℃;电子能量为70 eV;连接杆温度为220 ℃。
挥发性风味物质的定性及相对定量:通过与标准品在相同检测条件下的保留时间、质谱图特征离子对比,结合NIST 2017质谱数据库对挥发性风味物质进行定性定性,并通过内标物进行相对定量分析。
1.4 数据处理
采用Mircosoft Excel 2019软件进行数据整理;IBM SPSS Statistics 26、The Unscramber X 10.4软件进行化学计量学分析;Origin 2021软件进行作图。
2 结果与分析
2.1 两种发酵方式葡萄酒基本理化指标
如表1所示,两组均可以正常完成乙醇发酵(总 糖<4 g/L),达到干型酒的标准。然而自然发酵组发酵时间为15 d,远高于接种酵母组(发酵时间为7 d)。自然发酵组酒样可滴定酸含量高于接种酵母组,pH值低于接种酵母组。此外,接种酵母组酒样乙醇体积分数为11.17%,接近潜在酒度12%,然而自然发酵组酒样乙醇体积分数为8.33%,表明自然发酵乙醇发酵速率及乙醇转化效率均比接种发酵低。两组酒样可溶性固形物含量无显著差异。
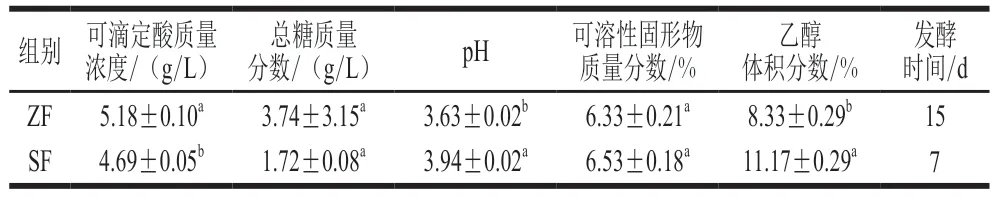
表1 两种发酵方式葡萄酒基本理化指标Table 1 Major physicochemical indexes of wine from natural and inoculated fermentation
2.2 两种发酵方式的有机酸含量
葡萄酒中的有机酸按其来源主要可分为两大类,一类是来源于葡萄浆果,如苹果酸、柠檬酸、酒石酸 等[12-13];一类来源于酵母或细菌的代谢,如琥珀酸、乳酸和乙酸等[14]。这些有机酸的含量与组成决定葡萄酒的酸度,对葡萄酒的口感也存在重要影响[15]。由图1a可知,采用两种发酵方式进行葡萄酒发酵的过程中,两组柠檬酸含量均呈现出下降趋势。接种酵母组在除梗破碎阶段及发酵初期两个阶段柠檬酸含量下降速率较快,而自然发酵组则在下个阶段内柠檬酸含量下降速度快(即发酵初期及中期)。发酵中期后两组柠檬酸含量无显著差异。由于接种发酵组中酿酒酵母是优势菌种,发酵过程旺盛,在发酵初始阶段糖可能无法满足酵母的需要,而柠檬酸作为碳源迅速被微生物代谢,致使柠檬酸含量下降[16]。
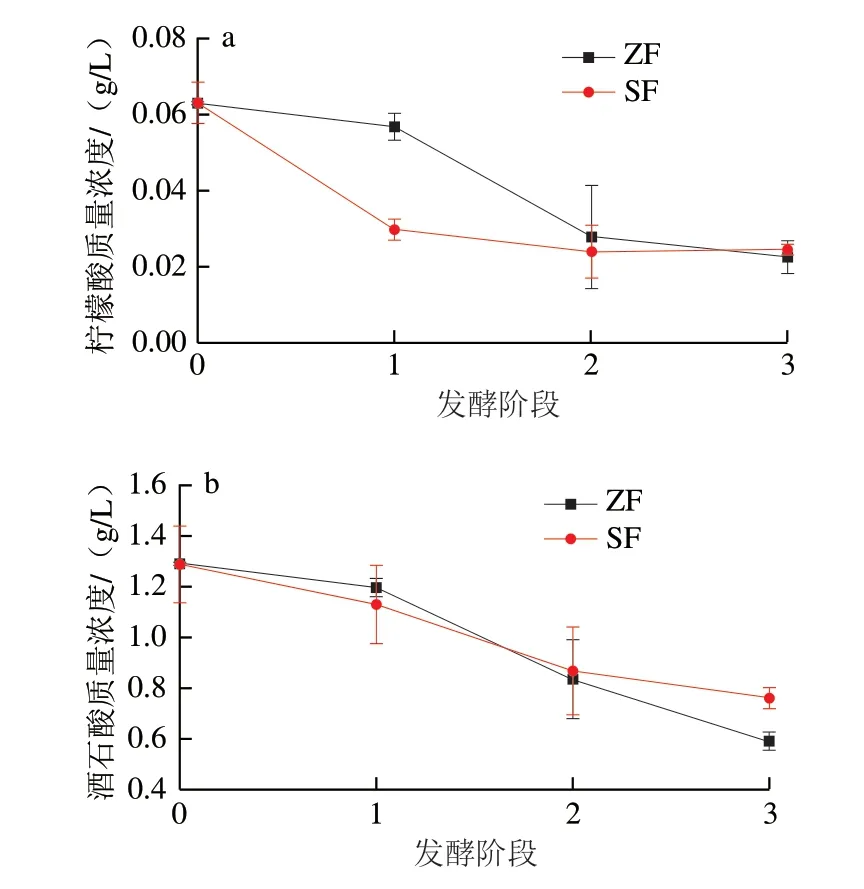
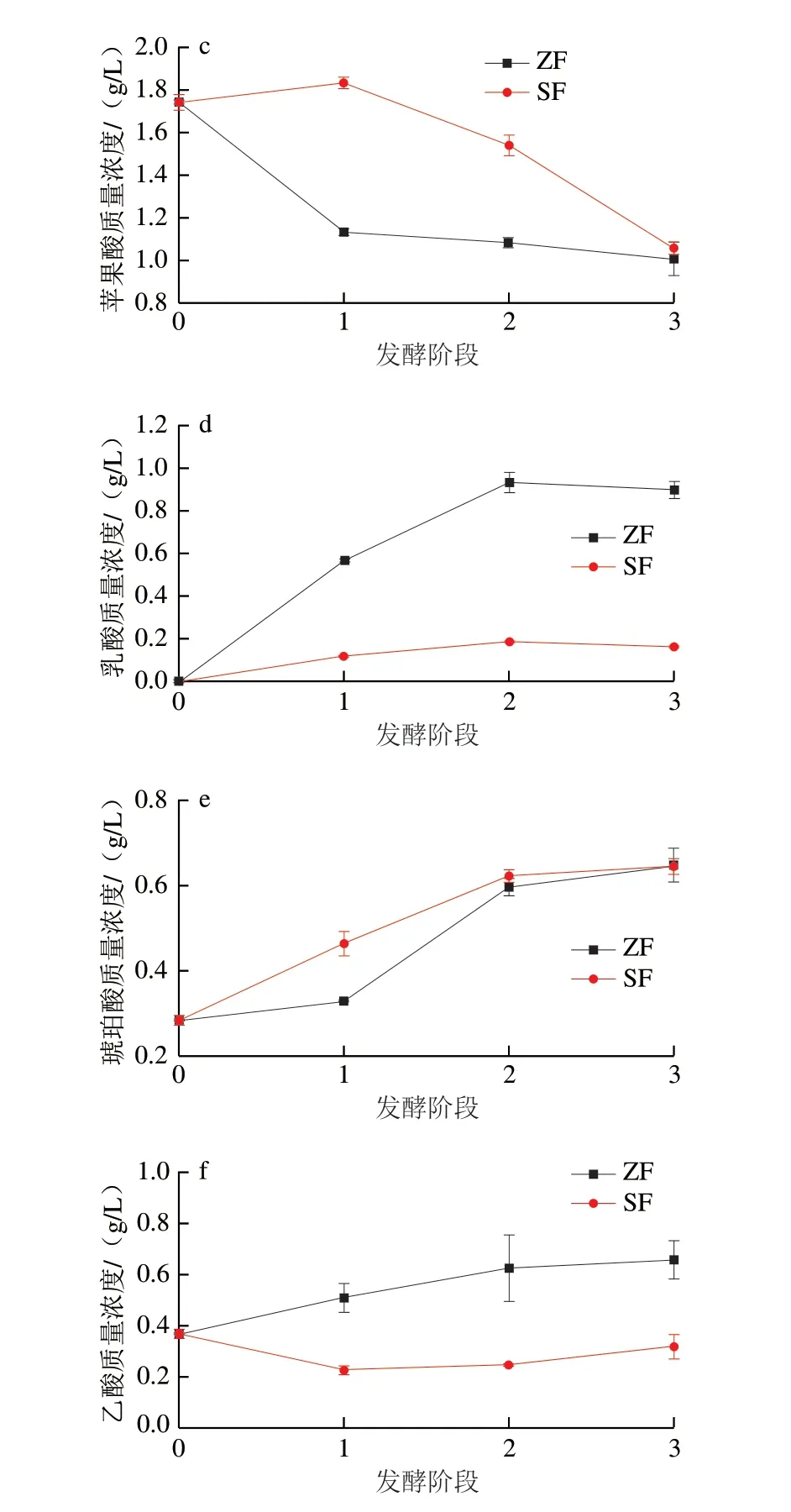
图1 两种发酵方式有机酸含量的变化Fig.1 Changes in organic acid contents in wine during natural and inoculated fermentation
酒石酸作为葡萄和葡萄酒的主要成分对葡萄酒品质可产生较大影响。一些乳酸菌也可以代谢酒石酸,生成乳酸和乙酸[17]。由图1b可知,在发酵过程中,酒石酸含量逐渐降低,且在两种发酵方式的相同阶段含量无显著差异,变化趋势相似。发酵末期接种酵母组酒石酸含量相对较高,而自然发酵组酒石酸含量较低,可能是自然发酵过程中的杂菌导致酒石酸被分解。
苹果酸是果汁最重要的组成成分之一,酸性较强,具特殊香气。但当其含量较高的时候,会给口腔带来刺激感。由图1c可知,待发酵结束时,两组苹果酸含量相近。
乳酸是葡萄酒发酵过程中产生的有机酸,口感柔和,可用于改善葡萄酒的结构感。由图1d可知,在除梗破碎阶段,葡萄醪中未检测出乳酸。其中自然发酵组在发酵初期乳酸大量生成,而接种酵母组乳酸生成量较少。接种酵母组由于添加了商业酵母,其快速生长抑制了乳酸的代谢活动菌,如酒酒球菌和乳酸杆菌[18],同时,较高水平的乳酸不会给葡萄酒产生较大问题[19]。我们发现,当发酵结束时,自然发酵组相较于接种酵母组乳酸含量增加,但苹果酸含量无明显差别,可能是因为存在苹果酸回补代谢途径,将丙酮酸或其他物质转化为苹果酸。
琥珀酸是一种口感较复杂的有机酸,其来源为酵母菌代谢以及谷氨酸转化,琥珀酸的含量对葡萄酒口感具有很大影响。由图1e可知,在葡萄酒发酵过程中,两组酒样琥珀酸的含量逐渐增加,接种发酵组琥珀酸的增加较为平稳,而自然发酵组则是在发酵初期及发酵中期琥珀酸含量有显著增幅。发酵中期及发酵末期,两种发酵方式酒样中琥珀酸含量相似。推测由于发酵初期接种酵母组的酵母菌相较于自然发酵组活跃,因此葡萄酒中琥珀酸产生量大于自然发酵组。
少量乙酸可丰富葡萄酒的口感,含量过高则会产生不愉快的气味。从图1f可以看出,发酵过程中自然发酵组乙酸含量逐渐增加,而接种酵母组酒样中乙酸含量先有少许降低,后略微增加,发酵末期乙酸含量是自然发酵组乙酸含量的48.48%。葡萄酒中理想的乙酸质量浓度约为0.1~0.3 g/L。可以看出,自然发酵葡萄酒中的乙酸质量浓度较高(0.66 mg/L),表明自然发酵在发酵过程中存在破败风险,但未超过GB/T 15037—2006《葡萄酒》的规定。
2.3 两种发酵方式挥发性风味物质的变化
如表2所示,共计检测得到52 种挥发性风味物质,主要包括酯、醇、醛、酮、脂肪酸及其他六大类化合物。其中酯类和醇类是葡萄酒中最主要的风味物质,酯类25 种,占比48.08%;醇类17 种,占比32.69%;醛类5 种,占比9.6%;酮类和酸类各2 种,占比3.84%。
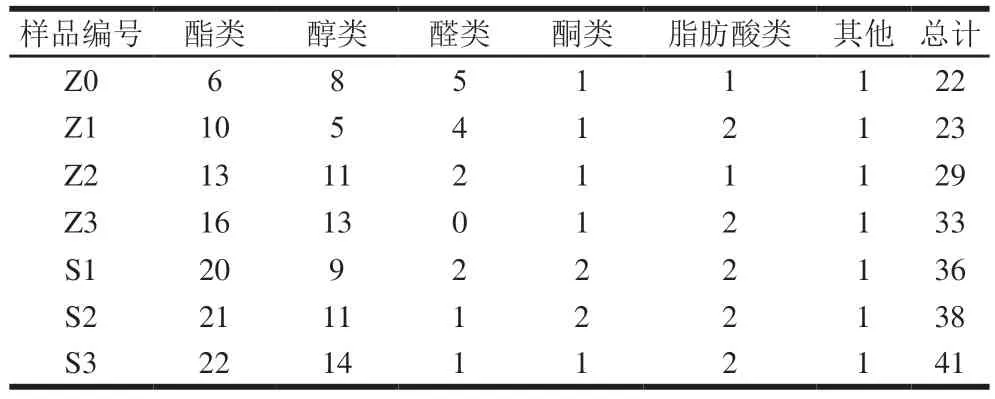
表2 7 个样品挥发性风味物质种类Table 2 Changes in types of volatile flavor substances during natural and inoculated wine fermentation
由表2可知,在除梗破碎阶段,葡萄醪中存在22 种挥发性风味物质,其中青叶醛和苯乙醛为这个阶段葡萄醪中独有,发酵开始后消失。随着发酵的进行,葡萄酒中挥发性风味物质种类逐渐增多。自然发酵组在发酵末期存在33 种挥发性风味物质,其中酯类16 种,醇类13 种。自然发酵组发酵过程中,产生的特有的挥发性风味物质有8 种,分别为异戊酸乙酯、甲酸丁酯、乙酸庚酯、2-羟基丁酸乙酯、3-羟基十八烷酸甲酯、十四酸乙酯、3-甲基-1-戊醇、十一烯醇。接种酵母组在发酵末期存在41 种挥发性风味物质,其中酯类22 种、醇类14 种。接种酵母组发酵过程中产生的特有挥发性风味物质有2 种,分别为丙酸乙酯和顺-3-壬烯-1-醇。
如图2所示,随着发酵的进行,葡萄酒中的挥发性风味物质开始积累。在发酵初期,两组酒样挥发性风味物质总量相近,其挥发性风味物质组成结构也较为相似;发酵中期和发酵末期,自然发酵组酯类的相比含量继续增加,而组酯类风味物质的相对含量逐渐降低。发酵末期,自然发酵组醇类比接种酵母组高了12.5%,主要集中在苯乙醇;而自然发酵组酯类含量是接种酵母组的10.11 倍;其乙酸乙酯含量是接种酵母组的12.27 倍;自然发酵组的脂肪酸类挥发性风味物质只有接种酵母组的10.40%。
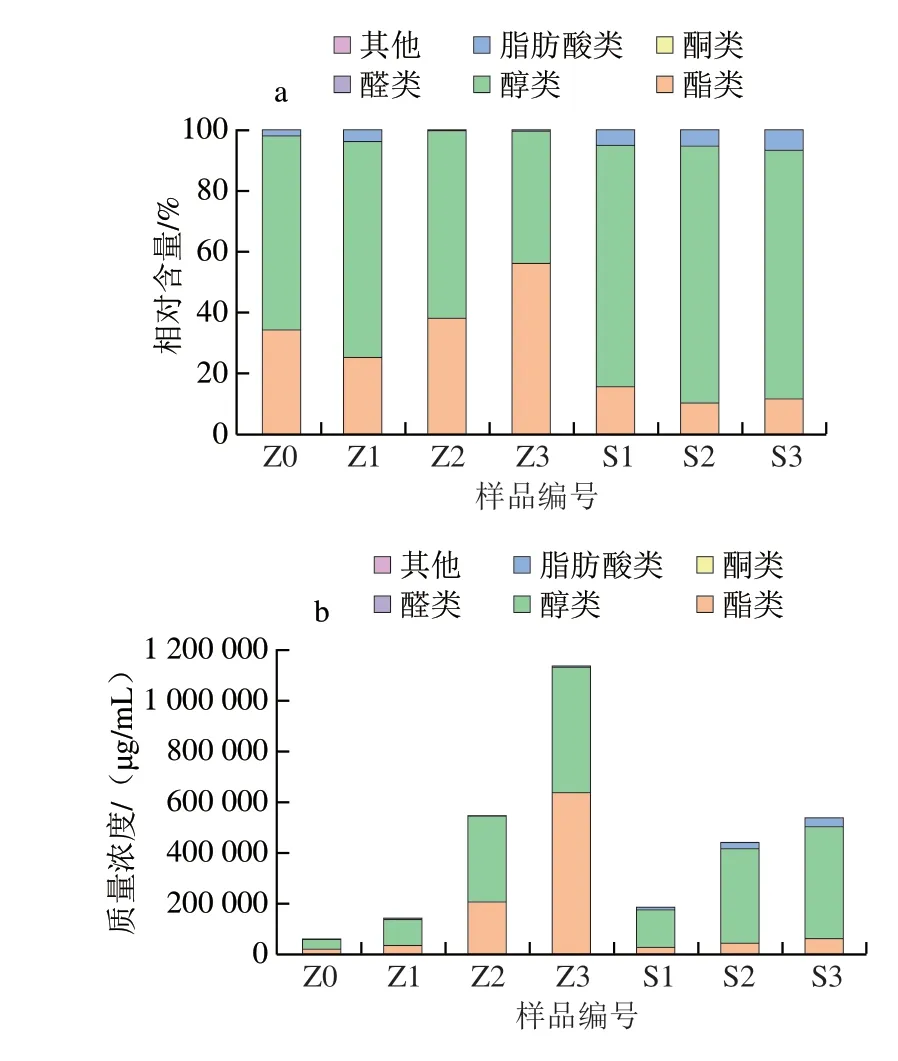
图2 不同发酵方式挥发性风味物质组成Fig.2 Changes in contents of volatile flavor compounds during natural and inoculated wine fermentation
对两种发酵方式不同发酵阶段挥发性风味物质成分进行主成分分析(principal component analysis,PCA),结果如图3所示。葡萄酒挥发性风味物质通过PCA后提取2 个PC,这2 个PC可以反映全部信息的61%。可以看出,7 个葡萄醪/酒样品主要聚为4 部分。自然发酵组(Z1、Z2、Z3)PC1正方向,接种酵母组(S1、S2、S3)位于PC1负方向,Z0位于第1坐标轴0点附近,差异明显。在PC2上,未开始发酵的Z0组位于坐标轴正方向,而已经开始发酵的S1、S2、S3、Z2、Z3组位于坐标轴负方向。Z1位于PC20点附近,可能是因为Z1组自然发酵刚开始时发酵速率较慢,这个阶段产生的新挥发性风味物质较少。图中可以很明显区分开Z0与其他组样品。此外,在图中无法区分S1、S2、S3,说明接种酵母产生的挥发性风味物质较为相似。图中也无法区分Z2和Z3,表明在自然发酵中期和末期,葡萄酒挥发性风味物质较为相似。
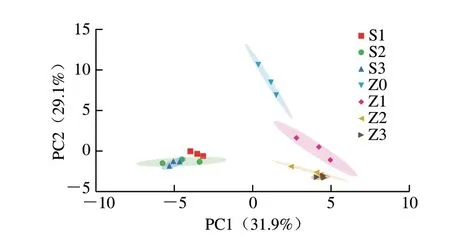
图3 葡萄酒挥发性风味物质的PCA图Fig.3 PCA plot of volatile flavor compounds in wine
2.4 两种发酵方式真菌微生物多样性的变化
2.4.1 物种丰富度与多样性分析
表3反映了两种发酵方式不同样品真菌群落多样性指数及物种丰富度。覆盖率为测序深度指数,其值越高,则样品中序列没有被检测出的概率越低。可以看出,所有样品的覆盖率均大于99.98%,表明本次样品测序深度足够,本次测序结果能够代表样品的真实情况。
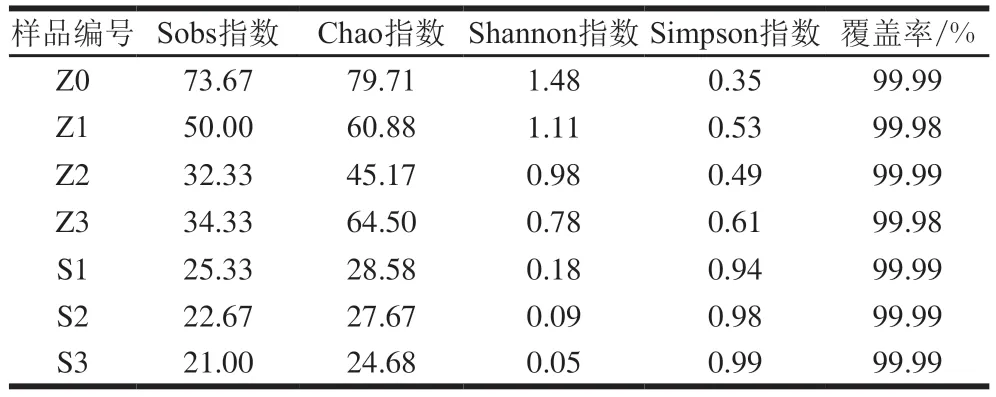
表3 不同样品真菌物种丰富度及群落多样性指数Table 3 Species richness and diversity indexes of fungal community in different wine samples
丰富度指数不考虑每个物种的相对丰度,给予相对丰度高的物种与相对丰度低的物种相同权重[20]。除梗破碎样品的Sobs指数与Chao指数均为最大,说明在除梗破碎时期,葡萄醪中物种丰富度最高。发酵起始阶段(发酵1阶段),接种酵母组的Sobs指数与Chao指数迅速降低为原来的34.38%和35.85%,说明在接种酵母后,酒样中物种丰富度迅速降低。随着发酵的进行,接种发酵组的物种丰富度逐渐降低,Sobs指数和Chao指数均有所下降。自然发酵组的发酵初期相较于除梗破碎阶段,两指数也有所降低,但降幅没有接种酵母组大,表明在不进行认为干预的情况下,葡萄醪中也会缓慢发生群落演替。随着发酵的进行,与接种发酵组相似,自然发酵组的物种丰富度也逐渐降低。但在发酵结束阶段(发酵3阶段),相较于上一阶段,自然发酵组的Sobs指数与Chao指数均有所增加,说明这个过程中有新的物种出现,这个现象在接种发酵组中未观测到。
物种多样性指数反映物种丰富度和均匀度的综合状况,常见的有Shannon、Simpson、Invsimpson指数等。Shannon指数反映物种丰富度与不同种类物种丰度的均匀性,而Simpson指数为在样本中抽取两条序列属于不同种的概率。随着发酵过程的进行,自然发酵组与接种发酵组的Shannon指数均在逐渐降低,Simpson指数均在逐渐升高,说明发酵过程中真菌多样性在逐渐降低,存在优势物种。而自然发酵组各阶段的Shannon指数均较接种发酵组高,Simpson指数均较接种发酵组低,说明自然发酵过程中的真菌多样性比接种酵母过程更为丰富。
2.4.2 葡萄酒样品物种分类注释分析
对两种发酵方式发酵过程中的样品进行高通量测序并进行物种分类注释,其结果如表4所示。两种发酵方式葡萄酒样品中共检测到2 个门,分别为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。样品中的微生物大多属于子囊菌门,少数为担子菌门。其中除梗破碎阶段的子囊菌门相对丰度最低,为95.27%,而其他几组子囊菌门的相对丰度均达到了98%。除梗破碎共检测出41 个目和59 个属,在发酵初期,自然发酵组共检测出了31 个科46 个属,接种发酵组检测出了24 个科及27 个属。在发酵末期,自然发酵组检测出了28 个科32 个属,接种发酵组检测出了17 个科18 个属。
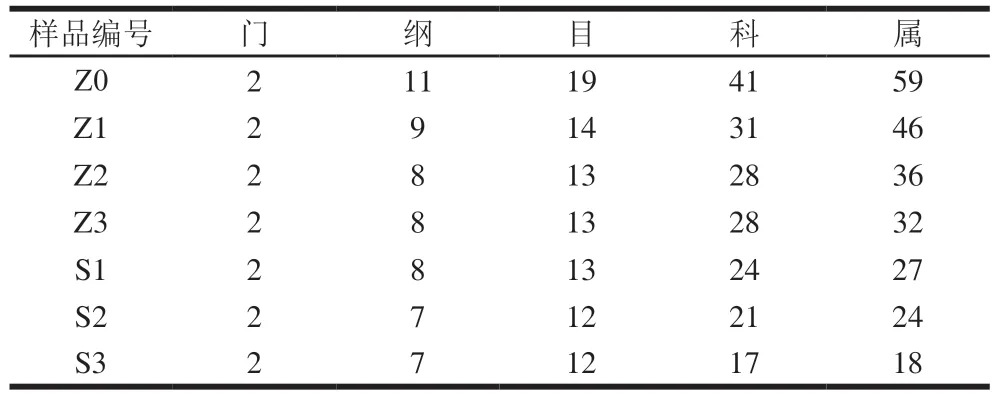
表4 两种发酵方式葡萄酒样品物种分类统计Table 4 Statistics of fungal community composition in wine samples from natural and inoculated fermentation
图4展示了两种发酵方式不同阶段在属水平物种分布情况。随着发酵进程推进,两种方式属水平数量都依次减少,其中接种发酵的属水平数量比自然发酵少。在属水平,本次测序所检出的微生物主要包括链格孢属(Alternaria)、青霉属(Penicillium)、有孢汉逊酵母属(Hanseniaspora)、枝孢属(Cladosporium)、酿酒酵母属(Saccharomyces)、枝顶孢属(Acremonium)和其他(others)。链格孢属是来自全球不同酿酒地区主要酿酒葡萄菌群的一部分[21]。作为一种病原体,它有可能在高压条件下引起葡萄果实腐烂。此外,据报道,链格孢菌菌株会在葡萄上产生AOH和AME真菌毒素[22],具有潜在的毒理学风险。青霉属一般认为是酿酒葡萄的致病因子,是葡萄园中分离出来的最常见属之一。在葡萄酒酿造过程中,可以产生青霉毒素[23]和异味,如蘑菇味和泥土味[24]。有孢汉逊酵母属是葡萄酒中常见的非酿酒酵母,通常在发酵初期占据优势,并对葡萄酒的感官具有显著影响[25]。有孢汉逊酵母属可以分泌多种水解酶,增加葡萄酒中乙酸苯乙酯含量[26],提高香气含量和复杂性,但也有可能产生过多的乙酸乙酯[27]。枝孢菌属是葡萄园中常见的病害微生物,它们以附生植物的形式存在于葡萄藤和其他寄主上,并经常出现在空气中[28],通常感染可溶性固形物含量大于15%或存在机械损伤的 葡萄[29]枝孢菌属感染会造成葡萄酒的果香(如脂类、内酯、酮和醇)损失,并对葡萄酒颜色造成负面影响[30]。酿酒酵母属是葡萄酒发酵过程中最重要的微生物,它促进乙醇发酵,将葡萄糖转化为乙醇和二氧化碳,并产生大量副产物[31]。枝顶孢属是一种常见的真菌,主要为植物寄生、腐生和自生。其次生代谢产物具有良好的生物活性,如枝顶孢素对葡萄霜霉的孢子萌发具有抑制作用[32],枝顶孢属的枝顶孢(Acremonium coenophilum)对多种体外培养的农作物病原真菌也具有抑制作用[33]。枝顶孢属真菌在工业上也常用来生产头孢菌素C[34]。
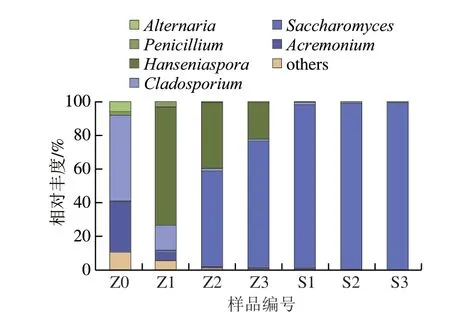
图4 属水平物种分布柱状图Fig.4 Fungal community distribution at the genus level
在除梗破碎葡萄醪中支孢属和枝顶孢属的真菌相对丰度最多,分别为占比30%和50%,酿酒酵母属仅占0.5%。发酵过程中接种发酵组由于人为添加酿酒酵母,酿酒酵母属相对丰度最大,占据绝对优势,发酵初期、中期、末期分别占比96.80%、98.75%和99.35%。而自然发酵组中,发酵初期有孢汉逊酵母属的相对丰度最大,为70.55%,其次是枝孢属,为14.72%,酿酒酵母属占比1.37%。随着发酵的进行,发酵中期自然发酵组有孢汉逊酵母属相对丰度降低,为39.20%;逐渐让位于酿酒酵母属,酿酒酵母属相对丰度增加,为57.04%。在发酵末期,酿酒酵母属相对丰度继续增加,达到75.34%,与接种发酵组不同,其有孢汉逊酵母属仍有21.91%的相对丰度。
在除梗破碎阶段,葡萄表面附着的各种微生物进入葡萄醪中,其中包括各种霉菌(如链格孢属、青霉属、枝孢菌属等)、酵母菌(如有孢汉逊酵母属、酿酒酵母属等)以及与对霉菌有抑制作用的菌类(如枝顶孢属等)。在接种酵母的过程中,葡萄所携带真菌的相对丰度迅速降低,并随着发酵过程的进行其种类和丰度继续降低,发酵醪中以酿酒酵母属为绝对的优势菌种,占据主导地位。一方面,引入商业酿酒酵母后,在适宜的环境下(葡萄醪中),酿酒酵母大量生长,挤压了原始菌群的生活资源;同时代谢产生乙醇,对其他菌群产生抑制作用,而自己对乙醇具有较高耐受性。而自然发酵葡萄酒在发酵开始阶段,有孢汉逊酵母属占据主导地位,因为其具有较高的糖耐受性;随着发酵的进行,耐乙醇能力强的酿酒酵母丰度逐渐增加,并在发酵的中后期逐渐占据主导地位。同时也发现,自然发酵过程中,没有哪类菌种具有绝对的优势地位(如接种发酵组所表现),在发酵初期,枝孢菌属的相对丰度仍有14.72%,而在发酵末期有孢汉逊酵母属也有21.91%的相对丰度。这可能是因为葡萄表皮携带的有孢汉逊酵母生存能力强,而其携带的酿酒酵母嗜杀性或产乙醇弱(自然发酵组仅能产生8.33%的乙醇,而接种发酵组可以产生11.17%的乙醇)。在接种酵母过程中,葡萄所携带的霉菌的生长早早就被抑制,在未发生大量感染的情况下各种霉菌对葡萄酒产生的负面影响较小。而自然发酵过程中各种霉菌在葡萄醪中有较长时间的出现,且不易控制,可能会对葡萄酒品质有负面影响,并有可能产生有害物质。通过有机酸测定,发现自然发酵葡萄酒样品中乙酸含量是接种酵母的2.06 倍。因此,需要进一步研究以评估自然发酵过程中原始菌群对葡萄酒品质及有害物质累积的影响。
2.4.3 “户太8号”葡萄酒样品物种β多样性分析
采取了21 个样品的OTU 数据进行主坐标分析(principal co-ordinates analysis,PCoA),以研究葡萄酒样品间真菌群落组成的物种β多样性。如图5所示,PCo1贡献率为77.94%,PCo2贡献率为23.44%,表明图有较好的解释效果。分析PCo1方向上,Z0组与其他处理组可以在PCo1区分,PCo1反映的因素应为发酵与否,能解释不同处理组微生物种群差异的77.94%;在PCo2方向,Z0组处于0点附近,S1、S2、S3组样品主要处于正坐标轴方向,Z1、Z2、Z3组样品主要处于负坐标轴方向,具有较好的区分,PCo2反映的因素应为自然发酵还是接种酵母,能够解释不同处理组微生物种群差异的23.44%。S1、S2、S3组在PCoA图中聚在一起,表明其组间微生物多样性差异不显著。随着发酵的进行,自然发酵组逐渐靠近接种酵母组,其组间微生物种群差异逐渐降低。
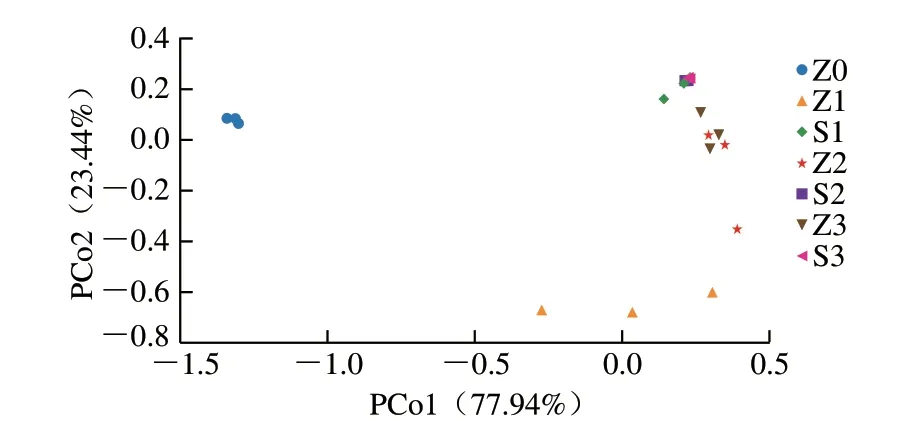
图5 不同发酵方式样品的PCoA图Fig.5 Principal coordinate analysis plot of wine samples from natural and inoculated fermentation
2.4.4 真菌微生物多样性与挥发性风味物质相关性分析
葡萄酒的挥发性风味物质与葡萄酒酿造过程中微生物的活动有很大关系。选取自然发酵组与接种发酵组发酵结束阶段真菌属微生物作为自变量X,两种发酵方式发酵结束阶段的挥发性风味物质作为因变量Y,利用The Unscramber X 10.4软件进行偏最小二乘(partial least squares,PLS)法分析,结果如图6所示。通过软件分析,选择两个PLS模型预测因子,两因子对自变量X有81%和12%的解释率,对因变量Y有62%和12%的解释率。变量点基本位于75%~95%方差置信区间内,证明两因子对X和Y均有较好的解释。酿酒酵母与其他菌种分别位于X轴两侧,表明两者呈负相关。青霉菌属(Penicillium)位于第1象限,与2-丁烯酸乙酯和乙酸苯乙酯距离较近。有孢汉逊酵母属(Hanseniaspora)、链格孢属(Alternaria)、枝顶孢属(Acremonium)、枝孢属(Cladosporium)位于第4象限,与乙酸乙酯、顺-3-壬烯-1-醇、苯甲醇、苯乙醇、正己醇距离较近,说明其相关性较强。酿酒酵母属(Saccharomyces)位于第4象限,与大多数挥发性风味物质距离较近,说明酵母菌属真菌是葡萄酒挥发性风味物质的重要来源。通过对葡萄酒进行真菌菌群结构与挥发性风味物质相关性分析,可以发现除酵母菌外大多数真菌与挥发性风味物质的醇类相关性较强,如苯乙醇、苯甲醇、正己醇以及顺-3-壬烯-1-醇。苯甲醇具有花香和柑橘香,苯乙醇具有甜香、玫瑰花香和蜂蜜香[35]。除了醇类外,乙酸乙酯也与有孢汉逊酵母属相关性强。对比两种发酵方式对葡萄酒挥发性风味物质的影响,可以发现自然发酵末期醇类挥发性风味物质比接种发酵末期要高,这说明葡萄中携带的微生物会产生更多的醇类物质。此外自然发酵产生乙酸乙酯含量是接种酵母组的12.27 倍,推测为在自然发酵阶段大量存在的有孢汉逊酵母产生了过量的乙酸乙酯,同时也消耗了葡萄酒中的酸类成分,导致自然发酵组酸类挥发性成分的量要远远少于接种发酵组[36-37]。
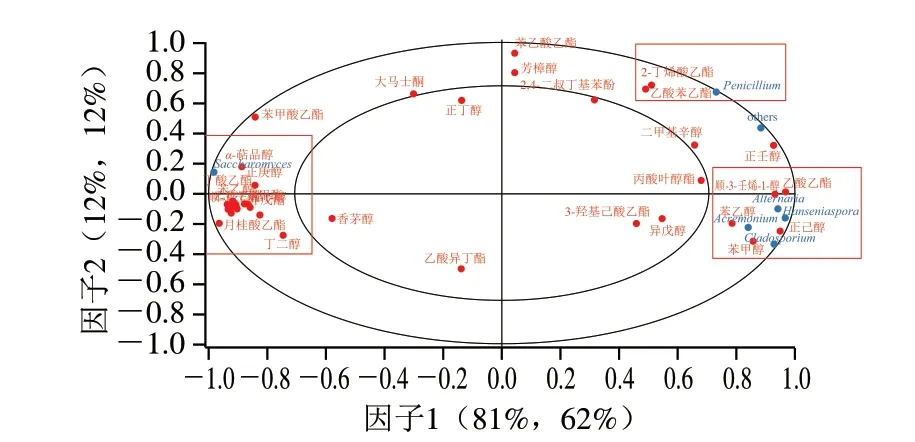
图6 发酵结束阶段PLS结果Fig.6 PLS analysis of wine samples at the end of fermentation
3 结论
无论是自然发酵与接种酵母,两种发酵方式均可完成“户太8号”葡萄酒乙醇发酵过程。然而自然发酵发酵周期长,乙醇发酵速率及乙醇转化效率较低。酒石酸含量较低,乳酸与乙酸含量较高,自然发酵过程可能存在破败风险,因此,在生产过程中自然发酵不易控制,具有风险。随着发酵的进行,葡萄酒中挥发性风味物质的种类与总量逐渐增加,两种发酵葡萄酒挥发性风味物质差异显著。自然发酵的醇类与酯类挥发性风味物质含量均多于接种发酵。
“户太8号”葡萄酒自然发酵过程中,初期有孢汉逊酵母属与枝顶孢属占优势;中期酿酒酵母属和有孢汉逊酵母属占优势;末期时酿酒酵母属与有孢汉逊酵母属占优势。在接种发酵过程中,酿酒酵母属始终占据绝对优势。通过PLS模型分析发现真菌微生物与挥发性风味物质的相关性明显。部分醇类物质,如苯乙醇、苯甲醇、正己醇、顺-3-壬烯-1-醇以及乙酸乙酯与有孢汉逊酵母属、链格孢属、枝顶孢属、枝孢属具有相关性。
两种发酵方式相比较而言,自然发酵挥发性物质含量虽然较多,但种类较接种发酵较少,并且会产生大量的乙酸乙酯,会对香气产生负面影响,因此在工业上大量使用自然发酵方式酿造“户太8号”酒需要谨慎处理。相比之下接种酵母发酵方式周期较短,效率较高,相对稳定,挥发性物质种类较多。因此,在生产实践推荐采用接种发酵方式生产“户太8号”葡萄酒。
