基于对硝基苯酚荧光内滤效应的脂肪酶活性测定
2023-08-05辛嘉英李慧敏王贵儒王雨晴
徐 阳,辛嘉英,2,*,李慧敏,王贵儒,王雨晴
(1.哈尔滨商业大学 食品科学与工程重点实验室,黑龙江 哈尔滨 150076;2.中国科学院兰州化学物理研究所,羰基合成与选择氧化国家重点实验室,甘肃 兰州 730000)
脂肪酶的定义是催化甘油三酯水解成脂肪酸和甘油、单甘油酯或甘油二酯的酶,也叫做三酰甘油酯水解酶,可进行酯交换、酯化等,其广泛存在于动物、植物等生物体内[1-2]。随着天然酶制剂应用越来越广泛,脂肪酶在食品工业中也占据了重要地位[3]。尤其脂肪酶活性对食品品质有很大影响,其酶活性测定也成为食品检测中十分重要的环节[4]。传统测定脂肪酶活性的方法包括平板法、滴定法、比色法、荧光法[5-8]等,其中平板法、滴定法是操作相对简便的两种方法,但由于其灵敏度较差,测定结果不准确,因此只能用来粗略判断脂肪酶活性大小;比色法虽然反应灵敏度高但操作流程复杂,易受反应介质、底物和环境因素如温度、pH值的影响,具有反应不稳定等缺点[9-10],因此,开发新方法测定脂肪酶活性将成为未来研究的重点。
基于纳米金以及金纳米簇的光学性质测定脂肪酶活性具有简便快速、灵敏度高、特异性强、操作简便等优点,是一种良好的测定脂肪酶方法[11-12]。孙旭东[13]为检测脂肪酶活性,研究了一种荧光探针。利用合成的氮金掺杂荧光纳米点,使其表面氨基与铜离子配位结合,使荧光淬灭。巯基乙酸甲酯在脂肪酶作用下发生水解反应,其水解产物巯基乙酸和铜离子的结合作用大于纳米点与铜离子的结合作用,最终导致铜离子脱离荧光纳米点,使得荧光强度恢复。通过建立标准曲线,从而得出脂肪酶活性大小。田丹碧等[14]研究了一种纳米金团簇荧光增强法检测脂肪酶活性。其原理是利用脂肪酶水解巯基乙酸甲酯产生巯基乙酸,巯基乙酸能与纳米金团簇稳定结合,使得纳米金团簇荧光发射强度增加。但利用纳米金法测定脂肪酶活性时,脂肪酶中蛋白含量会对实验结果造成一定影响,对脂肪酶特殊作用界面的理论研究也并不充分[15-16]。因此,应不断深入开发纳米金的制备及检测新技术,成功实现对脂肪酶活性灵敏性的测定。
随着学者们对荧光法认识的进一步加深,荧光内滤法已经发展成了一种新型荧光分析方法[17],早在1991年就被Gabor等[18]报道。荧光内滤效应指在反应体系中荧光剂的激发或发射光被吸收剂所吸收,进而导致荧光剂的荧光强度降低[19-20]。由于吸收剂对荧光基团的吸收程度可转变为荧光强度的变化,其检测灵敏度在一定程度上也大大提高,检出限也显著降低[21]。目前,基于荧光内滤效应的检测已广泛应用于食品、药品、环境等领域[22-24]。本研究提出一种基于荧光内滤机理测定脂肪酶活性的传感系统。金纳米簇具有良好荧光性能可以成为理想的荧光剂,利用谷胱甘肽制备金纳米簇,其激发波长为420 nm。对硝基苯酚(p-nitrophenol,p-NP)在405 nm波长处有紫外吸收峰,二者之间吸收与激发图谱重叠,荧光剂的荧光被猝灭,可利用荧光内滤效应达到对脂肪酶活性检测的目的。金纳米簇可作为反应体系的荧光团,棕榈酸对硝基苯酯(p-nitrophenyl palmitate,p-NPP)在脂肪酶的作用下可水解转化为p-NP,作为荧光内滤的吸收剂可影响金纳米簇的激发导致荧光强度降低,检测机理如图1所示。该方法具有操作简便、灵敏度高以及样品消耗少等优点,在脂肪酶活性检测方面具有良好的应用前景,在食品工业领域具有重要意义。
1 材料与方法
1.1 材料与试剂
氯金酸(分析纯)天津佳烨贵研科技有限公司;谷胱甘肽(98%)、p-NPP(分析纯)上海阿拉丁生化科技股份有限公司;Tris-HCl、牛血清白蛋白(均为分析纯)北京索莱宝科技有限公司;三羟甲基氨基甲烷、无水乙醇、阿拉伯胶、氢氧化钠(均为分析纯)天津市天力化学试剂有限公司;TritonX-100、异丙醇、磷酸(均为分析纯)天津光复化工开发中心;考马斯亮蓝G-250(分析纯)上海跃腾生物技术有限公司;硝酸、盐酸(均为分析纯)国药集团化学试剂有限公司;脂肪酶Nvozyme435(分析纯)诺维信(中国)投资有限公司;猪胰脂肪酶(30 U/mg)(分析纯)上海金穗生物科技有限公司;假丝酵母脂肪酶(700 U/mg)(分析纯)上海源叶生物科技有限公司;皱褶假丝酵母脂肪酶(700 U/mg)(分析纯)美国Sigma公司。
1.2 仪器与设备
KQ-50B超声波清洗器 昆山市超声仪器有限 公司;HWS24电热恒温水浴锅、DHG-9053A电热鼓风干燥箱 上海一恒科技有限公司;BSA224S电子天平、PB-10酸度计 赛多利斯科学仪器有限公司;DF-101S集热式恒温加热磁力搅拌器 上海力辰邦西仪器科技有限公司;UV2550紫外-可见光谱仪 岛津消耗品销售 公司;F-7000FL荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 金纳米簇合成
根据文献报道的方法[25]合成了谷胱甘肽修饰的金纳米簇。将10 mL 4 mmol/L氯金酸溶液添加到10 mL 6 mmol/L谷胱甘肽溶液中。将混合物溶液混合,置于油浴锅中,设置温度为90 ℃,搅拌时间6 h。再使用10 kDa MWCO膜过滤器纯化。将得到的滤液收集,置于冰箱,4 ℃保存备用。
1.3.2 脂肪酶底物溶液的制备[26]
溶液A:p-NPP 3 mg,溶于10 mL异丙醇中。溶液B:称量TritonX-100溶液2 g,阿拉伯胶0.5 g,将两者溶于450 mL的Tris-HCl缓冲液(50 mmol/L,pH 7.5)中,获得混合物溶液B。将溶液A与溶液B按1∶9比例混合配制为乳状液,稳定2 h左右,即可获得脂肪酶的底物溶液C。
1.3.3 脂肪酶活性的检测
将50 µL不同活性脂肪酶添加到含450 µL脂肪酶的底物溶液C中,并加入1.5 mL Tris-HCl缓冲溶液(50 mmol/L,pH 7.5)调节pH值。然后在50 ℃水浴中加热18 min,再加入400 μL谷胱甘肽-金纳米簇溶液到反应物中,于激发波长420 nm处得到金纳米簇的荧光图谱。
1.3.4 考马斯亮蓝法测定脂肪酶中蛋白含量[27]
染色液配制:将考马斯亮蓝G-250100 mg添加到100 mL 95%乙醇溶液中,再加100 mL 85% H3PO4溶液,加蒸馏水稀释至1 L。牛血清白蛋白(bovine serum albumin,BSA)标准液:0.1 mg/mL。标准曲线:在6 支试管中分别加不同体积的BSA溶液,另取一支试管加1 mg/mL脂肪酶溶液1 mL,将7 支试管分别加水定容至1 mL。每管加入5 mL染液,摇匀,放置5 min,测OD595nm值,通过标准曲线测定脂肪酶的蛋白含量。
1.3.5 比色法测脂肪酶活性
p-NP标准曲线:配制浓度在2.5~32.5 μmol/L的p-NP溶液,在波长405 nm波长处比色,以p-NP浓度为横坐标,吸光度为纵坐标绘制标准曲线,得到标准曲线方程。进而计算求得脂肪酶活性,具体方法可参见p-NP 法[28-29],计算公式如下:
式中:X为脂肪酶活性/(U/mL);C为p-NP浓 度/(μmol/mL);V为最终体积/mL;V′为脂肪酶的添加量/mL;t为反应时间/min。
2 结果与分析
2.1 谷胱甘肽-金纳米簇合成
合成谷胱甘肽修饰的金纳米簇电镜如图2A所示,其粒径约为2 nm。如图2B所示,形成的金纳米簇在420 nm激发波长下,580 nm处出现荧光发射峰,在紫外光照射下显示红色荧光。

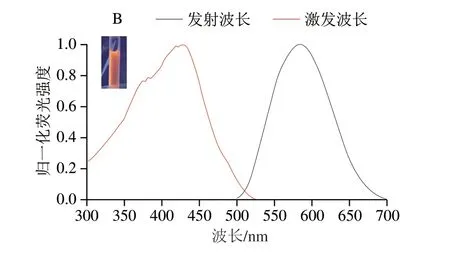
图2 金纳米簇的透射电镜图(A)和荧光光谱图(B)Fig.2 TEM image (A) and fluorescence spectrum (B) of gold nanoclusters
2.2 金纳米簇的稳定性
探究光稳定性、温度和pH值对金纳米簇的影响。由图3A可知,金纳米簇在420 nm处照射60 min,其归一化荧光强度几乎没有变化,表明金纳米簇具有良好的光稳定性。图3B表明,反应温度范围在30~50 ℃之间时,对金纳米簇的归一化荧光强度几乎没有影响。如图3C所示,pH值对金纳米簇有一定的影响,荧光强度随着pH值升高而增加,因此要严格控制金纳米簇起始溶液的pH值,这种现象的发生可能是由金纳米簇表面官能团的质子化-去质子化所引起[30-31]。

图3 抗光漂白性(A)、温度(B)和pH值(C)对金纳米簇的影响Fig.3 Photobleaching resistance of gold nanoclusters (A) and effect of temperature (B) and pH (C) on gold nanoclusters
2.3 基于荧光内滤的荧光传感机理
如图4A所示,在脂肪酶存在条件下,p-NPP被水解成p-NP造成吸收峰红移,从275 nm处红移到405 nm处。金纳米簇的激发波长在420 nm处,发射波长在580 nm处,则p-NP的紫外吸收光谱和金纳米簇的激发光谱存在一定的重叠现象,使金纳米簇的荧光减弱。
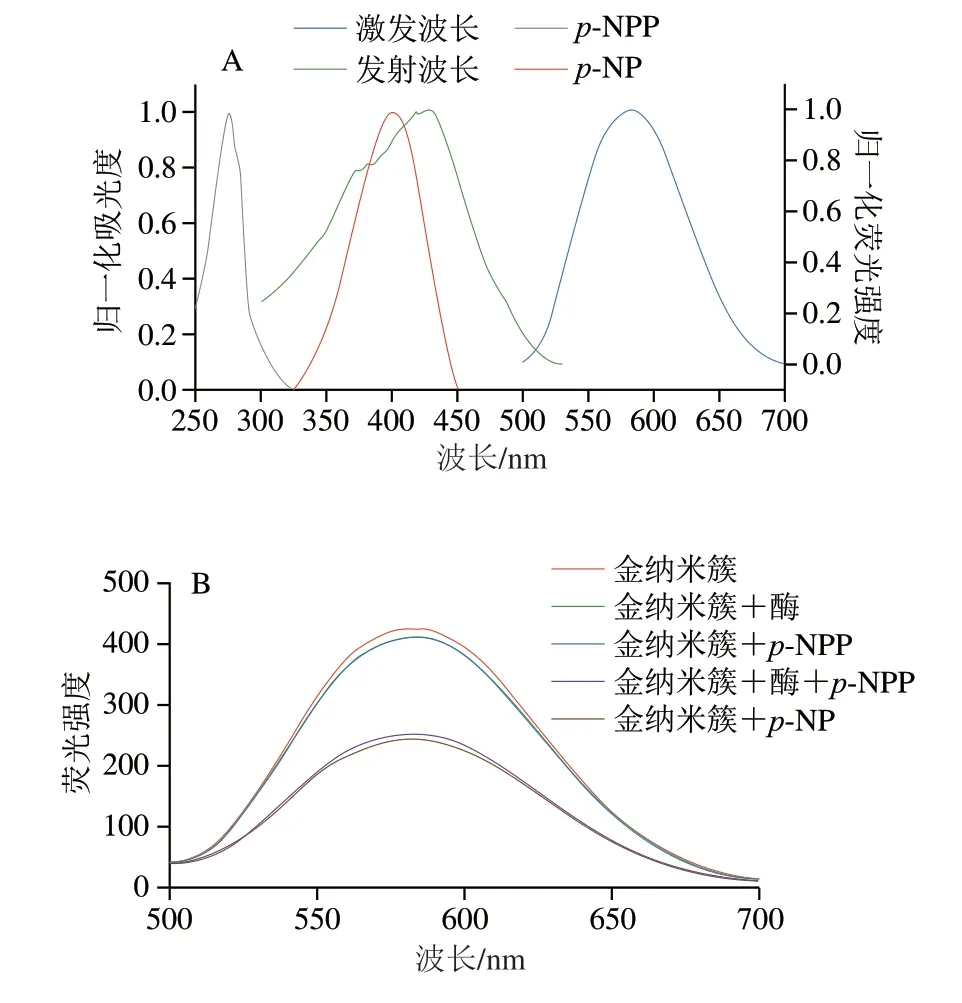
图4 荧光法测脂肪酶活性的反应机理图Fig.4 Fluorescence spectra and effect of the inner filter effect on fluorescence intensity
为证明金纳米簇荧光降低仅仅是由于脂肪酶水解产生的p-NP与金纳米簇的荧光内滤引起,进行如下实验,当金纳米簇中加入酶或p-NPP时,对金纳米簇荧光强度基本上没有影响,当加入p-NPP和脂肪酶时,其荧光强度减弱,证明了脂肪酶水解p-NPP产生的p-NP与金纳米簇的荧光内滤效应减弱金纳米簇荧光强度,其他物质对金纳米簇的荧光没有影响,当在金纳米簇中直接加入p-NP时,其荧光强度减弱,直接证明了该方法的有效性,见图4B。
基于p-NP紫外吸收和金纳米簇激发光谱之间的强烈重叠,使荧光强度发生降低,而p-NP的紫外光谱又会受到脂肪酶活性影响。当脂肪酶活性较大时,对p-NPP的水解程度高,产生的p-NP浓度大,则p-NP紫外光谱图与金纳米簇的激发光谱重叠大,导致荧光显著降低;反之脂肪酶活性小,对荧光强度的影响不大,荧光强度相对较高。对不同活力的皱褶假丝酵母脂肪酶水解产生的p-NP做了紫外光谱检测,如图5所示,其吸光度随着脂肪酶活性的增大而增加。

图5 不同活性褶皱假丝酵母脂肪酶的紫外-可见光谱图Fig.5 UV-visible spectra of Candida rugosa lipase with different activities
2.4 反应条件的优化
通过实验优化pH值、p-NPP质量浓度、脂肪酶水解时间和温度对金纳米簇荧光强度的影响。以相对荧光强度(荧光强度差值F0-F)作为脂肪酶活性大小当量,即脂肪酶活性越大时,水解产生的p-NP浓度越大,荧光内滤效应越强,对金纳米簇的荧光减弱越大,相对荧光强度越大;反之,脂肪酶活性越小,相对荧光强度越小。如图6所示,p-NPP质量浓度在0.8~3.2 mg/mL之间,随质量浓度增大而增加,在1.6 mg/mL基本达到平衡,选择最适质量浓度为1.6 mg/mL。其最适pH值为7.5,最适温度50 ℃,时间为20 min。

图6 褶皱假丝酵母脂肪酶检测实验条件优化Fig.6 Optimal conditions for CRL activity detection
2.5 脂肪酶活性的检测
图7显示了在不同皱褶假丝酵母脂肪酶活性条件下,金纳米簇荧光的改变。随着皱褶假丝酵母脂肪酶活性的增强,金纳米簇荧光强度逐渐降低。相对荧光强度(F0-F)与皱褶假丝酵母脂肪酶活性在5.6~196 U/L范围内呈正相关。线性方程y=2.0035+0.9368x,相关系数r2=0.9978,检出限为1.3 U/L(信噪比为3)。该检测方法与比色法相比,其检出限更低,并且不需对金纳米簇进行修饰,检测方法简单灵活,可应用于实际脂肪酶活性的检测。
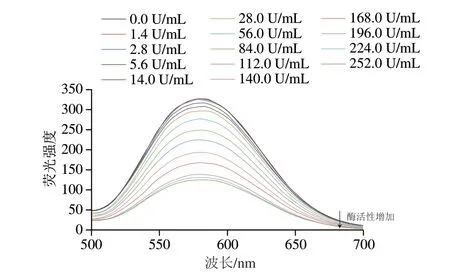
图7 脂肪酶活性检测的荧光图谱Fig.7 Fluorescence spectra for lipase activity detection
2.6 抗干扰检测
为了探究该反应体系的抗干扰性,在溶液中加入乳糖、甘露糖、蔗糖、果糖、麦芽糖、酪蛋白、纤维素酶、葡萄糖苷酶、淀粉酶、木聚糖酶、丝氨酸、木瓜蛋白酶。如图8所示,金纳米簇的相对荧光强度几乎不受这些物质影响,而脂肪酶加入后相对荧光强度明显升高,结果表明该方法对脂肪酶有良好的选择性。

图8 抗干扰检测Fig.8 Evaluation of anti-interference ability
2.7 荧光法与比色法对不同脂肪酶活性比较
为验证结果的可靠性,采用p-NP法对不同种类脂肪酶活性进行了测定,见表1,比色法的测定结果与本研究所建立荧光法检测脂肪酶活性结果顺序一致,即皱褶假丝酵母脂肪酶>假丝酵母脂肪酶>猪胰脂肪酶。虽然本方法所采用的酶活性参数与比色法不同,但脂肪酶活性的变化趋势完全一致。本方法采用相对荧光强度(F0-F)当作脂肪酶活性大小的参数,相对荧光强度越高,说明脂肪酶活性越高。
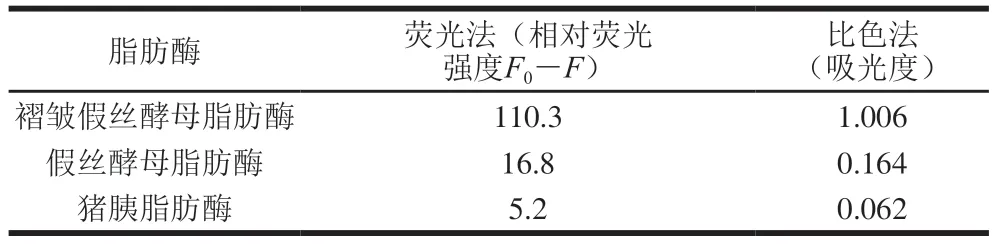
表1 荧光法与比色法对不同脂肪酶活性比较Table 1 Comparison of lipase activity determined by fluorescence and colorimetric methods
3 结论
探究了一种基于荧光内滤效应检测脂肪酶活性的方法,在该反应体系中,以谷胱甘肽为修饰剂体和还原剂合成了谷胱甘肽-金纳米簇,其作为反应体系的荧光团,在脂肪酶的作用下,p-NPP水解为p-NP,其作为荧光的吸收剂,利用荧光内滤机理测定脂肪酶活性。该方法具有操作简便、灵敏度高以及样品消耗少等优点,在脂肪酶活性检测方面具有良好的应用前景。
