乳铁蛋白、表没食子儿茶素没食子酸酯、高甲酯果胶和β-环糊精四元复合物基高内相Pickering乳液的构建及表征
2023-08-05谢丽清徐班萌梁新红
谢丽清,徐班萌,梁新红,李 波,杨 伟
(河南科技学院食品学院,河南 新乡 453003)
高内相Pickering乳液(high internal phase Pickering emulsion,HIPPEs)是内相体积分数大于74%的一类Pickering乳液[1]。与传统Pickering乳液相比,HIPPEs仅需少量固体或胶体颗粒就能稳定油滴,所形成的乳液体系多为半固态凝胶结构,具有优异的抗聚集、抗絮凝和抗奥氏熟化等特性[2-3],在食品工业中可作为人造奶油替代物或活性物质运载体系等[4]。
研究发现,与单一颗粒或二元复合物相比,多元复合物稳定Pickering乳液的能力通常更加优异。其中,蛋白质-多酚-多糖三元复合物是目前研究热点之一。许多三元复合物,如明胶-单宁酸-葡甘聚糖[5]、豌豆蛋白-表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)-高甲氧基化果胶[6]、乳铁蛋白(lactoferrin,LF)-姜黄素-燕麦β-葡聚糖[7]和LF-EGCG-低甲酯果胶[8]等,已成功用于稳定Pickering乳液。在这些体系中,蛋白质提供表面活性,多糖通过空间排斥或位阻提供物理稳定性,而多酚一方面作为抗氧化剂为乳液体系提供化学稳定性,同时通过“桥联”作用与蛋白质和多糖共同构建出更加优异的黏弹性网状结构,进一步提高了乳液的物理稳定性。因此,推测在蛋白质-多酚-多糖三元复合物颗粒基础上进一步构建四元复合物颗粒,可能会具有更加优异的乳化稳定能力,但目前仍鲜见相关研究。
β-环糊精(β-cyclodextrin,β-CD)是由8 个葡萄糖单元通过α-1,4-糖苷键连接的具有闭环结构的低聚糖,具有独特的疏水空腔,该特性使其能够包埋小分子,提高小分子的稳定性或水溶性[9]。另外,有研究报道,β-CD能够稳定Pickering乳液[10]。因此,将β-CD引入蛋白质-多酚-多糖三元复合物体系,可能能够通过与蛋白质、多酚和多糖之间的相互作用改变复合物的结构,进而形成新的功能特性。目前,有关利用β-CD调控蛋白质-多酚-多糖三元复合物结构和乳化特性的研究尚鲜见报道。
本研究在LF-EGCG-高甲酯果胶(high methoxylated pectin,HMP)三元复合物的基础上引入β-CD,以进一步调控三元复合物结构。首先,借助多种光谱学技术表征四元复合物结构;然后,制备HIPPEs并研究乳液的微观结构、流变和质构特性、3D打印特性以及冷藏稳定性;最后,提出四元复合物形成以及其稳定HIPPEs的作用机制。本研究能够为蛋白质-多酚-双多糖四元复合物的构建及其在HIPPEs中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
LF(纯度>92%)新西兰New Image国际有限公司;EGCG(纯度>98%)美国Sigma有限公司;β-CD、异硫氰酸荧光素、尼罗红 上海源叶生物科技有限公司;HMP(甲酯化度72%)安徽乔富企业有限 公司;大豆油 上海益海嘉里食品股份有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
ALPHA1-2 LD plus真空冻干机 德国Christ公司;IKA-T25数显型高速剪切仪 德国艾卡公司;2100N型浊度计 美国Hach公司;Cary Eclipse型荧光分光光度计 美国安捷伦公司;TENSOR 27型傅里叶变换红外光谱仪 德国Bruker公司;DCAT21型接触角与表面张力仪 德国DatePhysics公司;Quanta 200型扫描电子显微镜(scanning electron microscopy,SEM)美国FEI公司;LSM780型共聚焦激光扫描显微镜(confocal laserscanning microscopy,CLSM)德国Zeiss公司;BT-9300H型激光粒度分布仪 丹东百特仪器有限公司;Rheolaser Master型光学微流变仪 法国Formulaction 公司;TA.New plus型质构仪 美国ISENSO公司;食品3D打印机 杭州食印科技有限公司。
1.3 方法
1.3.1 三元及四元复合物制备
在10 mmol/L pH 6.0的磷酸盐缓冲液(phosphate buffered saline,PBS)中,分别配制0.04 g/mL LF、4.0 mmol/L EGCG、0.025 g/mL HMP和0.01 g/mLβ-CD母液,充分溶解后使用。
设置2 个空白对照组:LF-EGCG-HMP三元复合物、LF-EGCG-β-CD三元复合物,分别记为MIX1和MIX2。依据β-CD的不同添加顺序,构建得到3 种四元复合物:LFβ-CD-EGCG-HMP、LF-EGCG-β-CD-HMP和LF-EGCGHMP-β-CD,分别记为MIX3、MIX4和MIX5。
配制过程构建严格按照添加顺序进行:MIX1:1 mL LF+1.25 mL EGCG+0.8 mL HMP+1.95 mL PBS;MIX2:1 mL LF+1.25 mL EGCG+0.75 mLβ-CD+ 2 mL PBS;MIX3:1 mL LF+0.75 mLβ-CD+1.25 mL EGCG+0.8 mL HMP+1.2 mL PBS;MIX4:1 mL LF+ 1.25 mL EGCG+0.75 mLβ-CD+0.8 mL HMP+1.2 mL PBS;MIX5:1 mL LF+1.25 mL EGCG+0.8 mL HMP+ 0.75 mLβ-CD+1.2 mL PBS。每次溶液涡旋(3000 r/min,2 min)混合后,均静置30 min,以充分自组装。
1.3.2 浊度测定
分别取20 mL MIX1、MIX2、MIX3、MIX4和MIX5于测试管中进行浊度测定。测定温度为25 ℃。
1.3.3 荧光光谱测定
分别将MIX1、MIX2、MIX3、MIX4和MIX5稀释10 倍后进行荧光光谱扫描。激发波长295 nm,激发和发射的狭缝宽度均为10 nm,扫描温度25 ℃。
1.3.4 红外光谱测定
将MIX1、MIX2、MIX3、MIX4和MIX5于-18 ℃冷冻48 h,之后冷冻干燥。利用红外光谱对冻干样品进行微观结构观察。
1.3.5 界面张力测定
使用吊片法分别测定MIX1、MIX2、MIX3、MIX4和MIX5在大豆油中的界面张力[11]。先将20 mL大豆油加入样品皿中,再将20 mL样品溶液加入另一样品皿中测量,最后把20 mL大豆油加入到20 mL样品溶液中,以PBS作为空白,于25 ℃条件下测定。
1.3.6 接触角测定
分别将冷冻干燥的MIX1、MIX2、MIX3、MIX4和MIX5压片,制成直径13 mm、厚度2 mm的待测样品。将20 mL大豆油加入样品皿中,加适量蒸馏水于另一个新的样品皿中,然后将待测样品浸入大豆油中,在样品表面滴2 µL蒸馏水,平衡10 s,记录并读取接触角值。
1.3.7 SEM观察
将MIX1、MIX2、MIX3、MIX4和MIX5于-18 ℃冷冻48 h,之后冷冻干燥。利用SEM对冻干样品进行微观结构观察。
1.3.8 HIPPEs制备
分别以MIX1、MIX2、MIX3、MIX4和MIX5为液相,大豆油为油相,按油相80%、液相20%比例倒入高脚剪切杯中,使用IKA-T25数显型高速剪切仪以8000 r/min进行剪切,剪切时间为2 min。制得的HIPPEs分别记为HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5。
1.3.9 CLSM观察
参考Yusoff等[11]的方法并稍作修改。称取0.01 g异硫氰酸荧光素和尼罗红分别溶于异丙醇和无水乙醇,制备0.01%异硫氰酸荧光素染色液和0.01%尼罗红染色液,分别对LF和大豆油进行染色。之后按照1.3.8节中的方法制备乳液。将乳液置于凹面载玻片上,用盖玻片覆盖,并在盖玻片周围涂上甘油密封。分别在514、488 nm波长下激发异硫氰酸荧光素和尼罗红荧光,记录乳液微观形貌。
1.3.10 粒径和粒径分布测定
分别取适量HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5于激光粒度分布仪的搅拌装置中,与蒸馏水充分混合,在透光率15%时,进行粒径及其分布测定。
1.3.11 光学微流变测定
将HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5分别装入平底圆柱玻璃管(高度70 mm,外径27.5 mm),静置4 h 后进行微流变分析。记录乳液的弹性因子(elasticity index,EI)、宏观黏度因子(macroscopic viscosity index,MVI)和固液平衡值(solid-liquid balance,SLB)。
1.3.12 质构特性测定
分别取5 mL HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5置于小烧杯中进行质构分析,测定其硬度、黏性、内聚力、胶着性和咀嚼性。探头为P0.5,模式为TPA,测试前后速率均为2 mm/s,测试速率为1 mm/s,压缩距离为4 mm。
1.3.13 3D打印特性测定
选择直径30 mm,高15 mm圆柱体作为3D打印模型,采用1.2 mm口径针头进行3D打印。3D打印参数设置如下:移动速率30 mm/s,回缩速率40 mm/s,填充速率20 mm/s,填充密度80%,温度25 ℃。样品成型后使用游标卡尺测量圆柱体底部直径。
1.3.14 抗氧化能力测定
1.3.14.1 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基清除能力测定
参考朱颖等[12]的方法,并稍作修改。称取3.94 mg DPPH,加入适量无水乙醇溶解,避光超声10 min后,用无水乙醇定容至100 mL,得到100 µmol/L的DPPH自由基溶液,避光保存备用。分别将HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5用蒸馏水稀释10 倍,涡旋2 min。对照组为2 mL 100 µmol/L DPPH自由基溶液+2 mL无水乙醇,空白组为2 mL待测样品+2 mL无水乙醇,实验组为2 mL待测样品+2 mL 100 µmol/L DPPH自由基溶液。各组室温避光反应30 min后,于517 nm波长处测定吸光度。按式(1)计算DPPH自由基清除率:
式中:A为实验组吸光度;A0为空白组吸光度;A1为对照组吸光度。
1.3.14.2 2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力测定
参考朱颖等[12]的方法,并稍作修改。称取ABTS 0.0960 g、过硫酸钾0.0331 g溶于50 mL蒸馏水中,避光静置12 h,作为ABTS阳离子自由基母液。使用无水乙醇稀释母液至其在734 nm波长处的吸光度为0.70±0.02,用作ABTS阳离子自由基待测液。分别将HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5用蒸馏水稀释10 倍作为待测样品。空白组为3.6 mL ABTS阳离子自由基溶液+0.4 mL无水乙醇,实验组为3.6 mL ABTS阳离子自由基溶液+0.4 mL待测样品。各组室温避光反应5 min,于734 nm波长处测定吸光度。按式(2)计算ABTS阳离子自由基清除率:
式中:A为空白组吸光度;A0为实验组吸光度。
1.3.15 乳液稳定性测定
乳析指数:分别取5 mL HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5于10 mL离心管中,8000 r/min 离心20 min,测定离心后析出层与乳液高度。按式(3)计算乳析指数:
贮藏稳定性:分别取适量HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5于玻璃瓶中,常温放置1、3、5、7 d后观察样品表观变化。
冷藏稳定性:分别取适量HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5于玻璃瓶中,4 ℃冷藏1、3、5、7 d后,常温放置20 min,观察样品表观变化。
1.4 数据分析
2 结果与分析
2.1 三元及四元复合物的结构特性
由图1A可知,MIX1的浊度高达2637 NTU。这与之前的研究类似,这是因为HMP带负电荷,能够与 LF-EGCG复合物通过静电复合物形成高浊度凝聚体[13]。随着β-CD添加,形成的四元复合物浊度进一步增加,表明复合物中分子间的聚集行为增强。当β-CD质量浓度达到0.0015 g/mL后,进一步增加其质量浓度,溶液浊度不再增加,表明此时β-CD对溶液体系的影响达到饱和。在0.0015 g/mLβ-CD条件下,MIX2的浊度仅为15 NTU,溶液清澈透明。这也与之前的研究类似,认为β-CD作为中性电荷,不能与LF通过静电相互作用,但能够通过其疏水空腔结合EGCG,竞争性干扰LF与EGCG的相互作 用[14]。另外,自组装顺序直接影响了加入β-CD后的四元复合物浊度,从高到低依次为MIX3>MIX4>MIX5。
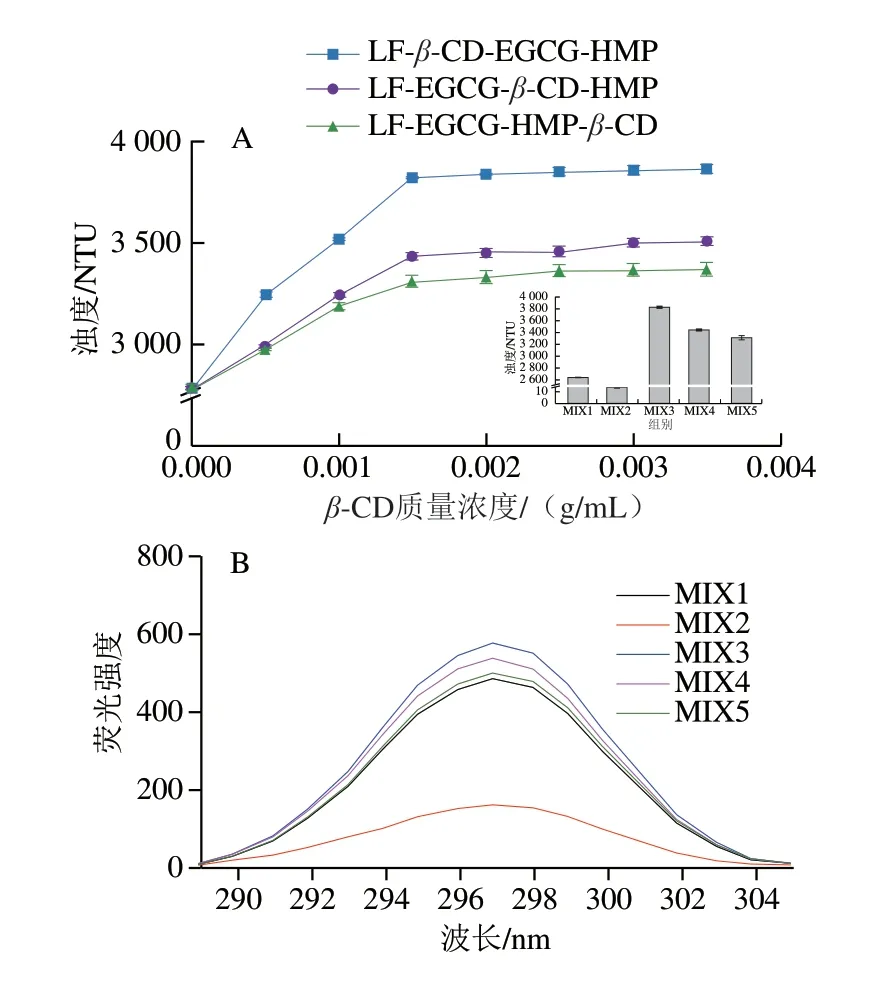

图1 三元及四元复合物的浊度(A)、荧光特性(B)、红外 光谱(C)、油-水界面张力(D)、接触角(E)和SEM图像(F)Fig.1 Turbidity (A),fluorescence spectra (B),FTIR spectra (C),oilwater interfacial tension (D),contact angle (E) and SEM images (F) of the ternary and quaternary complexes
由图1B可知,相较于MIX2,MIX1的荧光强度较强,表明研究所用浓度条件下,相比于β-CD,HMP对LF与EGCG相互作用的干扰能力更强,进而减弱EGCG对LF的荧光淬灭效应。与MIX1相比,四元复合物的荧光强度增强,表明β-CD的添加进一步减弱了EGCG对LF的荧光猝灭效应。这可归因于β-CD所具有的空腔结构,能够通过氢键包埋EGCG。
在蛋白质红外光谱中,位于3400 cm-1附近的酰胺A带与N—H伸缩振动有关,当其与氢键缔合时,将向低波数位移[15]。由图1C可知,MIX1和MIX2的酰胺A带分别位于3365.1 cm-1和3355.9 cm-1处,而在MIX3、MIX4和MIX5中分别红移至3332.1、3305.9 cm-1和3307.7 cm-1。蛋白质的酰胺I带位于1600~1700 cm-1之间,归因于多肽骨架的C=O伸缩振动,其变化也与氢键的形成密切相关[16]。与MIX1和MIX2相比,MIX3、MIX4和MIX5中的酰胺I带出现明显蓝移。显然,氢键参与了四元复合物的形成。另外,在1057~1077 cm-1区域峰的位移进一步表明四元复合物中各物质之间发生了相互作用。
界面张力的降低有利于乳化稳定[17]。由图1D可知,与三元复合物相比,四元复合物的界面张力降低约3 mN/m,表明添加β-CD后,复合物更易于吸附在乳滴表面,表现出更强的乳化稳定性。MIX3界面张力最低,说明其乳化稳定性最强。在四元复合物中,LF、EGCG和β-CD均具有稳定HIPPEs的能力,因此,它们之间的相互作用可能是四元复合物乳化稳定性提高的原因。
接触角是衡量颗粒润湿性的重要指标。通常,接触角小于90°时,表明颗粒具有较强的润湿水能力,形成的Pickering乳液多为O/W型;反之,接触角大于90°时,表明颗粒具有较强的润湿油能力强,形成的乳液多为W/O型。另外,接触角越接近90°时,形成的乳液越稳定[18]。由图1E可知,三元复合物和四元复合物的接触角之间差异明显,从高到低为:MIX3(89.9±0.2)°> MIX4(85.8±0.2)°>MIX5(79.5±0.2)°>MIX2(76.2±0.2)°>MIX1(74.6±0.1)°,这表明相比于三元复合物,四元复合物更易稳定HIPPEs。特别是MIX3,其接触角接近90°,显著高于MIX1和MIX2,这直接说明了自组装顺序的重要意义。即自组装顺序通过灵活调控四元复合物的结构和颗粒润湿性,显著影响着它们稳定HIPPEs的能力。这与之前强调自组装顺序对于LF-EGCG-低甲酯果胶三元复合物结构和乳化特性影响的研究结果[8]一致。
由图1F可知,MIX1表现出典型的网络交联结构,这与其含有HMP密切相关。HMP能够通过氢键、疏水相互作用和范德华力等非共价作用力与LF和EGCG分别或共同相互作用,进而形成复杂的网络结构。相比而言,MIX3、MIX4和MIX5的网络交联行为更加明显,结构更加致密。此外,MIX2的颗粒形貌几乎无网络结构,这是因为β-CD并不具备HMP的结构特点,其所形成的 “—(LF-EGCG-β-CD)n—”结构不具备相互交联特性。
综上,β-CD的添加显著影响了LF-EGCG-HMP三元复合物的结构,所形成的四元复合物可能会不同程度地影响HIPPEs的结构和稳定性。
2.2 CLSM分析
如图2所示,三元复合物和四元复合物用异硫氰酸荧光素染色,呈绿色;大豆油用尼罗红染色,呈红色。三元复合物和四元复合物(绿色)均吸附在乳液界面,并紧密包裹着乳滴(红色)。显然,这些乳液均为O/W体系。同时,连续相呈绿色,说明存在大量游离的(未吸附的)三元复合物和四元复合物。它们能够通过空间位阻作用抑制乳滴的聚结,有利于HIPPEs的稳定。另外,乳滴均呈非球形,表明这些乳液由Pickering稳定机制稳定,乳滴间存在强烈的挤压形变行为。

图2 三元及四元复合物的粒径分布及CLSM图Fig.2 Particle size distribution and CLSM images of the ternary and quaternary complexes
由表1可知,在这些HIPPEs中,乳滴的粒径大小和均一度存在一定差异。HIPPE1的D50、D4,3、D3,2分别为(23.24±0.17)、(26.24±0.12)、(9.18±0.13)μm,HIPPE 2 的D50、D4,3、D3,2分别为(26.99±0.61)、(38.87±0.30)、(12.32±0.61)μm,均一性较差。相比而言,HIPPE3、HIPPE4和HIPPE5中的D50、D4,3、D3,2分别在17~20、19~24、7~10 μm范围内,乳滴粒径明显减小,分布趋于均一。基于四元复合物的复杂网络结构以及优异的颗粒润湿性(接触角更接近90°),推测四元复合物通过两方面提高HIPPEs稳定性:1)更紧密吸附于油水界面;2)在连续相中形成高黏度网状结构,通过强大的空间位阻作用和高黏度有效抑制乳滴之间的聚集。

表1 三元及四元复合物的粒径Table 1 Particle sizes of the ternary and quaternary complexes
2.3 光学微流变分析
相比于机械流变,以多散斑扩散波光谱学为理论基础的光学微流变可以在无干扰条件下准确反映软物质体系(如悬浮液、乳液、水凝胶和泡沫等)的流变性质,目前已成为一种重要的流变学研究手段[19]。
EI值表征乳液的弹性,其大小与体系中网络结构的强度密切相关。EI值越大,乳液中网络结构越致密,体系越稳定;反之,乳液中网络结构越松散,体系越不稳定,易发生形变[20]。由图3可知,与HIPPE1和HIPPE2相比,HIPPE3、HIPPE4和HIPPE5的EI增大,特别是HIPPE3,EI值达(4.4±0.1)×10-3nm-2,是HIPPE1和HIPPE2的1.64 倍和1.88 倍。这表明HIPPE3、HIPPE4和HIPPE5的连续相中形成了更加致密的网络结构,可归因于MIX3、MIX4和MIX5致密的网络结构。
MVI值表征乳液的黏性,值越大表示体系中液滴的运动阻力越强,体系越稳定[21]。由图3可知,与HIPPE1、HIPPE2相比,HIPPE3、HIPPE4和HIPPE5具有更高的MVI值。这说明在HIPPE3、HIPPE4和HIPPE5中,乳液液滴的运动速度变慢,乳液变得更加稳定。显然,β-CD的添加增强了乳液连续相中三元复合物的黏度。
SLB值表征乳液的固液特征。通常,0<SLB<0.5时,体系倾向于固体行为;0.5<SLB<1.0时,体系倾向于液体行为;SLB=0.5时,体系达到固液平衡[22]。由图3可知,HIPPE1的SLB值为0.50±0.001,说明HIPPE1 为固液平衡体系,HIPPE2 的SLB 值为0.57±0.0025,大于0.5,说明HIPPE2体系更倾向于液体。相比而言,HIPPE3、HIPPE4和HIPPE5的SLB值减小,分别为0.45±0.001、0.46±0.001和0.47±0.001,说明β-CD的加入使HIPPE1由固液平衡体系向类固体体系转变。乳液的类固体行为较液体行为和固液平衡更有利于防止乳液体系的聚结和奥氏熟化[23]。
2.4 质构特性和3D打印特性
由表2可知,HIPPE3、HIPPE4和HIPPE5在硬度、黏性、内聚力、胶着性、咀嚼性指标上均优于HIPPE1和HIPPE2,这可归因于HIPPE3、HIPPE4和HIPPE5的致密网络结构和高黏性[24]。
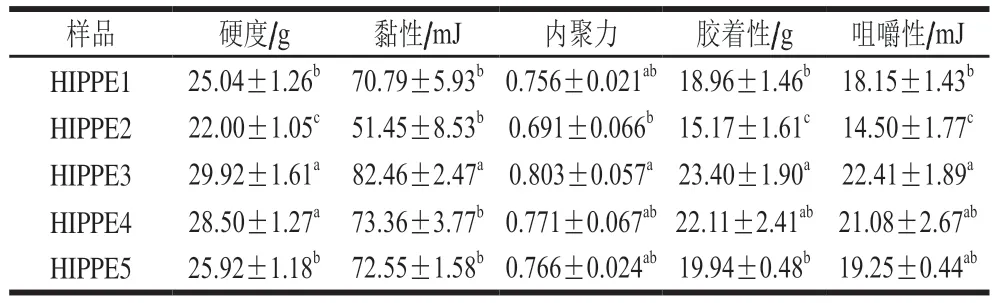
表2 三元及四元复合物的质构特性Table 2 Texture characteristics of the ternary and quaternary complexes
3D打印技术因其快速成型、个性化定制等优点,特别适合用于食品新结构的开发和应用[25]。图4A为HIPPE1、HIPPE2、HIPPE3、HIPPE4和HIPPE5的3D打印成型效果图。通过对3D打印乳液底部直径的测定,可间接反应乳液的3D打印稳定性。初始3D打印HIPPEs为直径30 mm、高15 mm的圆柱体。但放置12 h后,HIPPE1和HIPPE2出现较为严重的坍塌,由图4B可知,乳液底部直径分别达到40.1 mm和41.0 mm。相比而言,HIPPE3、HIPPE4和HIPPE5底部直径介于35.3~38.8 mm之间。这说明四元复合物基HIPPEs的支撑性能更强,表现出更加优异的3D打印特性,特别适合作为食品3D打印材料。显然,这应归因于HIPPE3、HIPPE4和HIPPE5的优异黏弹性和质构特性。
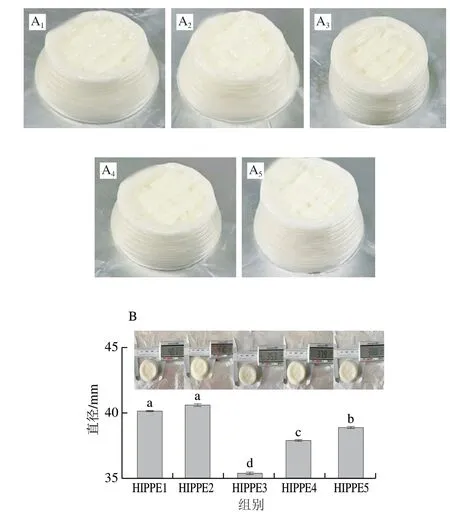
图4 三元及四元复合物的表观形貌(A)和3D打印直径(B)Fig.4 Visual appearance (A) and 3D printed diameters (B) of the ternary and quaternary complexes
2.5 抗氧化能力分析
之前报道发现,与单一多酚和蛋白质-多酚二元复合物相比,一些蛋白质-多酚-多糖三元复合物的抗氧化性较低,这种现象被归因于复合物中多糖对多酚“束缚”[26-27]。然而,本研究发现,与三元复合物基乳液相比,四元复合物基乳液的抗氧化性增强。由图5可知,HIPPE3、HIPPE4和HIPPE5的DPPH自由基清除能力分别为82.3%、76.6%和73.3%,高于HIPPE1(41.5%)和HIPPE2(45.7%);ABTS阳离子自由基清除能力分别为54.2%、51.2%和48.5%,高于HIPPE1(40.3%)和HIPPE2(42.3%)。由于EGCG是发挥抗氧化性的主要因素,因此推测四元复合物基HIPPEs抗氧化性提高的原因是:β-CD通过氢键作用与EGCG结合,竞争性降低HMP对EGCG的“束缚”,通过形成相对松散的“—(β-CDEGCG-HMP)n—”结构,增加EGCG的水溶性,进而提高整个乳液体系的抗氧化能力。不过,该推测仍需进一步研究加以验证。

图5 三元及四元复合物的DPPH自由基和ABTS阳离子自由基清除能力Fig.5 DPPH and ABTS cation radical scavenging activities of the ternary and quaternary complexes
2.6 乳液稳定性分析
乳析指数可以用于评价乳液的物理稳定性,其值越高,乳液物理稳定性越差,反之则越强[28]。由图6A可知,HIPPE2在离心后表现出明显的破乳现象(大量油析出),说明LF-EGCG-β-CD三元复合物的乳化稳定性较差。HIPPE3、HIPPE4和HIPPE5的乳析指数低于HIPPE2,说明它们的离心稳定性增强。HIPPE3的乳析指数最小,这可归因于HIPPE3较小的粒径、较致密的结构和较高的黏弹性。

图6 三元及四元复合物的乳析指数(A)、常温稳定性(B)和 冷藏稳定性(C)Fig.6 Creaming index (A),room temperature stability (B) and refrigeration stability (C) of the ternary and quaternary complexes
由图6B、C可知,5 种乳液均表现出良好的常温稳定性,但其冷藏稳定性却不相同:HIPPE1、HIPPE2出现了可见的析油现象,而在HIPPE3、HIPPE4和HIPPE5中并未发生。这说明HIPPE3、HIPPE4和HIPPE5具有良好的冷藏稳定性,适合在冷藏食品体系应用。
2.7 四元复合物及其HIPPEs可能的形成机制
如图7所示,在MIX3中,首先形成LF-β-CD二元混合物(LF与β-CD相互作用力弱);添加EGCG后,形成浊度较低的LF-β-CD-EGCG三元复合物;之后,借助于与LF和EGCG的相互作用,HMP将LF-β-CD-EGCG三元复合物吸附于表面,促进了各成分之间的交联,形成了结构复杂的网络结构。MIX4的结构形成过程与MIX3类似,区别在于大量LF-EGCG-β-CD三元复合物存在于该结构内部,部分“掩盖”了复合物整体的乳化能力。MIX5的网络结构相对简单,主要是由LF-EGCG-HMP三元复合物及围绕在该复合物表面的β-CD组成。总之,β-CD的加入推动了复合物中各成分的重组装,优化了颗粒网络结构,使其具备更加适宜的润湿性。当MIX3、MIX4和MIX5作为连续相稳定HIPPEs时,这些颗粒通过强界面吸附能力及高黏网络结构,赋予HIPPEs优异的黏弹特性和稳定性。
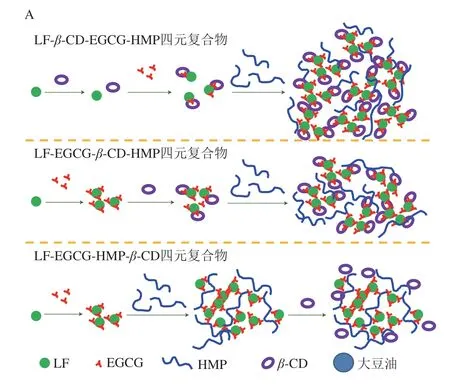
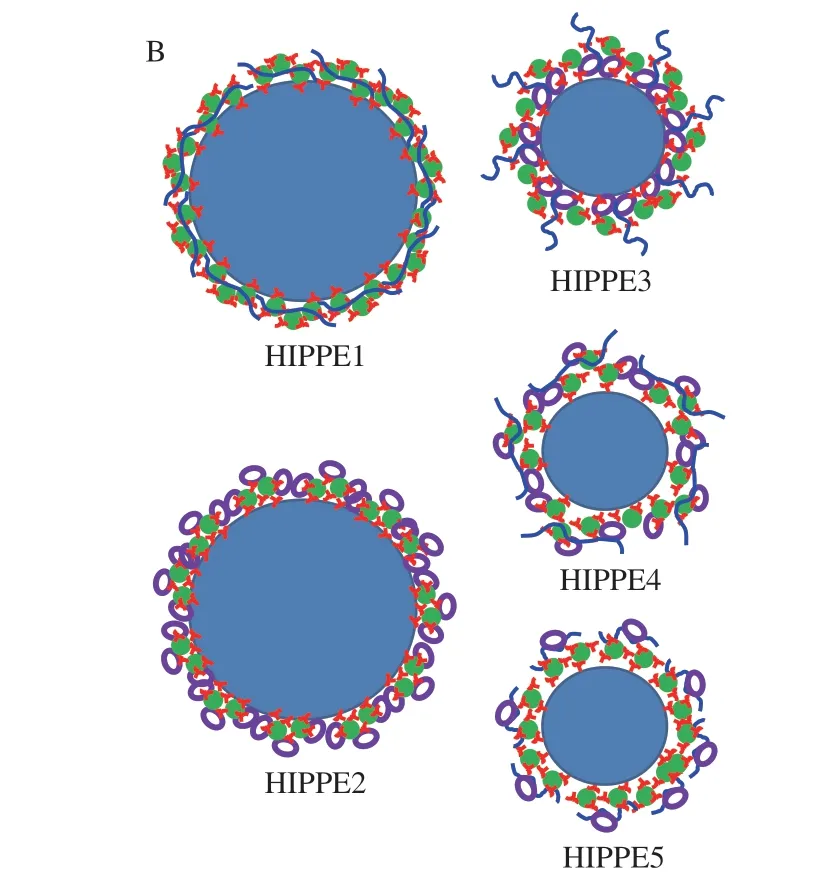
图7 四元复合物可能的形成(A)及其稳定HIPPEs的 作用机制(B)示意图Fig.7 Schematic diagrams of the possible mechanisms involved in the formation of the quaternary complexes (A) and the structures of HIPPEs (B)
3 结论
与三元复合物相比,由LF、EGCG、HMP和β-CD自组装构建的四元复合物具有较低的界面张力和更加适宜的润湿性,表现出优异的稳定HIPPEs特性。四元复合物的致密交联网络赋予HIPPEs更高的黏弹性、质构特性和3D打印特性。同时,β-CD能够通过干扰EGCG与LF或HMP的结合,显著提高HIPPEs的抗氧化特性。另外,自组装顺序灵活调控着四元复合物的结构和乳化特性。本研究为蛋白质-多酚-双多糖四元复合物的构建及其在HIPPEs中的应用提供理论依据。
