苹果轮纹病菌对吡唑醚菌酯的敏感性及犆狔狋犫基因序列分析
2023-08-05王丽侯珲朱佳红等
王丽 侯珲 朱佳红等


关键词 苹果轮纹病;葡萄座腔菌;吡唑醚菌酯;敏感性;细胞色素b基因
中图分类号:S 482.92 文献标识码:A DOI:10.16688/j.zwbh.2022383
近些年苹果产业给中国农业经济带来了巨大的效益,栽培面积和区域逐步稳定和集中,种植面积和产量均居全球第一。然而作为苹果生产大国的中国与其他贸易大国相比,苹果品质不高、管理水平不足等客观问题仍然存在[1]。其中,病害的发生严重影响苹果的质量和产量,成为产业发展中的瓶颈。苹果轮纹病(apple ring rot)主要由Botryo-sphaeria dothidea引起,在欧美认为是白腐病(white rot),因后期病瘤开裂脱落造成粗皮,所以也叫粗皮病等,在全球不同苹果产区均有发生[1]。该病害是中国苹果生产中的重要病害之一,通常情况下能导致减产25%,发病严重的不套袋果园病果率高达80%,枝干上轮纹病发病率严重时高达77.6%[3]。
目前,仍然将化学防治作为苹果轮纹病的主要防控措施。常用的杀菌剂包括苯并咪唑类(MBCs)、甾醇去甲基化抑制剂(DMIs)和甲氧基丙烯酸酯类(Qols)等[4]。然而,不使用登记农药及超剂量施用农药等违规情况十分常见,致使果品质量安全得不到保证。而且长期单一、大量使用杀菌剂,苹果轮纹病菌对药剂的敏感性已有所下降[3]。关于苹果轮纹病菌对MBCs类杀菌剂的敏感性研究屡见报道[6],研究发现B.dothidea已对这类杀菌剂产生了E198A型抗性[7]。由于DMIs类杀菌剂对苹果轮纹病有良好的防效,其在苹果上应用越来越广泛,国内学者研究了苹果轮纹病菌对这类杀菌剂的敏感性[4,6,8]。然而,关于苹果轮纹病菌对QoIs类杀菌剂的敏感性研究较少。
Qols类杀菌剂作用于线粒体细胞色素b(Cytb),通过与细胞色素bc1复合物结合,阻断呼吸途径中的电子转移,导致由于缺乏三磷酸腺苷造成能量缺乏[9]。有的植物病原菌当Cytb受到抑制时,其交替氧化酶(AOX)呼吸途径被启动补偿能量,而水杨肟酸(SHAM)等物质能够阻碍植物病原菌的AOX呼吸途径,所以在研究病原菌对此类杀菌剂的敏感性试验中,为了避免AOX途径的干扰,通常加入适当浓度的SHAM[10]。同时在研究不同病原菌对QoIs类杀菌剂的敏感性时发现,SHAM添加与否对病原菌敏感性影响不同,说明不同病原菌的细胞色素氧化酶呼吸途径被QoIs杀菌剂抑制时AOX途径的启动情况存在差异[11]。关于苹果轮纹病菌受到QoIs类杀菌作用时AOX水平尚不明确。
據报道,QoIs类杀菌剂作用位点单一,因此病原菌对其很容易产生抗性。在许多植物病原菌中发现了对此类杀菌剂的抗性,并且已经广泛研究了其抗性机制。例如,苹果黑星病菌Venturia inaequal-is,香蕉叶斑病菌Mycosphaerella fijiensis,链格孢属真菌Alternaria spp.,指状青霉Penicillium dig-itatum和番茄白粉病菌Leveillula taurica等病原菌的靶标基因测序结果表明,Cytb基因中的第143位密码子由GGC突变为GCC,即G143A型突变,导致菌株对QoIs类杀菌剂的高抗性[12-16]。在超过20种真菌的抗性菌株中检测到G143A突变。另外,其他位点氨基酸变化也可以导致抗药性发生,例如,第129位氨基酸由苯丙氨酸转变成亮氨酸(F129L)以及G137R型突变等已在病原真菌中发现,但抗性水平低于G143A型突变[17-18]。然而,也有研究发现,在一些对QoIs类杀菌剂敏感性下降的植物病原菌中,没有发现Cytb基因突变,关于这类的抗性机理还不明确,需进一步研究[19-20]。
吡唑醚菌酯属于QoIs类杀菌剂,具有内吸治疗作用,对多种植物病原真菌表现出优良的活性[21]。据报道其已在我国苹果园中使用多年,对苹果轮纹病有较好的抑制作用[22],至今为止没有关于B.do-thidea对吡唑醚菌酯产生抗性的报道。鉴于上述情况,本研究对国内不同地区苹果轮纹病菌对吡唑醚菌酯的敏感性进行了测定,建立其敏感性基线;对敏感性不同的苹果轮纹病菌菌株的Cytb基因部分序列进行测序分析,研究靶标基因中是否产生抗性相关的点突变。旨在为制定苹果轮纹病的科学防控方案和抗性治理策略提供技术支撑,并为解析QoIs类杀菌剂的抗性机制提供理论依据。
1材料与方法
1.1供试菌株
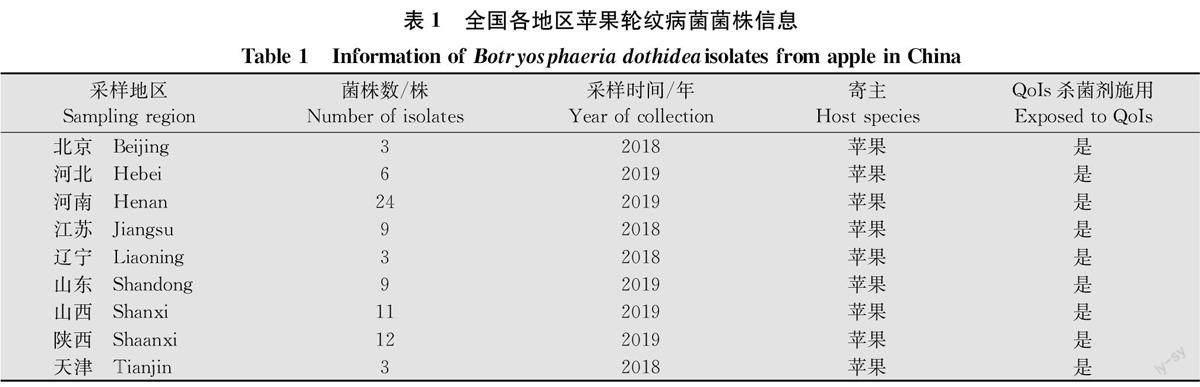
2018年至2019年,从中国9省市的苹果产区采集有轮纹病症状的枝条或果实病样。采用组织分离法获得440株分离物,经鉴定确定其为B.do-thidea[7]。选取80株菌株保存于4℃的PDA斜面上备用。供试菌株信息见表1。
1.2供试药剂
96%吡唑醚菌酯原药,江苏剑牌农药化工有限公司;99%的水杨肟酸(SHAM),Aladdin(上海)公司。均用丙酮溶解配成1×10μg/mL母液,于4℃保存备用。
1.3水杨肟酸对菌丝生长的影响
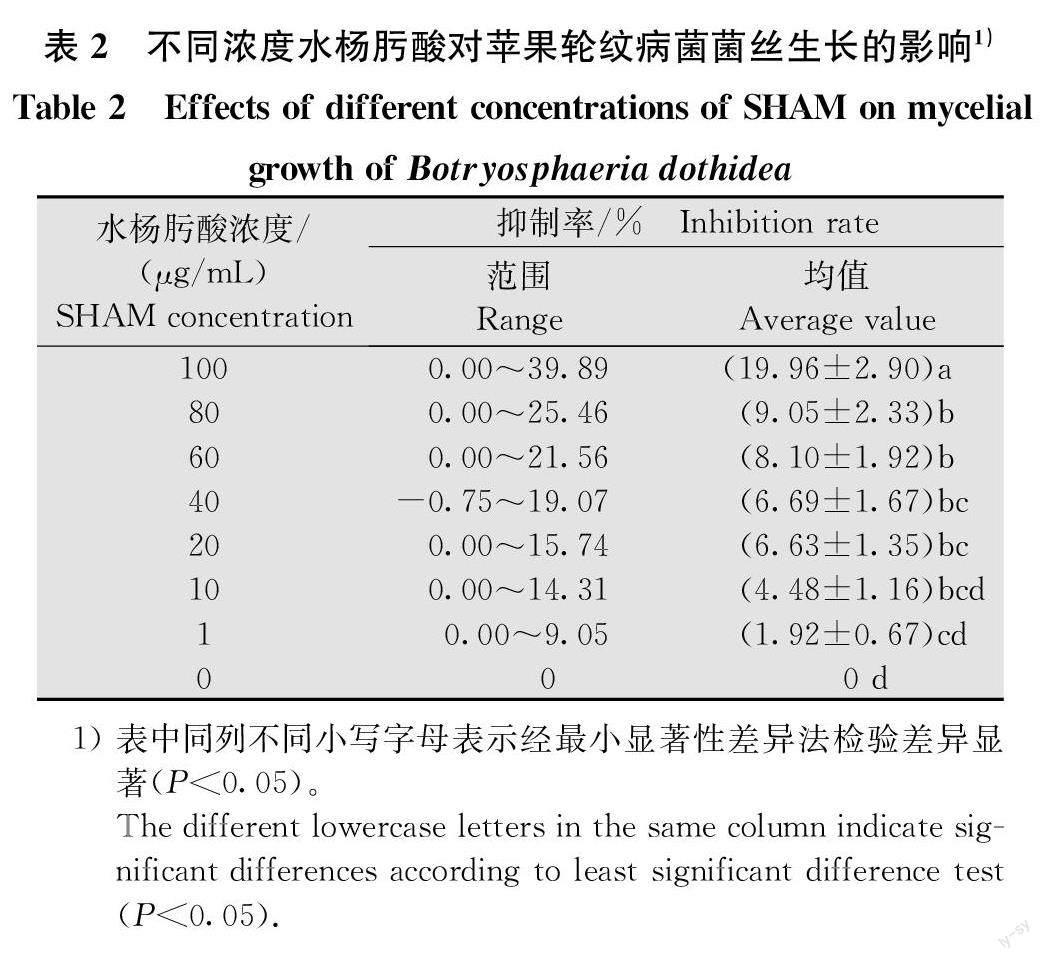
随机选取20株苹果轮纹病菌,在PDA培养基上培养5d备用,应用菌丝生长速率法测定不同浓度SHAM对病原菌菌丝生长的影响。配制含1、10、20、40、60、80μg/mL/mL和100μg/mL SHAM(终浓度)的PDA平板,以含丙酮的PDA平板为对照。用灭菌打孔器(d=5 mm)打取菌饼,菌丝面朝下接种到各平板中心,放人恒温培养箱,25℃下培养。待对照平板菌丝长满培养皿时,用数显游标卡尺十字交叉法测量菌落直径,计算抑制率。
抑制率=(空白对照菌落直径-药剂处理菌落直径)/空白对照菌落直径×100%。
1.4水杨肟酸对病原菌对吡唑醚菌酯敏感性的影响
选取12株苹果轮纹病菌,添加1.3中确定的适当SHAM浓度,测定SHAM是否影响病原菌对吡唑醚菌酯的敏感性。分别配制含0、0.04、0.12、0.37、1.11、3.33、10μg/mL和30μg/mL吡唑醚菌酯(终浓度)和适当SHAM浓度的PDA培养基,以及含吡唑醚菌酯但不含SHAM的PDA平板。以添加相同量的丙酮和SHAM的平板为对照。每个菌株3个皿,每处理重复3次。待平板完全凝固后,按1.3的方法接种培养,测量菌落直径及计算抑制率。以抑制率几率值为纵坐标(y),吡唑醚菌酯浓度对数为横坐标(x),计算毒力回归方程、相关系数(r)及EC等。
1.5苹果轮纹病菌对吡唑醚菌酯的敏感性测定
根据1.4的结果,添加SHAM不影响B.do-thidea菌株对吡唑醚菌酯敏感性,故此试验不添加SHAM。依据1.4的方法,测定供试80株苹果轮纹病菌对吡唑醚菌酯的敏感性。然后以敏感基线的10倍为鉴别浓度测定所有440株菌株对吡唑醚菌酯的抗性。在含有鉴别浓度杀菌剂的培养基上,敏感菌株的菌丝生长受到严重抑制(抑制率大于80%),而抗性菌株则不受影响或受到影响有限[23]。
1.6苹果轮纹病菌部分Cytb序列分析
据报道,病原菌对QoIs杀菌剂产生抗性是靶基因Cytb基因点突变导致氨基酸突变引起的,主要突变类型包括G143A和F129L,另外G137R等类型的突变也有报道。本试验选取对吡唑醚菌酯敏感性较低和较高的菌株各6株。使用DNA提取试剂盒提取其基因组DNA,PCR扩增Cytb基因含常见突变位点的片段。根据GenBank中B.dothidea的Cytb序列(KY801668.1)设计了2对引物,Cytb-07F/R:5′-AGGTGTACATTTTGATTATGAGG-GA-3′/5′-AAGATTGCAGAAAGATTGTTACT-CG-3′和Cytb-6F/R:5′-AACCTAGATTCAGAAA-ATATTAGAA-3′/5′-CGTGTATTCAATTAAA-ACTAGTATA-3′,分别扩增含第129位氨基酸的1285bp基因片段和含第137位、第143位氨基酸的1492 bp基因片段。PCR扩增体系(25μL)为:PCRMaster Mix 12 μL,10 μmol/L Cytb-07F/R(或Cytb-6F/R)引物各1μL,模板DNA 1μL和超纯水10μL。扩增条件为:94℃预变性2 min; 94℃变性30s,60℃退火30s,72℃延伸2min,30个循环;72℃延伸10min。PCR产物经1.5%琼脂糖凝胶电泳检测后,由北京六合华大基因科技有限公司测序。测序结果用BioEdit软件对不同敏感菌株的Cytb基因序列进行比对分析。
1.7数据统计分析
采用DPS和Excel对试验数据进行统计分析,应用单因素方差分析(One-way ANOVA)和LSD进行显著性检验,显著水平设置为α=0.05,
2结果与分析
2.1水杨肟酸对病原菌菌丝生长及其对吡唑醚菌酯毒力的影响
不同浓度的SHAM对苹果轮纹病菌菌丝生长的抑制作用不同(表2),最高浓度100μg/mL下抑制作用最强,达到19.96%,且与其他浓度的抑制率差异显著;SHAM浓度为1μg/mL和10μg/mL时对菌丝生长的抑制率与对照之间差异不显著;虽然现有报道中经常选用对病原菌菌丝生长抑制率小于30%的SHAM浓度[24],但本研究中最高浓度抑制率仅为19.96%,综合考虑最终将添加40μg/mL的SHAM应用到敏感性试验中。试验结果表明,添加SHAM不影响B.dothidea菌株对吡唑醚菌酯的敏感性,在添加或不添加SHAM件下吡唑醚菌酯对12株菌株的ECso均差异不显著(表3),对其进行多因子分析,取样适切性量数(Kaiser-Meyer-Olkin,KMO)值为0.50,说明SHAM是否存在与B.do-thidea菌株对吡唑醚菌酯的敏感性之间相关性差。
2.2苹果轮纹病菌对吡唑醚菌酯的敏感性
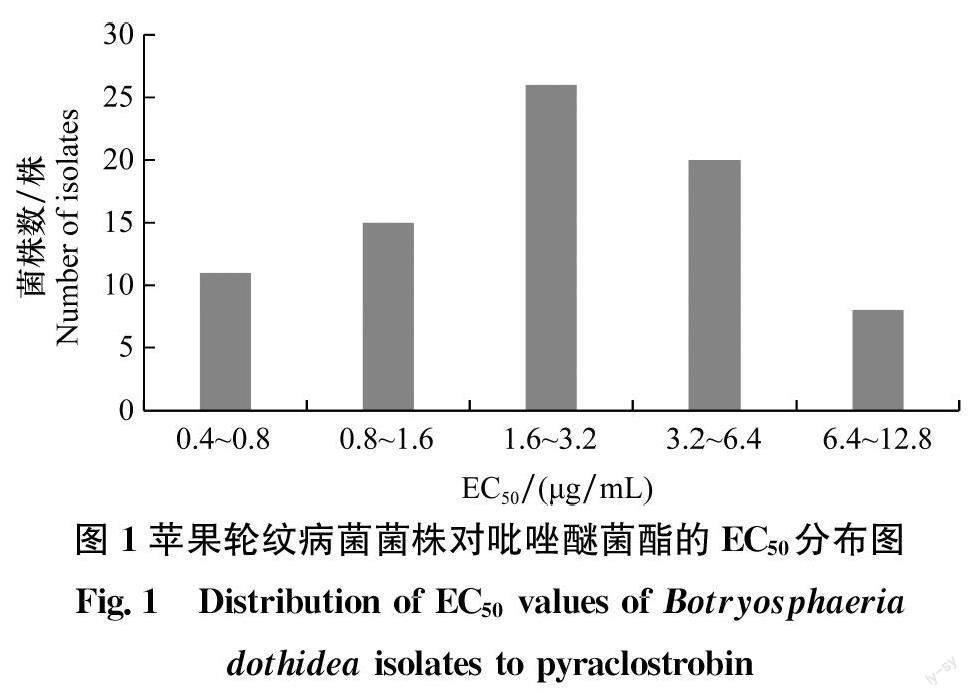
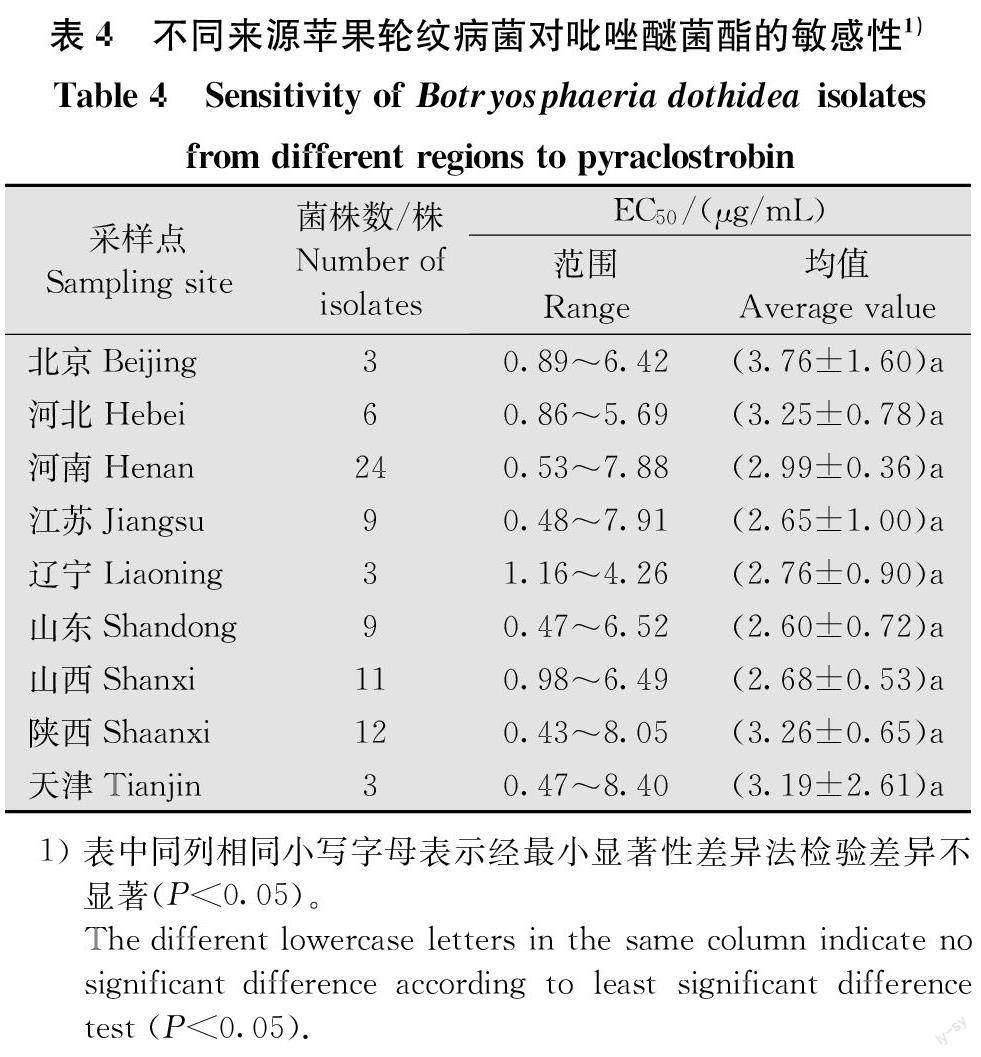
B.dothidea菌株对吡唑醚菌酯的敏感性试验表明,80株菌株的ECso范围是0.43~8.40μg/mL,平均ECso是(2.95±2.11》μg/mL。结果(图1)显示,苹果轮纹病菌对吡唑醚菌酯的敏感性频率符合近似正态分布(W=0.9699,P>0.05),因此可将此EC平均值作为苹果轮纹病菌对吡唑醚菌酯的相对敏感性基线。从表4可知,采自中国9个地区的苹果轮纹病菌的平均EC之间差异不显著。对440株菌株的抗性检测结果显示没有抗性菌株。
2.3苹果轮纹病菌Cytb序列分析
本试验扩增了吡唑醚菌酯敏感性较低和较高菌株的Cytb基因片段。测序结果表明,该序列涵盖了与吡唑醚菌酯抗性有关的3个密码子(F129、G137和G143)碱基序列(TTC、GGT和GGT),序列分析发现在131位密码子和143位密码子后分别有一段1356 bp和1061 bp的内含子插入(图2a)。研究认为工型内含子其5′端上游的外显子末尾碱基是T,且其3′端下游外显子首个碱基是G[25]。因此,Cytb基因143位密码子后内含子为工型内含子。此外,序列比对发现敏感性较低的菌株(Bd-347)和敏感性较高的菌株(Bd-250)碱基序列没有差异(图2b),各菌株在143位密码子后都有长度为1061 bp的内含子插入,其他菌株Cytb基因序列也都一样。结果说明B.dothidea菌株没有产生引起吡唑醚菌酯抗性的Cytb基因点突变。
3结论与讨论
苹果轮纹病的病原菌B.dothidea是一种园艺植物病原菌,能够感染多种木本植物[26]。生产上对其引起的病害仍然是以化学防治为主。QoIs类杀菌剂具备杰出的抑菌作用,在化学防治中广泛应用。例如,此类杀菌剂中的吡唑醚菌酯已在我国苹果园中使用多年[22]。本研究测定了中国9省市苹果产区80株苹果轮纹病菌对吡唑醚菌酯的敏感性,建立了苹果轮纹病菌对吡唑醚菌酯的敏感基线,可为苹果轮纹病菌对吡唑醚菌酯的抗药性监测提供理论依据。甲氧基丙烯酸酯类杀菌剂的敏感性试验中通常加入旁路氧化途径抑制剂SHAM,但对不同的病原菌其加入浓度也不尽相同[11]。本研究中100μg/mLSHAM的高浓度下对菌丝的抑制率仅为19.96%,综合考虑最终将添加40μg/mL SHAM应用到敏感性试验中。同时还发现SHAM存在与否不影响B.dothidea菌株对吡唑醚菌酯的敏感性。因此,本研究认为在测定B.dothidea对吡唑醚菌的敏感性时,SHAM不是必需添加的。
此外,本研究分析B.dothidea菌株的Cytb基因序列時发现,在Cytb基因的143位密码子后面插入一个内含子(长度为1061 bp),这个内含子的插入目前在B.dothidea菌株中还未见报道。当病原菌中有此内含子插入时,G143A位点的突变将阻碍内含子配对和剪接过程,并产生有缺陷的Cytb,携带G143A突变和上述内含子的突变菌株会在某个时间点存在,但是由于Cytb的缺陷可能会导致这些菌株的适合度降低,使其很快从群体中消失[25,27]。目前多种植物病原菌中已报道在143位密码子后面有内含子插入,包括Botrytis cznerea,Moniliniafructicola,Guignardia bidwellii,Alternaria spp.以及Fusicladium rffusum等[25,28-31]。但至今为止,报道的G143A突变只存在Cytb基因143位密码子后没有紧跟内含子的病原菌中,而此密码子后有紧跟内含子的病原菌中未曾报道产生此突变[27]。据此推断B.dothidea很难对QoIs类杀菌剂产生G143A抗性突变。敏感性测定也没发现吡唑醚菌酯抗性菌株。目前也没有相关文献报道B.dothidea对QoIs类杀菌剂产生抗性。因此在生产上可以推荐此类杀菌剂与其他类型杀菌剂交替使用防治苹果轮纹病,尤其是对多菌灵产生抗性的地区。但病原菌对QoIs产生抗性的机理除Cytb基因G143A类型点突变导致的高水平抗性外,应该还有其他未知机理,还需进一步研究。且持续对苹果轮纹病菌进行抗药性研究,可实现对苹果轮纹病更为有效的防治。
本研究表明,添加适量的水杨肟酸对苹果轮纹病菌对吡唑醚菌酯敏感性的影响不显著,目前尚未发现对吡唑醚菌酯产生抗性的B.dothidea菌株,且苹果轮纹病菌对吡唑醚菌酯的敏感性在不同产区差异不显著。首次发现B.dothidea菌株的Cytb基因143位密码子后面有一个内含子的插入。
