广西柑橘衰退病和黄脉病调查及其病原病毒的遗传多样性分析
2023-08-05耿雪欣高方栏梁文馨等
耿雪欣 高方栏 梁文馨等



关键词 柑橘衰退病毒;柑橘黄脉病毒;病原检测;遗传多样性分析
中图分类号:S 432. 41 文献标识码:A DOI: 10.16688/j.zwbh 2022391
柑橘是全球最重要的经济作物之一,是世界第一大类水果[1]。广西是我国最大的柑橘种植区,随着种植面积的不断扩大,柑橘病毒病的威胁越来越大。柑橘衰退病由柑橘衰退病毒(citrus tristeza vi-rus,CTV)引起,是柑橘产业中最具毁灭性的病毒病害之一,导致柑橘产量和品质降低,树势衰弱甚至死亡。CTV是长线形病毒科Closteroviridae长线形病毒属Closterovirus成员,为正义单链RNA(posi-tive single strand RNA,+ssRNA)病毒。基因组长约20 kb[2],含有12个开放阅读框(open reading frame,ORF),被认为是目前已知最大的植物RNA病毒[3]。CTV有外壳蛋白(coat protein,CP)和小外壳蛋白(minor coat protein,CPm)两种外壳蛋白[4]。其中,CP基因位于ORF 7,是CTV病毒颗粒的主要组装成分[5]。通常,CP和CPm的序列表现出很大程度的保守性[6]。有研究表明,CTV的CP具有RNA沉默抑制活性,会极大地促进病毒颗粒的积累,是其致病性的重要决定因素。在我国,多个柑橘产区如四川、重庆,广西、江西等地均陆续有柑橘感染CTV的报道[8]。柑橘黄脉病由甲型线性病毒科Alpha flexiviridae印度柑橘病毒属Mandarivirus的柑橘黄脉病毒(citrus yellow vein clearing virus,CYVCV)引起,症状表现为叶片脉明黄化,并伴随皱缩、反卷,叶背水渍状等,严重时导致树势减弱,果实减产。CYVCV为+ssRNA病毒,含有6个开放阅读框,其中CP由ORF 5编码,对核酸起保护作用,决定了病毒的寄主范围、细胞内系统侵染能力、症状表现和向外扩散传播的能力[9]。目前,我国已报道的CYVCV分离物主要来源于浙江、江西、湖北、湖南、广东、广西、福建、云南、四川和重庆等地[10]。该病毒可通过嫁接和介体昆虫传播,在我国主要柑橘产区常与CTV发生混合感染[11]。
病毒的CP基因具有序列保守的结构域,不仅可用于病毒的分子检测,还可以进行同种病毒不同分离物和不同种病毒之间的遗传多样性分析[12]。本研究通过调查广西百色、北海、崇左、贵港、桂林、河池、贺州、来宾、柳州、南宁、梧州、玉林等柑橘产区的衰退病和黄脉病发生情况,对CTV和CYVCV阳性样品的CP基因进行RT-PCR扩增测序,了解这两种病毒CP基因序列的遗传多样性及其与地理来源和寄主来源的相关性,为病毒的流行监测、早期诊断和抗病品种培育提供参考。
1材料与方法
1.1材料
2020年9月到2021年9月间,采集广西百色、北海、崇左、贵港、桂林、河池、贺州、来宾、柳州、南宁、梧州、玉林等12个柑橘产区多个柑橘品种的叶片样品共737份。柑橘类样品包括‘沃柑’‘砂糖橘’‘马水橘’‘蜜橘’‘八月橘’‘茂谷柑’‘贡柑’‘金橘’‘皇帝柑’和‘温柑’等;橙类样品包括‘蜜香橙’‘脐橙’‘冰糖橙’和‘红江橙’等;柚类样品包括‘青柚’‘沙田柚’‘蜜柚’和‘红心柚’等。疑似感染病毒病样品的症状包括明显的植株矮小和生长迟缓,叶片变小、斑驳、皱缩以及叶脉变黄。样品置于-80℃超低温冰箱保存备用。
1. 2总RNA提取和RT-PCR
取0.1 g左右的柑橘叶片样品置于研钵中,加入液氮研磨成粉末,用TRIzol法提取叶片总RNA[13]。使用反转录试剂盒(百迈客生物科技有限公司)合成cDNA。反应体系为20μL,包括:总RNA 1.0μg, d(T)23VN 2.0μL, 10mmol/LdNTPs 1.0μL, Biomarker Script Ⅱ Reaction Mix(2×)
10.0μL, Biomarker ScriptⅡEnzyme Mix(10×)2.0μL,Nuclease-free H20补充至20μL;常温下静置反应5 min后,42℃温浴th。然后用CTV与CYVCV的特异性引物(表1)进行PCR扩增。PCR反应体系为25μL,包括:2×TaqMaster Mix 12.5μL,上、下游引物各1.0μL,模板cDNA 1.0μL,ddH20 9.5μL。PCR反应程序为:95℃预变性3 min; 94℃变性30 s,退火温度下退火30 s,72℃延伸30 s,35个循环;72℃延伸5 min,4℃保存。1.5%琼脂糖凝胶电泳检测PCR产物。使用凝胶DNA回收试剂盒[天根生化科技(北京)有限公司]回收特异性条带。纯化的PCR产物委托南宁鑫金生物技术有限公司进行序列测定。
1.3序列分析
利用NCBI (National Center for Biotechnology Information)數据库的BLAST程序(https:∥blast.ncbi.nlm.nih. gov/Blast.cgi)进行序列比对。采用Vector NTI软件进行序列一致性、核苷酸遗传距离分析,DNAMAN进行多序列比对。从Gen-Bank基因组数据库(http:∥www.ncbi.nlm.nih.gov/genbank/)中检索所有柑橘病毒相关序列后,通过Clustal W程序和默认参数将代表性的特定CP基因序列与本研究中获得的分离物的CP基因序列进行比较和分析,选择具有代表性的病毒CP序列用于系统发育分析。使用MEGA-X软件最大似然(maximum likelihood estimate,MLE)法构建系统发育树,自展检验法(bootstrap)重复取值1000次,根据构建的系统进化树分析各分离物与地理来源和宿主的相关性。
2结果与分析
2.1田间症状
田间柑橘病毒病发生普遍,症状表现复杂多样,包括植株矮化、树势弱、叶脉黄化、叶片脉间失绿和叶片黄化等。其中感染CTV的植株整体长势衰弱,果实小,叶片小、黄化、叶片脉间失绿,似缺素症状;感染CYVCV的则表现为叶脉透明和黄化等。结合病毒检测结果,发现受CYVCV侵染的植株仅在叶片表现症状,枝条和果实尚未观察到典型的症状,部分无症状的样品也检出病毒。调查发现的2种柑橘病毒病田间典型症状见图1。
2.2病毒检出率
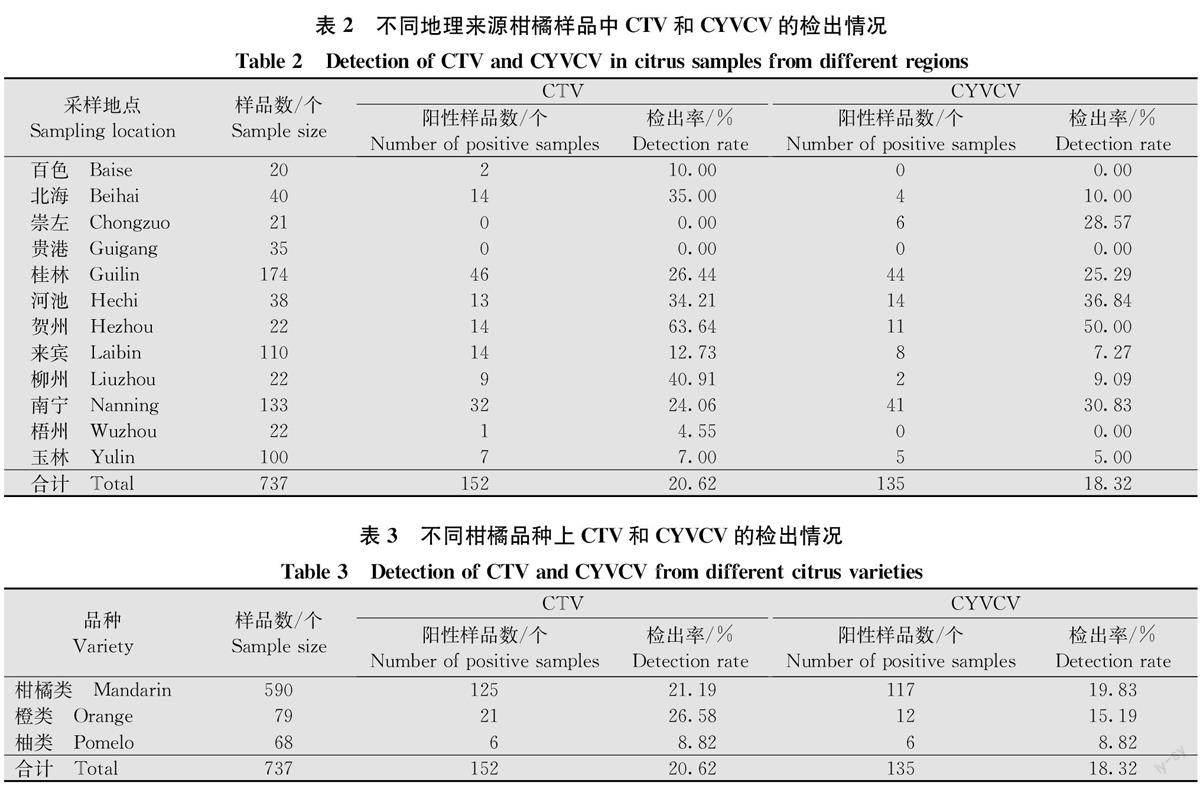
CTV和CYVCV的检出率在不同地区的样品间存在差异(表2)。CTV的总检出率为20.62%,CYVCV的总检出率为18.32%。贵港市样品中两种病毒均未检测出,崇左市样品中未检测出CTV,百色市和梧州市的样品中未检测出CYVCV。此次检测中贺州市样品的CTV和CYVCV检出率最高,分别为63.64%和50.00%。CTV和CYVCV复合侵染的情况普遍存在,复合侵染率为34.50%。
此外,不同柑橘品种中CTV和CYVCV检出率也存在差异(表3)。CTV在橙类上的检出率最高,为26.58%; CYVCV在柑橘类上的检出率最高,为19.83%;在柚类样品上两种病毒的检出率均最低,均为8.82%。
2.3 CTV和CYVCV的核苷酸序列一致性和多重比对分析
选择来源于不同地区和不同柑橘品种的CTV和CYVCV阳性样品,对其CP基因片段进行克隆测序,共获得12个CTV分离物和6个CYVCV分离物的CP基因序列片段(表4)。12个CTV分离物CP基因的核苷酸序列相似性在88.3%~98.3%,存在87个核苷酸变异位点。其中来宾的CTV分离物LB52与北海分离物k2420的遗传差异最大,核苷酸遗传距离为0.13,其余CTV分离物之间核苷酸遗传距离在0.018~0. 123,遗传变异较小。对12个CTV分离物的核苷酸序列进行多重比对分析,发现CP基因的5′端出现较多碱基突变、缺失的现象,3′端区域相对较保守。
本研究获得的6个CYVCV分离物的CP基因核苷酸序列较CTV分离物更为保守,遗传变异较小,序列相似性为97.9%~100%,仅存在10个核苷酸变异位点。其中,来宾分离物LB71与其他分离物的遗传差异最大,相似性在97.9%~98.4%。对CYVCV分离物CP基因的序列进行多重比对,发现来自同一个采集地的CYVCV分离物LB71、LB72、LB73的CP基因序列相似性为97.9%,存在10个碱基的差别,而地理位置相距较远的北海分离物k7093与桂林分离物GL71、GL72的CP基因序列相似性达99.2%,仅有3个碱基的差别。可能是由于近年来广西柑橘种质交流频繁导致该病毒的流行,分离物间尚未因地理隔离出现显著的序列差异。
2.4 CTV和CYVCV分离物的系统发育分析
基于CTV的CP基因序列构建系统进化树,发现CTV的分离物可聚为4个类群(图2)。A类群的14个CTV分离物分别来自中国广西(LB51、LB52、LB53和BH51)、意大利、南非、马来西亚、美国和伊朗。值得关注的是广西分离物LB51与意大利分离物SG29的亲缘关系最近,可能是國际种质交流导致病毒传人国内。B类群的4个CTV分离物来自中国广西(L251、GL53和k4138)和马来西亚(AMJ31),其中分离物k4138与AMJ31聚在同一分支。C类群的4个CTV分离物来自中国广西(k2420、GL51和GL52)和巴西(CSL01),其中分离物k2420与CSL01聚在同一分支。D类群的6个CTV分离物来自中国和美国,其中本研究获得的广西分离物k2051与美国分离物CA-S1-L聚在同一分支。分离物寄主以柑橘属植物为主,包括柑橘类、橙类和柚类等,从系统发育树可以看出,CTV分离物的聚类情况与寄主来源没有明显相关性。
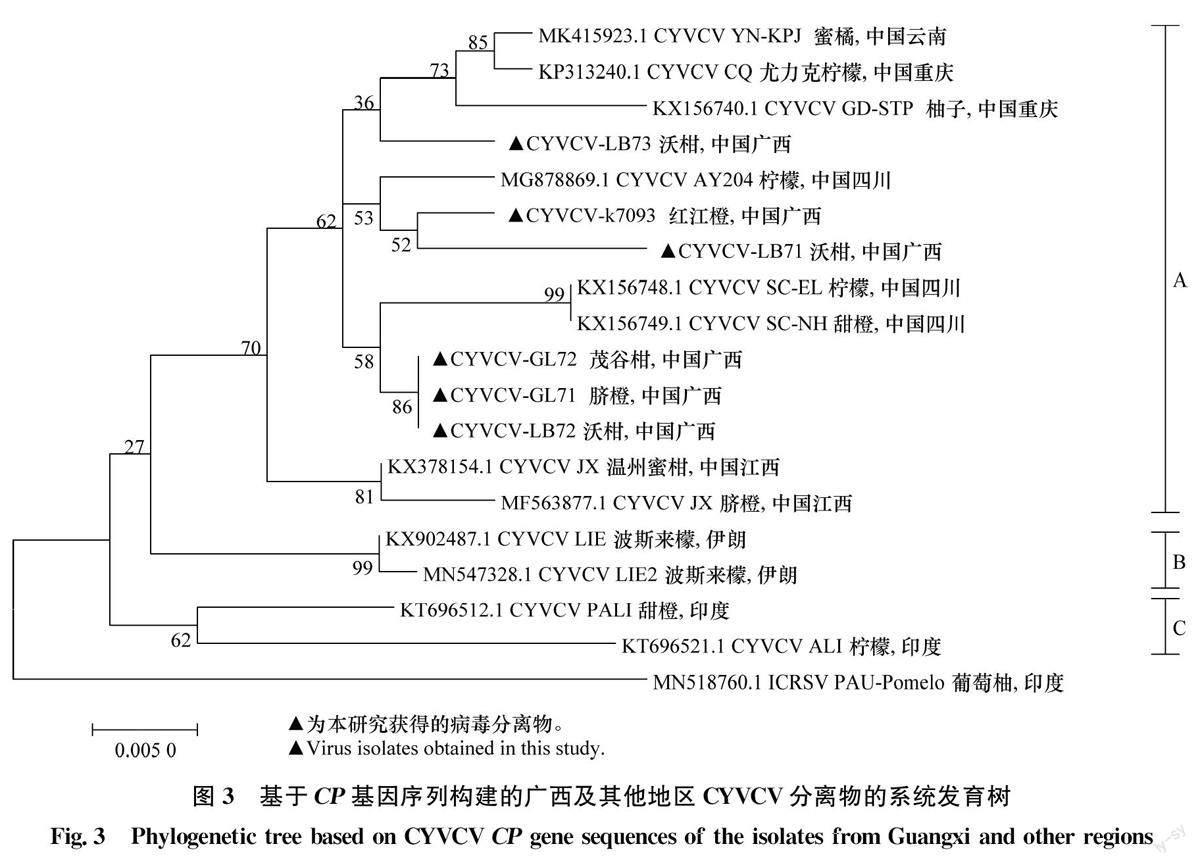
以印度环斑病毒(Indian citrus ringspot virus,ICRSV,MN518760.1)为外群构建CYVCV CP序列系统进化树,发现CYVCV的分离物可聚为3个类群(图3)。分离物寄主以柑橘属植物为主,包括柠檬、甜橙、蜜橘和柚子等。A类群的14个CYVCV分离物来自中国广西、四川、重庆、江西、云南等地,包括本研究获得的广西分离物GL71、GL72、LB71、LB72、LB73和k7093。来自伊朗柑橘分离物单独聚在B类群,2个印度分离物组成了C类群。由系统进化可知CYVCV的进化与柑橘品种没有明显的相关性,但存在地区差异,且本研究获得的所有CYVCV分离物与其他中国本土的分离物亲缘关系较近,说明它们可能为本土毒株。
3结论与讨论
柑橘病毒病对我国柑橘产区的危害越来越严重,特别是CTV和CYVCV常常复合侵染植株,使症状加重,对柑橘产业造成严重危害[11]。因此,了解CTV与CYVCV引起的衰退病和黄脉病在广西柑橘产区的发生情况对柑橘病毒病的防控具有重要指导意义。本研究在广西百色、北海、崇左等12个柑橘产区共采集了737份柑橘样品,其中CTV的检出率为20.62%,CYVCV的检出率为18. 32%。与在海南地区的CTV检出率(71.15%)[16]和福建三明地区CYVCV的检出率(57%)[17]相比,广西的CTV和CYVCV的检出率总体相对较低,与Zhou等2017年报道的广西CYVCV的检出率(29.1%)相比,有所下降[18]。通过分析不同寄主品种上的柑橘病毒检出情况,发现不同柑橘品种对CTV和CYVCV敏感性存在差异。柚类样品上两种病毒的检出率均最低(8.82%)。利用寄主抗病性是控制植物病毒病害最有效的手段之一,针对本研究CTV和CYVCV在柚类样品中检出率最低这一发现,后续可从寄主一病毒互作的角度进行深入研究,明确柚类对CTV和CYVCV是否确实存在较强抗性,为实现现有抗性资源和品种的合理利用,以及将来培育抗病毒柑橘新品种提供新思路。
本研究对获得的12个CTV分离物和6个CYVCV分离物的CP基因的核苷酸序列进行一致性分析,发现这两种病毒的CP基因序列都较为保守,可以针对其保守序列探索多种检测方法。如设计重组酶聚合酶快速扩增技术的特异性引物、制备血清抗体等,为大规模田间快速诊断技术的开发和应用奠定基础。另外对CTV的CP基因序列进行多重比对分析,发现其序列多样性从5′端到3′端逐渐减小,这与易龙[19]对11个野生柑橘和13个栽培品种上的CTV分离物CP基因序列遗传多样性的结果一致,Melzer等[20]对来自美国的CTV分离物的研究也得出这一结论。基于这12个CTV分离物CP基因5′端和3′端序列多样性的研究,可以为CTV毒株的分离与鉴定提供理论依据,为寻找具有交叉保护作用的CTV弱毒株提供新的思路。
对CTV的CP基因进行系统发育分析,发现CTV分离物的序列变异与地理来源和寄主来源没有明显的相关性,说明该病毒在世界各地广泛传播和分布,且适应性较强,无明显的地理和气候条件限制。如本研究获得的广西LB51、k4138、k2420和k2051分離物相较本土分离物,分别与意大利、马来西亚、巴西和美国的CTV分离物亲缘关系更近。推测可能是由于国家间种质交流频繁或无性繁殖材料长距离运输导致亲缘关系较近的分离物在世界范围内不同地方出现。吴官维[21]将中国不同地区的CTV分离物和国外的CTV分离物的CP基因和CPm基因进行系统发育分析,发现不同地理来源的CTV分离物间存在明显的基因漂移,各分离物间无明显的地域相关性,与本研究结论一致。因此,在引种时要加强柑橘苗木的检疫,或尽量种植脱毒苗木,以阻断病毒的传播。
利用CYVCV分离物CP基因序列构建系统发育树,结果显示,供试的CYVCV分离物可聚为3个类群,来自中国广西、四川、重庆、江西、云南等地的14个CYVCV分离物聚为A类群,来自伊朗的CYVCV分离物组成了B类群,2个印度分离物单独聚在C类群,表明CYVCV分离物与地理来源相关,但3个类群与寄主来源无明显相关性。这与刘惠芳[22]和陈洪明等[23]对不同地区以及不同柑橘品种中得到的CYVCV分离物进行遗传多样性分析得出的结论一致。Zhen等[24]对中国和土耳其的柠檬中获得的2个CYVCV分离物的全长序列进行分析,发现CYVCV的序列变异很小,不易因地理和寄主差异发生明显变异。这可能是由于CYVCV入侵中国地区时间不长,种内尚未出现明显变异与分化就广泛传播[18]。
群体遗传多样性的形成是一个长期过程,与种质交流、介体传播、序列突变和自然选择多种因素有关,本研究对广西的CTV分离物和CYVCV分离物进行了系统发育分析,研究结果可为深入了解CTV和CYVCV在广西的流行情况以及柑橘病毒病的检疫和防控提供理论依据和科学指导。
