基于lncRNA DGCR5介导miR-1180/SFRP1/Wnt通路对结直肠癌细胞生长转移的影响*
2023-08-04陈茂良单汉国
陈茂良,单汉国
(南华大学附属第二医院 胃肠外科,湖南 衡阳 421001)
结直肠癌(CRC),是全球最常见的消化系统恶性肿瘤之一。近年来,其发病率随着人们生活方式的改变而出现逐年递增的趋势[1]。CRC 是指发生在结肠与直肠任意部位的癌症,但多以直肠与乙状结肠这两个部位常见[2-3]。由于民众体检意识不强、早期临床表现不明显等,目前确诊的CRC 多为中晚期,此时的癌症细胞具有较强的生长、转移、侵袭能力,CRC 远处转移是导致患者死亡的主要原因之一[4-5]。目前CRC 西医治疗以手术切除+辅助化疗为主,具有较好的效果,但化疗为长期治疗,药物毒副作用长期累加致使患者生活质量与治疗依从性明显降低。有研究证明[6-7]经治疗后的患者仍有20%~30%的可能出现癌症复发的情况,且患者5 年内死于远处转移的概率较高。因此,针对CRC 早期的诊断、寻找新的治疗方法或药物一直是临床工作的重点。
目前多项研究证明了SFRP1/Wnt 通路、miR-1180 和lncRNA DGCR5 参与多种肿瘤的病理过程,并且SFRP1/Wnt 通路已被证明与CRC 具有相关性[8]。而miR-1180 与lncRNA DGCR5 在CRC 中虽无相关研究,但是已被证明在其他多种肿瘤细胞中具有重要的作用[9-10]。研究[11]发现lncRNA DGCR5 能够靶向miR-1180,而miR-1180 能够调节SFRP1/Wnt 通路影响肿瘤病理进程。因此,本研究探析lncRNA DGCR5 对CRC 细胞增殖、转移、侵袭的影响,并分析lncRNA DGCR5 是否通过调控miR-1180/SFRP1/Wnt 通路来发挥作用,以为临床诊治CRC 提供思路。
1 材料与方法
1.1 细胞培养和转染
选取人结直肠癌细胞系SW480,使用RPMI 1640+10%FBS+1% 双抗培养,于37℃、5%CO2环境下培养。将载体DGCR5 NC、DGCR5 mimic 及DGCR5 inhibitor 和转染试剂如Lipofectamine 2000分别加入Opti-MEM 基础培养基互相混合,静置15 min。静置时间内细胞吸去含血清培养基,PBS清洗一遍,加入基础培养基。将载体和转染试剂的混合液加入细胞,饥饿培养6 h。细胞更换成完全培养基,再培养24 h。根据转染情况将SW480细胞分为对照组(C 组,正常培养SW480 细胞)、DGCR5 NC 组(SW480 细胞+转染DGCR5 NC 载体)、DGCR5 mimic 组(SW480 细胞+转染DGCR5 mimic 载体)以及DGCR5 inhibitor 组(SW480 细胞+转染DGCR5 inhibitor 载体)。
1.2 qPCR 检测DGCR5 表达水平
Trizol 法提取SW480 细胞RNA,RNA 沉淀使用适量的RNase-free 水溶解,通过仪器检测RNA浓度和纯度(OD260/OD280),然后使用甲醛变性胶电泳观察RNA 的降解情况,使用反转录试剂盒将RNA 反转录成cDNA。设计DGCR5 引物,最后按照qPCR 试剂盒说明书,配置反应体系,上机检测。
1.3 细胞增殖
1.3.1 CCK8 取对数生长期的SW480 细胞,消化离心后培养基重悬细胞,细胞计数后调整细胞浓度至5×103/100 μL,96 孔板每孔加入100 μL 细胞悬液,培养24 h 后进行转染操作,每组设3 个复孔,24 h 后每孔加入10 μL CCK8 孵育4 h,摇床低速震荡10 min,酶标仪OD450 nm 检测各孔的吸光值。
1.3.2 克隆形成试验 取对数生长期的SW480 细胞,消化离心后培养基重悬细胞,调整细胞浓度后,分别在培养皿中以50、100、200 个细胞的梯度密度接种,培养3 周左右。当出现肉眼可见的克隆时,使用4% 多聚甲醛固定细胞,吸去固定液,加适量Giemsa 染液染色10~30 min,流水缓慢冲洗。干燥后将平皿倒置,叠加带网格的透明胶片,肉眼直接计数克隆或低倍镜计数大于10 个细胞的克隆数。克隆形成率=(克隆数/接种细胞数)×100%。
1.4 细胞凋亡
1.4.1 TUNEL 取对数生长期的SW480 细胞,转染处理。细胞爬片,多聚甲醛固定约1 h,PBS 清洗一遍,加入0.1% Triton X-100 冰浴2 min。PBS清洗两遍,滴加TUNEL 检测液37℃避光孵育1 h。PBS 清洗三遍,最后加抗荧光淬灭剂封片观察。
1.4.2 Western Blot(WB)取对数生长期的SW480 细胞,转染处理后,吸去培养基,预冷的PBS 清洗一遍。加入蛋白裂解液冰上充分裂解细胞,收集细胞裂解液,超声处理,离心取上清。BCA 法进行蛋白质定量,调整蛋白浓度一致,加入SDS 煮蛋白使其变性。取30 左右总蛋白样品通过聚丙烯酰胺凝胶电泳分离蛋白,湿法转膜,5%脱脂牛奶封闭,配置DGCR5、β-catenin 和Wnt 蛋白一抗,4 度孵育过夜。TBST 摇床洗膜3×10 min,使用对应的二抗室温孵育1~1.5 h,TBST 摇床洗膜3×10 min,ECL 曝光,根据目的蛋白/内参蛋白评价蛋白的表达水平。
1.5 细胞迁移
1.5.1 划痕实验 SW480 细胞经过转染处理后,使用枪头在6 孔板底部进行“十”字型划痕。吸去培养基,PBS 冲洗划痕时脱落的细胞,重新加入完全培养基进行培养,每6 小时拍照,根据划痕区域的细胞面积判断迁移能力。
1.5.2 Transwell 侵袭实验 配置BD Matrigel TM基质胶,使用无血清培养基稀释,后将稀释液加入Transwell 小室插件中,使其均匀分布在上室底面。待基质胶凝固后,在上室加入细胞悬液,在下室中加入完全培养基。培养24 h 后取出小室插件,棉签轻轻擦去Transwell 小室内侧面细胞,PBS 清洗两遍。使用4%多聚甲醛固定10 min,再用0.1%结晶紫染色,PBS 液洗去多余结晶紫,自然干燥后小室插件在显微镜下拍照,进入下室的细胞量可以反映细胞穿过基质胶(细胞外基质)的能力,即侵袭能力。
1.6 lncRNA DGCR5 与miR-1180 的靶向关系
1.6.1 预测靶向关系 通过miRanda、Targetscan等生物信息学分析软件预测lncRNA DGCR5 与miR-1180 的靶向关系。
1.6.2 荧光素酶报告基因 设计miR-1180 野生型和突变体引物。提取SW480 细胞RNA,逆转录成cDNA,PCR 扩增miR-1180-wt/mut 片段。胶回收目的基因片段,构建miR-1180-wt/mut 载体。将miR-1180-wt/mut 载体分别与DGCR5 过表达和干扰载体及空载体共转染6 h,更换培养基继续培养48 h 后进行荧光素酶活性检测。
1.6.3 qPCR 取对数生长期的SW480 细胞,经DGCR5 过表达和干扰载体及空载体转染处理后,收集细胞。Trizol 法提取RNA,逆转录成cDNA,设计miR-1180 引物,qPCR 检测miR-1180 的表达,方法同上。
1.7 SFRP1/Wnt 通路检测
1.7.1 WB 取对数生长期的SW480 细胞,转染处理后,提取蛋白。通过WB 检测Wnt、β-catenin和SFRP1 蛋白表达水平,方法同上。
1.7.2 qPCR 取对数生长期的SW480 细胞,转染处理后,收集细胞。Trizol 法提取RNA,逆转录成cDNA,设计miR-1180 引物,qPCR 检测SFRP1的表达,方法同上。
1.8 统计学方法
通过Prism 软件进行数据分析与画图。多组间计量资料以均数±标准差()表示,用单因素方差分析检验;计数资料以百分率(%)表示,用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 SW480 细胞转染后lncRNA DGCR5 的表达(qPCR)
qPCR 检测结果显示,与DGCR5 NC 组比较,DGCR5 inhibitor 组细胞的lncRNA DGCR5 表达水平下降(P<0.05);DGCR5 mimic 组细胞的lncRNA DGCR5 表达水平显著高于DGCR5 NC 组与DGCR5 inhibitor 组,差异有统计学意义(P<0.05)。见图1。
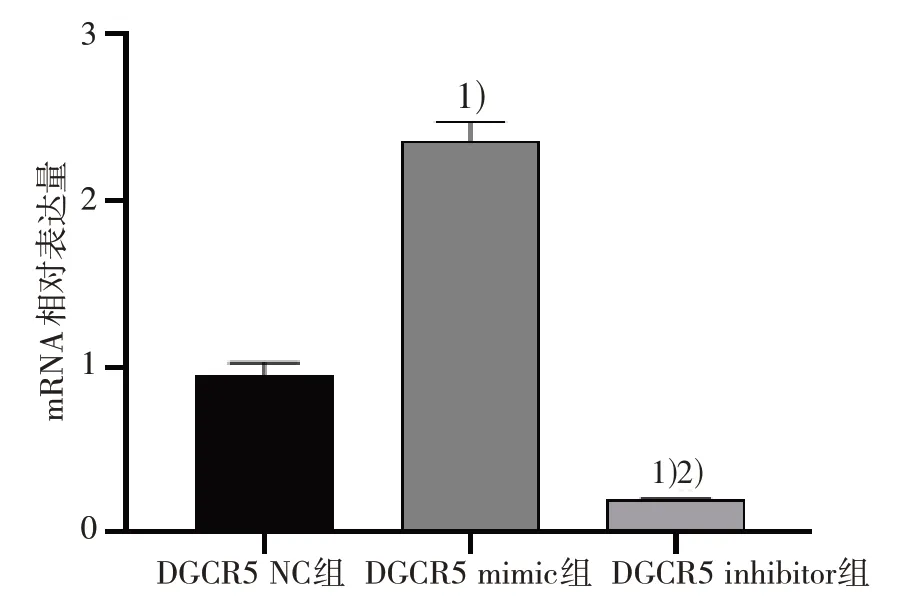
图1 各组SW480 细胞的lncRNA DGCR5 表达水平
2.2 lncRNA DGCR5 对SW480 细胞活力及增殖的影响
2.2.1 CCK8 法检测lncRNA DGCR5 对SW480细胞活力 CCK8 检测结果显示,与DGCR5 NC 组比较,DGCR5 mimic 组细胞相对增值率显著降低;DGCR5 inhibitor 组细胞相对增值率显著高于DGCR5 NC 组与DGCR5 mimic 组,差异有统计学意义(P<0.05)。见图2。

图2 各组SW480 细胞增值能力的比较
2.2.2 克隆形成检测lncRNA DGCR5 对SW480细胞增殖的影响 克隆形成检测结果显示,上调lncRNA DGCR5 后SW480 细胞的克隆数目显著低于C 组与DGCR5 NC 组,下调lncRNA DGCR5 后SW480 细胞的克隆数目显著高于C 组与DGCR5 NC 组,差异有统计学意义(P<0.05)。由此推测lncRNA DGCR5 在体外具有抑制CRC 细胞增殖的能力。见图3。
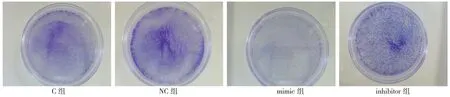
图3 上调或下调lncRNA DGCR5 对SW480 细胞克隆形成的影响
2.3 lncRNA DGCR5 对SW480 细胞迁移及侵袭的影响
2.3.1 各组SW480 细胞迁移能力比较 划痕实验检测细胞迁移能力结果显示,与C 组、DGCR5 NC组比较,DGCR5 mimic 组细胞愈合率显著降低,DGCR5 inhibitor 组细胞愈合率显著升高,差异有统计学意义(P<0.05)。见图4。

图4 各组SW480 细胞迁移能力对比
2.3.2 Transwell 法检测 lncRNA DGCR5 对SW480 细胞侵袭的影响 Transwell 法检测结果显示,与C 组、DGCR5 NC 组比较,DGCR5 mimic组细胞侵袭数量显著降低,DGCR5 inhibitor 组细胞侵袭数量提高(P<0.05)。见图5。

图5 各组SW480 细胞侵袭能力比较
3 lncRNA DGCR5 与miR-1180 的靶向关系
荧光酶素报告结果显示,SW480 细胞共转染miR-1180-wt 和DGCR5 mimic 后细胞的相对荧光强度显著低于共转染miR-1180-wt 与DGCR5 NC的细胞组(P<0.05);而共转染miR-1180-wt 与DGCR5 inhibitor 的SW480 细胞组相对荧光强度显著高于共转染miR-1180-wt 与DGCR5 NC 的细胞组(P<0.05)。共转染miR-1180-mut 和DGCR5 NC、共转染miR-1180-mut 和DGCR5 mimic 与共转染miR-1180-mut 与DGCR5 inhibitor 的三组W480细胞组间相对荧光强度比较,差异无统计学意义(P>0.05)。见图6。

图6 荧光酶素报告验证lncRNA DGCR5 与miR-1180 的靶向关系
4 lncRNA DGCR5 可介导 miR-1180/SFRP1/Wnt 通路的表达
qPCR 检测结果表明,上调SW480 细胞中lncRNA DGCR5 的表达可使miR-1180、Wnt 表达水平明显降低,SFRP1 表达水平升高(P<0.05);下调SW480 细胞中lncRNA DGCR5 的表达可使miR-1180 及Wnt 表达水平明显升高;SFRP1 水平降低(P<0.05)。进一步WB 检测结果显示,上调lncRNA DGCR5 后Wnt 及β-catenin 蛋白的表达均明显下降,SFRP1 蛋白表达上升(P<0.05);下调lncRNA DGCR5 后Wnt 及β-catenin 蛋白的表达均明显上升,SFRP1 蛋白表达下降(P<0.05)。由此笔者推测lncRNA DGCR5 在CRC 细胞中能够通过调控miR-1180/SFRP1/Wnt 通路的表达,来抑制癌细胞的侵袭与转移。见图7。
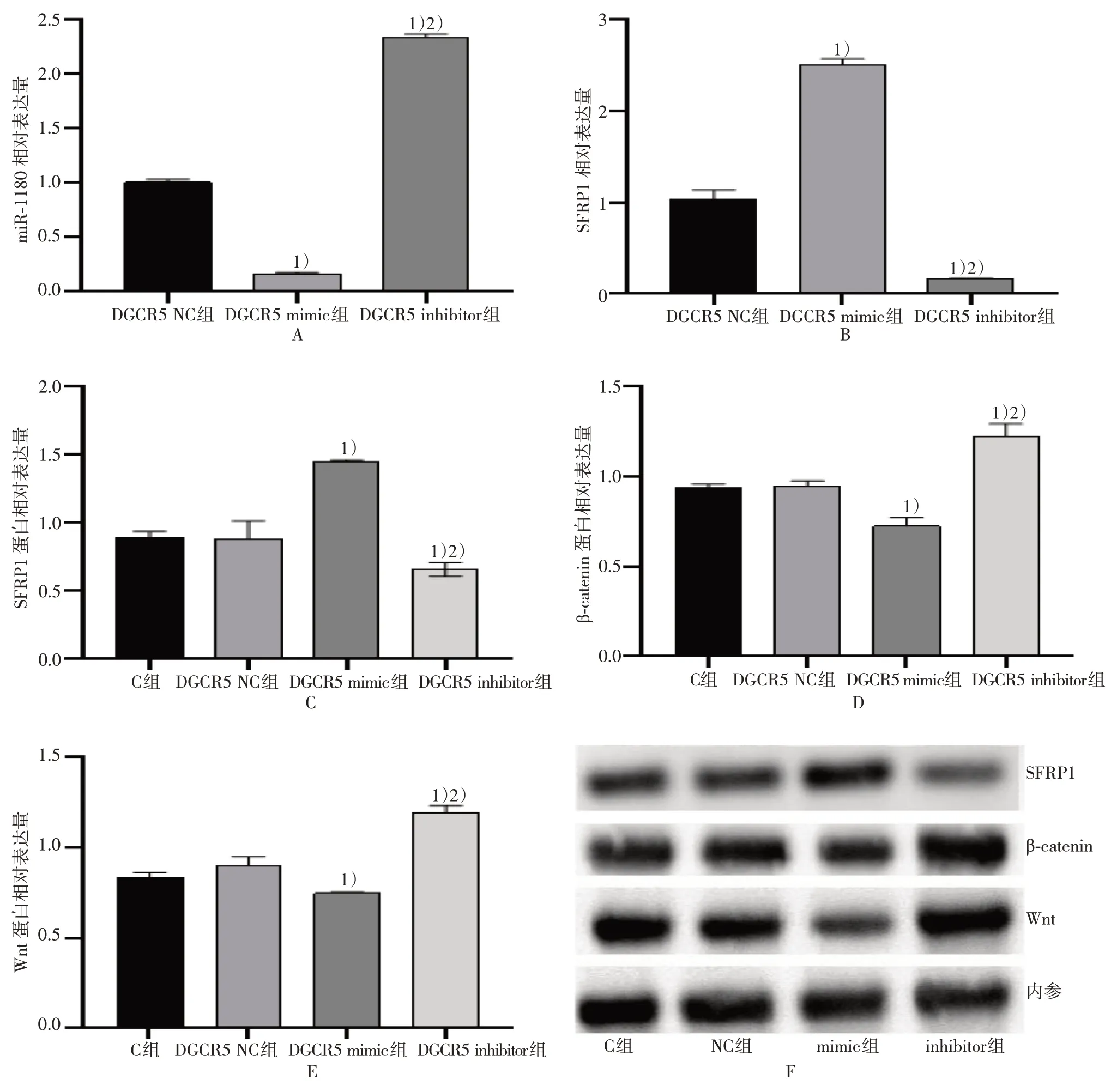
图7 lncRNA DGCR5 介导miR-1180/SFRP1/Wnt 通路
5 讨论
有数据调查显示[12],得益于CRC 诊治、预防技术的发展,近年来早期CRC 患者的生存率有了明显的提高,但晚期CRC 患者由于多数存在癌细胞的转移、扩散,其10 年及以上的生存率仍相当不理想。因而寻找新的CRC 生物标志物与治疗靶点具有重要的临床意义。
lncRNAs 已被证实在癌症细胞的增殖、自噬、转移、侵袭等致病过程中发挥着重要的调节作用[13]。lncRNA DGCR5 是一种肿瘤抑制因子,有研究表明其与肺癌[14]、甲状腺癌[15]、肝癌[16]、膀胱癌[17]等多种癌症细胞的生长、转移有密切的关系。但lncRNA DGCR5 对CRC 细胞增殖、转移的影响目前尚无相关报道。本研究结果显示上调lncRNA DGCR5 的表达后,CRC 细胞的增殖能力降低,下调lncRNA DGCR5 的表达后,CRC 细胞的增殖能力升高(P<0.05)。而上调lncRNA DGCR5 后,细胞的愈合率及侵袭能力均明显下降,而下调后细胞的愈合率及侵袭能力提高(P<0.05)。这提示CRC 细胞内lncRNA DGCR5 的表达能够影响癌细胞的生长、转移及侵袭能力。
lncRNA 通常作为内源性RNA 与微小RNA(miRNA)结合,通过降低组织细胞中miRNA 丰度来抑制mRNA 翻译及两者的结合,提高miRNA靶蛋白的表达,从而在癌症细胞的致病过程中发挥调节作用[18-19]。如lncRNA DGCR5 可通过靶向抑制miR-22-3p 来促进肺腺癌的进展[20];lncRNA DGCR5 还可通过调控miR-21 来促进鼻咽癌细胞的凋亡,抑制其增殖、转移[21]。Wnt/β-catenin 信号转导通路在癌症细胞的生存与增殖中具有重要作用,有研究[22]表明,在90%以上的CRC 中存在着Wnt/β-catenin 通路的异常激活。此外,另有研究证明lncRNA DGCR5 亦可靶向miR-1180 参与调节肺癌的增殖、迁移和侵袭,而miR-1180 已被证明能够调节 SFRP1/Wnt 途径。目前关于lncRNADGCR5 与CRC 的研究尚无报道,因此,笔者猜测lncRNA DGCR5 可能通过靶向miR-1180调控SFRP1/Wnt 通路影响CRC 的病理变化。
本研究通过荧光酶素报告基因实验证明miR-1180 是lncRNA DGCR5 的靶向基因,上调lncRNA DGCR5 的表达能够抑制miR-1180 的表达,而抑制lncRNA DGCR5 后,SW480 细胞中miR-1180 的表达量明显提高。此外本研究还发现,上调lncRNA DGCR5 表达致使miR-1180 表达量下降之后,miR-1180 调节的SFRP1/Wnt 途径的相关基因的表达量亦有所变化,其对应的SFRP1 mRNA与蛋白表达量明显升高,Wnt mRNA 与蛋白表达量和β-catenin 蛋白表达降低。反之下调lncRNA DGCR5 可使miR-1180 的表达量升高,其对应的SFRP1 mRNA 与蛋白表达降低,Wnt mRNA 与蛋白表达量和β-catenin 蛋白表达升高。进一步说明调控lncRNA DGCR5 表达能够有效地抑制CRC 细胞生长,还可通过抑制Wnt/β-catenin 通路来阻断肿瘤细胞的转移。
综上,miR-1180 是DGCR5 的靶基因,抑制或促进DGCR5 的表达能够有效地降低或提高miR-1180 的表达水平。DGCR5 可通过靶向miR-1180调控SFRP1/Wnt 通路来实现对CRC 细胞生长、转移及侵袭的抑制或促进。这提示DGCR5/miR-1180有望成为治疗CRC 的潜在靶点。
