不同生长年限党参根系微生物群落结构和多样性研究
2023-08-03孟彤彤崔兴帅冷非凡王永刚陈吉祥1
孟彤彤,崔兴帅,朱 宁,冷非凡,王永刚*,陈吉祥1, *
不同生长年限党参根系微生物群落结构和多样性研究
孟彤彤1, 3,崔兴帅2,朱 宁2,冷非凡2,王永刚2*,陈吉祥1, 2*
1. 兰州理工大学能源与动力工程学院,甘肃 兰州 730050 2. 兰州理工大学生命科学与工程学院,甘肃 兰州 730050 3. 甘肃省水利科学研究院,甘肃 兰州 730050
探究不同生长年限党参根系微生物群落结构变化及其与土壤环境因子的相关性,以提高党参品质。对一、二、三年生党参土壤、根际土壤和根进行高通量测序和生物信息学分析。随党参生长年限的增加,土壤和根际土壤中优势细菌处于动态平衡,而根内细菌丰度减少。真菌在土壤和根际土壤中丰度逐年降低,病原真菌在党参根系中丰度逐年增加。不同生长年限的党参根系微生物群落组装更多的受随机性过程影响,且根系细菌的群落功能稳定性高于真菌。蛋白酶(protease,PRO)、全氮(total nitrogen,TN)、速效钾(available potassium,AK)、水分(water content,WC)、速效磷(available phosphorus,AP)和土壤有机质(soil organic matter,SOM)是影响不同生长年限党参根系细菌群落结构和多样性的主要影响因素,TN和全钾(TK)是影响真菌群落结构和多样性的主要影响因素。党参根系微生物群落组成和多样性随生长年限改变,并对不同土壤环境因子作出差异化响应,该研究为后期深入研究党参病害防治,提高党参品质提供理论基础。
党参;高通量测序;环境因子;根系;微生物多样性
党参(Franch.) Nannf.属于桔梗科植物,其干燥根作为中国传统补益药,富含甾醇、多糖、炔苷、生物碱等活性成分[1-2]。中国药典中记载,党参具有健脾、润肺、养血、生液、增强免疫等功效[3]。党参在我国种植广泛,而甘肃省是中国最大的党参种植基地,栽培面积占全国种植总面积的90%以上[4]。
植物根系包含根内、根平面、根际和土壤,土壤中蕴含丰富多样的微生物,对生态系统的稳定发挥着重要作用[5-8]。根际作为地球上物质和能量循环、信息交换最活跃的界面之一,也是植物-微生物-土壤相互作用的一个复杂场所[9]。根际微生物系统可以调整植物菌群结构,增强植物抵抗力和提高特殊环境胁迫下的耐受性[10],同时根际土壤微生物也是衡量土壤肥力和养分的重要指标[11]。药用植物产生的黄酮、萜类等次级代谢产物的积累,因种植地点、季节和植物基因型而异,这些因素也会影响定殖于宿主体内微生物的分布[5]。在植物生长过程中,这些代谢产物很容易被释放到土壤中,引起土壤理化性质的改变,最终导致根系微生物群落的变化[12]。冼康华等[13]对3、5、7、9年生华重楼根际微生物和土壤理化因子进行的研究结果表明,随着华重楼生长年限的增加,根际微生物多样性先升高后降低,速效钾和全氮是影响根际细菌群落组成的主要因素,总钾是影响根际真菌群落组成的重要因子。李勇等[14]研究发现不同生长年限的西洋参根际土和非根际土中的微生物群落结构存在显著差异,不同土壤样品的微生物群落结构表现一定的根际效应。国内外研究表明,土壤养分丢失、微生物菌群结构发生变化[15,16-22]等为植物连作障碍的主要原因。综上研究所述,探究在不同生长年限药用植物生长发育对根系微生物群落多样性的影响,对了解药用植物根系状态、促进植株生长、防止土传病虫害及提高药材品质等有极其重要的意义。
近年来党参根系微生物研究多集中在连作障碍[23]、缓解根腐病[24]等方面,而不同发育时期的党参与根系微生物群落多样性变化的研究较少,微生物群落结构变化与党参生长年限的关系仍不清楚。因此,本研究利用Illumina MiSeq的高通量测序技术,对不同生长年限党参土壤、根际土壤和根细菌16S rRNA和真菌ITS序列进行测序,研究不同生长年限的栽培党参根系微生物群落结构组成和多样性,探讨党参生长发育对定殖微生物群落结构变化的影响,为后续深入研究党参活性成分积累调控机制提供理论依据。
1 材料与仪器
1.1 材料
供试党参根际土壤和根来自甘肃省定西市岷县中药种植基地(104°14′40″E,35°10′12″N),植物样本经兰州理工大学生命科学与工程学院制药工程专业杨林副教授鉴定为桔梗科植物党参(Franch.) Nannf.,品种为“白条”。不同年限党参主要通过种苗移栽的方式种植。
1.2 仪器
DYCP-32C型琼脂糖水平电泳仪(北京市六一仪器厂);Covaris超声波破碎仪(Covaris S2 System Massachusetts,美国);Qubit Fluorometric Quantification(Qubit 2.0,Thermo Scientific,美国);Agilent 5400生物分析仪(Agilent Technologies有限公司,USA)T100 PCR仪(Bio-Rad公司,美国);Novaseq 6000测序仪(Illumina,San Diego,CA,美国)。
2 方法
2.1 样品处理
2021年8月中旬,在甘肃省定西市岷县中药种植基地分别采集一年生、二年生和三年生党参根际土壤和药用部位根。采样时,每个样地随机选取6个样方(5 m×5 m),每个样方随机设置3个重复,则共采集党参土壤18×3份,根际土壤18×3份,根18×3份。先采用抖落法收集与根系结合松散的土壤,作为非根际土壤,再收集与根系表面粘附性较强的土壤作为根际土壤(距离根部2.5 mm),最后收集根[25]。土壤样品装入无菌密封袋,冰袋保存迅速送回实验室。随机将每2个样方内的土壤混合作为土壤样本的一个重复;将每个样方内的根际土壤混合,作为根际土壤样本的一个重复;将每个样方内的根混合,作为根样本的一个重复。3个处理(SF、SS、SR),共得到18组样品,分别标记为SF1、SF2、SF3、SS1、SS2、SS3、SR1、SR2、SR3。SF1、SF2、SF3分别表示一、二、三年生党参土壤;SS1、SS2、SS3分别表示一、二、三年生党参根际土壤;SR1、SR2、SR3分别表示一、二、三年生党参根。所有样品平均分成2份,一份保藏于−80 ℃用于高通量测序,一份保藏于−20 ℃用于理化性质测定。
采集的党参根部,分别用毛刷去除表面土壤,自来水冲洗干净,利用0.1%次氯酸钠表面消毒10 min,再用75%乙醇,消毒5 min,最后用无菌水冲洗干净,无菌滤纸吸干表面水分,最后一次清洗水用于菌落检查,将确定表面消毒彻底的根部保存在预先灭菌的离心管中,液氮速冻,置于−20 ℃冰箱中,用于后续的内生菌群落结构分析。
2.2 土壤理化性质测定
土壤理化性质测定参考《土壤农化分析》[26]。土壤有机质(SOM)含量测定采用重铬酸盐湿法燃烧法;全氮(TN)测定采用凯氏定氮法;速效氮(AN)测定采用碱扩散法;全磷(TP)含量测定采用钼酸铵比色法;速效磷(AP)含量测定采用碳酸氢钠浸提-火焰分光光度法。全钾(TK)含量测定采用氢氧化钠熔融-火焰分光光度法[27]。速效钾(AK)含量采用醋酸铵浸提-钼锑抗比色法[28]。土壤含水率(MC)采用常规烘干恒重法测定[29]。
2.3 土壤微生物活性测定
土壤微生物生物量氮(MBN)和微生物生物量碳(MBC)采用氯仿熏蒸浸提法测定[30-33]。
2.4 土壤酶活性测定
土壤酶活性测定参考《土壤酶及其研究法》[32]。硝酸还原酶(nitrate reductase,NiRs)采用苯酚二磺酸比色法测定,纤维素酶(cellulase,CE)和蔗糖酶(sucrase,SUC)采用3,5-二硝基水杨酸比色法测定,过氧化氢酶(catalase,CAT)采用高锰酸钾滴定法测定,土壤磷酸酶(soil phosphatase,PHP)采用磷酸苯二钠比色法测定,亚硝酸还原酶(nitrite reductase,NR)采用微量法测定,土壤蛋白酶(soil protease,PRO)采用茚三酮比色法测定。
2.5 DNA提取与PCR扩增
从根部和土壤中提取总DNA。根样本的16S用799F(5’-AACMGGATTAGATACCCKG-3’)和1193R(5’-ACGTCATCCCCACCTTCC-3’)引物对V5-V7可变区进行PCR扩增,土壤和根际土壤样本的16S用341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTACNNGGGTATCTAAT-3’)引物对V3~V4可变区进行PCR扩增,所有样本的ITS用ITS1-1F-F(5’-CTTGGTCATTTAGAGGAA- GTAA-3’)和ITS1-1F-R(5’-GCTGCGTTCTT- CATCGATGC-3’)引物对ITS1-1F可变区进行PCR扩增。扩增程序为:在98 ℃预变性1 min后,运行30个循环,包括在98 ℃下孵育10 s,50 ℃下孵育30 s,在72 ℃时延长30 s,然后在72 ℃时延长5 min。扩增产物经2%琼脂糖凝胶电泳法纯化回收。
2.6 文库构建与测序
根据Illumina MiSeq平台(Illumina,San Diego,美国)标准操作规程将纯化后的扩增片段构建文库。构建文库步骤如下:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)氢氧化钠变性,产生单链DNA片段。利用Illumina公司的Miseq PE250平台进行测序。运用QIIME2 feature-classifier插件将ASV的代表序列比对到预先训练好的13.8版本99%相似度的GREENGENES数据库(16S rRNA)(根据引物对将数据库分别聚集到V3V4和V4V5的区域)和8.2版本的UNITE数据库(ITS)(根据引物对将数据库分别聚集到ITS1、ITS3的区域),得到了物种的分类信息表[34]。之后用QIIME2 feature-table插件剔除了所有污染性的线粒体和叶绿体序列。
2.7 生物信息学分析
使用Qiime 2.0计算分析到物种的Chao1、Shannon、Simpson和Observed feature指数值,使用ANOVA分析α多样性指数的组间差异。基于R的“Phyloseq”包进行主坐标分析(principal coordinates analysis,PCoA)分析,以可视化不同组之间样本关系。Mantel test基于R的“vegan”包分析土壤养分与物种多样性之间关系。应用中性群落模型来评估细菌和真菌群落的组装过程,中性群落模型用于通过预测微生物群落组装的频率之间的关系来确定随机过程对微生物群落组装的贡献[35]。去除样本发现率低于20%的物种,构建共生网络,选取丰度>10%的模块进行标记,并展示其top10门水平物种丰度,使用R的“vegan”“psych”和“igraph”包完成上述内容。冗余分析(redundancy analysis,RDA)使用深圳微科盟云平台绘制(https://www. bioincloud.tech)。
2.8 统计分析

3 结果与分析
3.1 不同生长年限党参土壤理化性质的变化
对不同生长年限党参土壤和根际土壤的理化性质进行测定和分析(表1),结果显示测得的土壤理化因子中除SOM外,其余理化因子含量在各样本中组间差异显著(<0.05)。不同生长年限的党参根际土壤和土壤中TN含量组间差异显著(=5.293,<0.01),根际土壤中的TN含量逐年增加,而土壤中SF2的TN含量最高。土壤中的TP含量、MC随党参种植年限的增加逐渐提高,而根际土壤中的相应含量与之相反。不同生长年限党参的土壤、根际土壤都呈弱碱性(pH 7.7~8.0)。MBN在一年生党参的土壤和根际土壤中含量最高,而在二年生、三年生党参相应土壤中含量显著降低,且随种植时间的增加,含量逐渐降低。各土壤酶活性,仅NiRs表现出组间显著差异(=2.859,<0.05),随年限增加,NiRs含量分别在土壤、根际土壤中呈先减少后增加趋势。PRO含量在土壤和根际土壤中随时间序列,先增加后减少,且二年生党参的土壤中NiRs含量高于根际土壤。
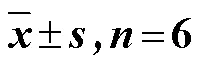
表1 各样品土壤理化因子含量()
同行中数值后面的不同小写字母表示差异显著(<0.05);*<0.05**<0.01***<0.001,下同
Different lowercase letters after the values in the same line indicate significant differences. ANOVA:*< 0.05**< 0.01***< 0.001, same as below
3.2 不同生长年限党参根系微生物群落组成及其多样性
3.2.1 细菌群落组成及其多样性 对不同生长年限党参土壤、根际土壤和根样品进行细菌16S和真菌ITS高通量测序,土壤和根际土壤样品采用同一引物扩增16 S序列,而根样品采用不同引物扩增16S序列,结果显示土壤样本与植物样本细菌注释稍有差异。在质量控制后,18个根样本得到1 446 298个16 S的clean reads,27个土壤和根际土壤样本得到2 240 267个16 S的clean reads,在97%分类水平下进行OTU分类,根内生细菌共获得3287个OTU,分类学地位明确的细菌有25个门,68个纲,105个目,156个科,265个属和150个种;根际土壤细菌共获得20 522个OTU,分类学地位明确的细菌有49个门,140个纲,202个目,238个科,362个属和179个种。不生长年限党参土壤、根际土壤、根内微生物组成差异显著,选择top10属水平物种相对丰度进行优势物种展示。图1结果显示土壤、根际土壤属水平优势细菌为(3.07%),根样本中优势属为(23.64%)。党参生长过程中,土壤和根际土壤样本中的各细菌物种占比处于动态平衡,而根内细菌属的比例逐年减少,的比例逐年增加。
表中展示Shannon、Simpson、Observed features、Chao1 4个α多样性指数(表2)。细菌的Shannon指数显示,不同生长年限党参土壤和根际土壤分别与根样本组间差异显著(<0.001),土壤样本Shannon指数高于根样本。Chao1指数显示土壤和根际土壤中组间差异显著(<0.001),土壤样本的Chao1指数高于根样本。图2-A、B的PCoA显示同年生党参土壤和根际土壤细菌样本聚集在一起,而不同年之间样本分离(Permanova:=2.294,=0.001),解释率为25.77%;不同生长年限党参根细菌样本分离(Permanova:=2.303,=0.001),解释率为33.15%。

A-属水平根系相关微生物群落组成 B-根内细菌组成 C-土壤和根际土壤细菌组成
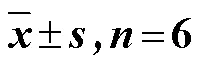
表2 根系微生物α多样性指数()
3.2.2 真菌群落组成及其多样性 测序质量控制后,45个土壤样本和根样本得到3 537 408个ITS的clean reads。在97%分类水平下进行OTU分类,所有样本真菌共获得3287个OTU,分类学地位明确的真菌有20个门,50个纲,113个目,259个科,599个属和916个种。图1-C结果显示土壤、根际土壤和根内属水平优势真菌为(10.66%)、(9.98%)、(7.80%)、(6.64%)和(5.05%)。党参生长过程中,真菌在三年生党参的不同隔室中比例最高,在一年生党参的不同隔室中比例最高。

A-根系微生物β多样性基于Permanova的PCoA B-根内细菌的PCoA C-土壤和根际土壤细菌的PCoA
真菌的Shannon指数显示,不同生长年限党参土壤和根际土壤分别与根样本组间差异显著(<0.001),土壤样本Shannon指数高于根样本。Chao1指数显示不同生长年限党参根内细菌和真菌组间差异不显著,而各样本中细菌的Chao1指数明显高于真菌。图2-C的PCoA显示不同生长年限的党参土壤和根际土壤样本的真菌聚集在一起,根样本聚集在一起(Permanova:=4.448,=0.001),解释率为36.93%。
3.3 不同生长年限的党参根系微生物菌群分布
3.3.1 细菌菌群分布 中性群落模型表明随机过程在土壤和根际土壤细菌群落组装过程中占主导作用。图3-A结果显示中性模型分别解释了一年生、二年生、三年生土壤和根际土壤细菌85%、90.6%、90.2%的群落变化,其中二年生党参土壤细菌扩散能力高于一年生和三年生细菌。随机过程主导了土壤和根际土壤细菌的群落构建,二年生党参随机过程的相对贡献最大。根内细菌受随机过程影响最大(图3-B),中性模型分别解释了一年生、二年生、三年生根内细菌65.4%、79.7%、79%的群落变化,而二年生党参根内细菌扩散能力也高于一年生和三年生细菌。
3.3.2 真菌菌群分布 真菌群落组装的随机性过程的贡献度低于细菌。中性模型分别解释了一年生、二年生、三年生党参根系真菌61.7%、64.3%、66.7%的群落变化,其中三年生党参根系真菌扩散能力高于一年生和二年生真菌。基于生态位宽度的观察,图3-B结果显示土壤细菌和根内细菌的生态位宽度随生长年限的增加而增加,相对于其他2种根际土壤,二年生党参根际土壤细菌的生态位宽度更高。对于真菌而言,土壤和根际土壤生态位宽度变化趋势相同,随生长年限的增加,生态位宽度先增加后减少,这与根际土壤细菌的变化趋势相同。根内真菌的生态位宽度最小。
3.4 不同生长年限党参根系微生物与土壤环境因子的相关性
不同生长年限党参根系微生物的组成和多样性受环境因素驱动,进一步探究强相关性的环境因子的驱动作用,进行如下分析。图4为分别以土壤和根际土壤微生物为一组,根内微生物为一组的物种组成与环境因子的Mantel分析。图4-A结果显示,土壤和根际土壤的细菌物种与SUC、TN、AK、MC、MBN呈显著正相关(<0.05),与CAT呈显著负相关(=0.91),且AK与TN之间有强相关性,真菌与PHP、TN、MC呈显著正相关(<0.05),与NR呈显著负相关(=1.00)。图4-B结果显示,根内细菌物种与NiRs、TN呈显著正相关(<0.05),与CE呈显著负相关(=0.95),真菌与PHP、NiRs、TN、MBC、SOM呈显著正相关(<0.05),与SUC呈显著负相关(=0.95)。
选取属水平优势微生物与环境因子进行RDA,结果如图5所示。图5-A显示RDA1和RDA2共解释该模型的23.63%,TN(=0.007)、AK(=0.001)和WC(=0.001)是影响不同生长年限党参土壤和根际土壤细菌群落结构和多样性的主要影响因素。AK与和呈显著正相关,TN与呈显著正相关。图5-B显示RDA1和RDA2共解释该模型的20.46%,PRO(=0.003)、AK(=0.006)、AP(=0.001)和SOM(=0.001)是影响不同生长年限党参根内细菌群落结构和多样性的主要因素,PRO和AK与呈显著正相关,而AP和SOM与呈显著正相关。图5-C显示RDA1和RDA2共解释该模型的21.92%,TN(=0.033)和TK(=0.011)是影响不同生长年限党参根系真菌群落结构和多样性的主要因素,TN与呈显著正相关,pH与呈显著正相关。

SF-SS-土壤和根际土壤 SR-根内 C1-一年生党参 C2-二年生党参 C3-三年生党参

A-根系相关微生物与环境因子的相关性 B-土壤和根际土壤细菌和真菌多样性与环境因子的Mantel分析
A-根系属水平优势物种与环境因子的RDA B-根内细菌与环境因子的RDA C-土壤和根际土壤优势细菌与环境因子的RDA
3.5 共生网络分析
为进一步探究不同生长年限党参根系相关微生物之间的相互关系,对不同样本绘制共生网络图并进行拓扑结构分析。将节点按照模块化分组并以不同颜色填充,图6显示,细菌网络图共分为9个模块,真菌网络图共分为5个模块,土壤和根际土壤细菌共有155个节点和497条边,根内细菌有78个节点和131条边,真菌共有120个节点和1465条边。表3显示土壤和根际土壤细菌的模块化系数最高,为0.645,真菌的模块化系数最低,为0.165。平均聚类系数最高的是真菌,为0.704,最低的是根内细菌,为0.384。平均加权度最高的是真菌,为16.811,最低的是根内细菌,为2.609。
4 讨论
土壤微生物作为土壤生态系统的重要组成部分,在本研究中,不同生长年限党参土壤和根际土壤pH值呈弱碱性(pH值7.7~8.0),理想党参生长pH值为弱酸性或中性[36],有研究表明,受空间格局和季节变化的影响,甘肃省大多数土壤情况为碱性沉淀[37]。除SOM外,所测土壤理化因子存在组间差异(<0.05),二年生和三年生非根际土壤、根际土壤样本的MBN含量都低于一年生样本,且表现显著差异(<0.05),可能与土壤物种多样性有关,有研究表明高寒草地生态系统中,土壤细菌和真菌多样性与土壤微生物生物量呈负相关[38],微生物生物量和群落组成而非多样性也会影响多年生苜蓿根际土壤的氮含量[39]。SOM含量在不同生长年限党参土壤样本中表现出动态稳定,可能与腐生微生物组成和氮磷肥的施用有关。
A-党参根系微生物的共发生网络 B-土壤和根际土壤细菌的共发生网络 C-根内细菌的共发生网络

表3 共生网络拓扑结构
不同生长年限党参根系优势微生物丰度处于动态变化之中,这种动态变化可能导致代谢物差异和积累。许多内生菌,如、和也有利于药用植物中人参皂苷、倍半萜和生物碱的生成[40]。根部微生物群落变化除微生物间相互作用外,也受植物生长阶段的影响,例如不同豆科植物在种植过程中,根瘤内生菌的富集遵循分级过滤,根瘤内生菌的细菌群落根据植物种类发生变化[41-42]。从土壤向根内圈过渡,物种多样性和丰度减少,随党参生长年限增加,物种多样性和丰度也有减少趋势,有研究表明草莓和马铃薯在种植的不同年根际群落表现出不同[43],这表明党参根系具有一般植物根系微生物的共性。在不同生长的党参根际土壤中,本研究发现了一些植物促进生长的根际细菌(PGPR),例如和[44]。可以产生铁载体和胞外多糖,有助于调节离子平衡、在植物组织中运输水分并抑制病原微生物生长[45],这可能解释了党参生长早期病原菌丰度低的原因。观察不同生长年限党参根系微生物群落组装过程,结果显示群落组装过程受随机性过程影响,二年生党参根系细菌和三年生党参根系真菌受随机性影响更大,在同一种植基地栽培的党参,生长环境相似,随机过程可能会压倒确定性过程[46]。此外,在群落水平对不同生长年限根系生态宽度进行分析,结果表明根内细菌和真菌相比土壤和根际土壤表现出更窄的生态位宽度,有研究表明,具有更广泛生态位宽度的群落受环境因素影响较小[47]。
不同生长年限植物可以保护耕地土壤,减少土壤流失和水分流失[48],也可能导致环境因素驱动微生物群落影响转变。土壤理化因子与党参根系微生物群落结构和多样性显著相关,在本研究中,分析结果显示与TN呈显著正相关,可能是具有促进党参根系吸收氮元素的功能,有研究表明促进植物固氮和增加非生物胁迫耐受性[49]。AK与和呈显著正相关,其作为植物促生菌具有良好的解钾作用[50]。TN与呈显著正相关,由此推测该病原菌会因有机质增加或随土壤中氮含量下降而降低[51-52]。
土壤和根际土壤细菌网络复杂度高于根内细菌,植物的根系分泌物可能改变了根内菌和根际土壤细菌群落的组成。根际真菌群落被认为对植物健康至关重要[53]。在本研究中,病原菌占总体注释物种的29.94%,土壤和根际土壤中含有植物病原菌丰度高于根内,而且属作为引起根腐病的病原菌,在三年生党参中丰度最高,该物种在多种作物包括小麦[54]、菠萝[55]、马铃薯[56]中存在。在植物生长早期的集约化管理农业土壤中,真菌主要定殖于健康的植物根系[57],而在后期阶段,病原体逐渐积累,聚集于根内。排泄物腐生菌在土壤和根际土壤中的含量高于根内,可能与粪肥的施用和腐殖质的含量有关。综上,本研究通过甘肃地区不同生长年限党参根系样本分析,探讨了不同生长年限党参根系土壤的理化性质和根系相关微生态变化,发现了在党参生长过程中,对根系微生物群落结构和多样性具有显著影响的土壤环境因子,为后续深入研究党参病害防治,提高党参品质提供理论基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 周武先, 熊琳珂, 张雅娟, 等. 化感作用对川党参种子萌发及幼苗生长的影响 [J]. 山东农业科学, 2022, 54(11): 76-85.
[2] 李芳, 杨扶德. 党参多糖提取分离、化学组成和药理作用研究进展 [J]. 中华中医药学刊, 2023, 41(4): 42-49.
[3] Bai R B, Li W Y, Li Y D,. Cytotoxicity of two water-soluble polysaccharides fromNannf. var.(Nannf.) L. T. Shen against human hepatocellular carcinoma HepG2 cells and its mechanism [J]., 2018, 120(Pt B): 1544-1550.
[4] 李成义, 刘书斌, 李硕, 等. 甘肃党参栽培现状调查分析 [J]. 中国现代中药, 2016, 18(1): 102-105.
[5] Li Y M, Liu Y, Zhang H,. The composition of root-associated bacteria and fungi ofand their relationship with the bioactive ingredients [J]., 2021, 12: 642730.
[6] 姜茗轩, 张红兵, 李冉, 等. 金银花主要活性成分及内生菌研究进展 [J]. 河北省科学院学报, 2022, 39(5): 7-13.
[7] 丁兆军, 白洋. 根系发育和微生物组研究现状及未来发展趋势 [J]. 中国科学: 生命科学, 2021, 51(10): 1447-1456.
[8] Zheng Q, Hu Y T, Zhang S S,. Soil multifunctionality is affected by the soil environment and by microbial community composition and diversity [J]., 2019, 136: 107521.
[9] 祝蕾, 严辉, 刘培, 等. 药用植物根际微生物对其品质形成的影响及其作用机制的研究进展 [J]. 中草药, 2021, 52(13): 4064-4073.
[10] 王继莲, 李明源, 周茜, 等. 盐胁迫下植物与根际微生物互作研究进展 [J]. 北方园艺, 2021(17): 143-149.
[11] 全鑫, 杨艳艳, 梁娟, 等. 小麦-玉米轮作一体化保护栽培期间土壤微生物群落变化 [J]. 中国农学通报, 2016, 32(12): 132-138.
[12] Li Y Y, Dang H, Lv X,. High-throughput sequencing reveals rhizosphere fungal community composition and diversity at different growth stages ofin the lower reaches of the Tarim River [J]., 10: e13552.
[13] 冼康华, 苏江, 付传明, 等. 不同生长年限华重楼根际土壤微生物多样性研究 [J]. 广西植物, 2022, 42(12): 2087-2098.
[14] 李勇, 应益昕, 赵东岳, 等. 人参及西洋参栽培土壤微生物种群遗传多样性的RAPD分析 [J]. 中草药, 2010, 41(11): 1871-1875.
[15] Li X G, Ding C F, Zhang T L,. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing [J]., 2014, 72: 11-18.
[16] 刘诗蓉, 王红兰, 孙辉, 等. 半夏连作对根际土壤微生物群落的影响研究 [J]. 中草药, 2022, 53(4): 1148-1155.
[17] 吴清莹, 林宇龙, 孙一航, 等. 根系分泌物对植物生长和土壤养分吸收的影响研究进展 [J]. 中国草地学报, 2021, 43(11): 97-104.
[18] 李敏, 赵熙州, 王好运, 等. 干旱胁迫及外生菌根菌对马尾松幼苗根系形态及分泌物的影响 [J]. 林业科学, 2022, 58(7): 63-72.
[19] 李月明, 杨帆, 韩沛霖, 等. 植物根系分泌物响应非生物胁迫机理研究进展 [J]. 应用与环境生物学报, 2022, 28(5): 1384-1392.
[20] Hobson D J, Harty M A, Langton D,. The establishment of winter wheat root system architecture in field soils: The effect of soil type on root development in a temperate climate [J]., 2023, 39(1): 198-208.
[21] Langenfeld A, Prado S, Nay B,. Geographic locality greatly influences fungal endophyte communities in[J]., 2013, 117(2): 124-136.
[22] Zhou Y, Coventry D R, Gupta V V S R,. The preceding root system drives the composition and function of the rhizosphere microbiome [J]., 2020, 21(1): 89.
[23] 杨阳, 李海亮, 马凯丽, 等. 连作对党参根际土壤理化性质、微生物活性及群落特征的影响 [J]. 环境科学, 2023: 1-15.
[24] 杨姗姗, 仲彩萍, 王仪, 等. 草甘膦对党参生长根腐病及根际土壤微生物的影响 [J]. 中国现代中药, 2022, 24(10): 1932-1938.
[25] Dong Y M, Gao M L, Qiu W W,. Effect of microplastics and arsenic on nutrients and microorganisms in rice rhizosphere soil [J]., 2021, 211: 111899.
[26] 鲍士旦. 土壤农化分析 [M]. 第3版. 北京: 中国农业出版社, 2000: 26.
[27] Bremner J M, Mulvaney C S.[M] Madison: Agronomy Monographs, 2015: 595-624.
[28] Olsen B S R.[M]. Washington D C: U.S. Dept. of Agriculture, 1954: 23.
[29] Lu R.[M]. Beijing: China Agricultural Science and Technology Press, 1999, 107: 147-68.
[30] Jenkinson D S, Powlson D S. The effects of biocidal treatments on metabolism in soil—V [J]., 1976, 8(3): 209-213.
[31] Brookes P C, Landman A, Pruden G,. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil [J]., 1985, 17(6): 837-842.
[32] 关松荫. 土壤酶及其研究法 [M]. 北京: 农业出版社, 1986: 56.
[33] Gil-Sotres F, Trasar-Cepeda C, Leirós M C,. Different approaches to evaluating soil quality using biochemical properties [J]., 2005, 37(5): 877-887.
[34] Bokulich N A, Kaehler B D, Rideout J R,. Optimizing taxonomic classification of marker-gene amplicon sequences with QIIME 2’S q2-feature-classifier plugin [J]., 2018, 6(1): 90.
[35] Sloan W T, Lunn M, Woodcock S,. Quantifying the roles of immigration and chance in shaping prokaryote community structure [J]., 2006, 8(4): 732-740.
[36] Moon K G, Um I S, Jeon S H,. Effect of organic fertilizer application on growth characteristics and saponin content in[J]., 2018, 59(1): 125-130.
[37] Zhang F X. Spatial pattern and seasonal variation of alkaline precipitation observed in the Gansu Province, NW China [J]., 2019, 78(14): 1-11.
[38] Zhang Y, Dong S K, Gao Q Z,. Soil bacterial and fungal diversity differently correlated with soil biochemistry in alpine grassland ecosystems in response to environmental changes [J]., 2017, 7: 43077.
[39] 孙建波, 畅文军, 李文彬, 等. 香蕉不同生育期根际微生物生物量及土壤酶活的变化研究 [J]. 生态环境学报, 2022, 31(6): 1169-1174.
[40] Dong L L, Li Y, Xu J,. Biofertilizers regulate the soil microbial community and enhanceyields [J]., 2019, 14: 20.
[41] Xiao X A, Chen W M, Zong L,. Two cultivated legume plants reveal the enrichment process of the microbiome in the rhizocompartments [J]., 2017, 26(6): 1641-1651.
[42] Wang P P, Yang L F, Sun J L,. Structure and function of rhizosphere soil and root endophytic microbial communities associated with root rot of[J]., 2022, 12: 752683.
[43] Murphy C, Foster B, Gao C L. Temporal dynamics in rhizosphere bacterial communities of three perennial grassland species [J]., 2016, 6(1): 17.
[44] Backer R, Rokem J S, Ilangumaran G,. Plant growth-promoting rhizobacteria: Context, mechanisms of action, and roadmap to commercialization of biostimulants for sustainable agriculture [J]., 2018, 9: 1473.
[45] Bhandari P, Garg N. Plant-microbe communication: New facets for sustainable agriculture [A] // Singh D, Gupta V, Prabha R.[M]. Singapore: Springer, 2019: 547-573.
[46] Wang J J, Shen J, Wu Y C,. Phylogenetic beta diversity in bacterial assemblages across ecosystems: Deterministic versus stochastic processes [J]., 2013, 7(7): 1310-1321.
[47] Jiao S, Yang Y F, Xu Y Q,. Balance between community assembly processes mediates species coexistence in agricultural soil microbiomes across Eastern China [J]., 2020, 14(1): 202-216.
[48] Salah A M A, Prasse R, Marschner B. Intercropping with native perennial plants protects soil of arable fields in semi-arid lands [J]., 2016, 130: 1-13.
[49] Zboralski A, Filion M. Genetic factors involved in rhizosphere colonization by phytobeneficialspp. [J]., 2020, 18: 3539-3554.
[50] 黄涛. 玉米根际促生细菌的筛选及其促生机理初步研究 [D]. 沈阳: 沈阳农业大学, 2019.
[51] 曾广娟, 冯阳, 吴舒, 等. 基于高通量测序的有机种植蔬菜地土壤微生物多样性分析 [J]. 南方农业学报, 2022, 53(9): 2403-2414.
[52] Li H Y, Qiu Y Z, Yao T,. Nutrients available in the soil regulate the changes of soil microbial community alongside degradation of alpine meadows in the northeast of the Qinghai-Tibet Plateau [J]., 2021, 792: 148363.
[53] 任氢欣, 曾齐, 张必弦, 等. 基于高通量测序的大豆根际真菌群落动态变化分析 [J]. 分子植物育种, 2021, 19(14): 4836-4845.
[54] 李燕, 张玉凤, 林海涛, 等. 木醋液对小麦根腐病致病菌及小麦发芽的影响 [J]. 山东农业科学, 2017, 49(4): 96-99.
[55] Ibrahim N F, Mohd M H, Mohamed Nor N M I,. Characterization ofspp. associated with pineapple fruit rot and leaf spot in[J]., 2017, 165(11/12): 718-726.
[56] 姚凡, 王喜刚, 郭成瑾, 等. 绳状青霉P-19不同固体发酵浸提液对马铃薯镰刀菌根腐病病原菌的抑制作用 [J]. 植物保护, 2022, 48(6): 368-373.
[57] Loit K, Soonvald L, Astover A,. Temporal and cultivar-specific effects on potato root and soil fungal diversity [J]., 2020, 10(10): 153.
Root microbial community structure and diversity ofin different growth years
MENG Tong-tong1, 3, CUI Xing-shuai2, ZHU Ning2, LENG Fei-fan2, WANG Yong-gang2, CHEN Ji-xiang1, 2
1. College of Energy and Power Engineering, Lanzhou University of Technology, Lanzhou 730050, China 2. School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China 3. Gansu Water Conservancy Research Institute, Lanzhou 730050, China
To explore the changes of root microbial community structure of Dangshen [(Franch.) Nannf.] in different growth years and its correlation with soil environmental factors in order to improve the quality of.The soil, rhizosphere soil and roots ofin the first, second and third years were analyzed by high-throughput sequencing and bioinformatics.With the increase of growth years of, theof dominant bacteria in soil and rhizosphere soil was in dynamic balance, while the abundance of bacterialin root was decreased. The abundance of fungalin soil and rhizosphere soil decreased year by year, while the abundance of pathogenic fungusinroot increased year by year. The microbial community assembly ofroots with different growth years is more affected by random processes, and the functional stability of root bacteria is higher than that of fungi. Protease, total nitrogen, available potassium, water content, available phosphorus and soil organic matter are the main factors affecting the bacterial community structure and diversity ofroots in different growth years. Total nitrogen and total potassium are main factors affecting the structure and diversity of fungal community.The composition and diversity of root microbial community ofchanged with the growth years, and responded to different soil environmental factors, which provided a theoretical basis for the later in-depth study ofdisease control and improving its quality.
(Franch.) Nannf.; high-throughput sequencing; environmental factors; root system; microbial diversity
R286.12
A
0253 - 2670(2023)15 - 4992 - 11
10.7501/j.issn.0253-2670.2023.15.024
2022-12-03
国家自然科学基金资助项目(32160066);甘肃省自然科学基金项目(20JR5RA475);兰州理工大学青年人才支持计划项目(2018)
孟彤彤,男,博士研究生,研究方向为水资源利用与环境工程。E-mail: 61734210@qq.com
通信作者:陈吉祥,博士,教授,博士研究生导师,主要从事环境工程研究。E-mail: chenjixiang@lut.edu.cn
王永刚,博士,副教授,硕士研究生导师,主要从事微生态效应对药用植物生长及代谢物研究。E-mail: wangyg@lut.edu.cn
[责任编辑 时圣明]
