基于UHPLC-Q-Orbitrap HRMS分析覆盆子不同部位的化学成分及其9种成分含量的快速测定
2023-08-03黄思红刘依茹李靖蕾陈昌伦刘考铧秦路平李荣胜吴建军
沈 瑶,黄思红,刘依茹,李靖蕾,陈昌伦,刘考铧,刘 伟,秦路平,李荣胜*,吴建军*
基于UHPLC-Q-Orbitrap HRMS分析覆盆子不同部位的化学成分及其9种成分含量的快速测定
沈 瑶1,黄思红2,刘依茹1,李靖蕾1,陈昌伦1,刘考铧1,刘 伟3,秦路平1,李荣胜3*,吴建军1*
1. 浙江中医药大学药学院,浙江 杭州 310053 2. 上海中医药大学附属曙光医院宝山分院 儿科,上海 201900 3.上海中医药大学附属曙光医院肝病研究所,肝肾疾病病证教育部重点实验室,上海市中医临床重点实验室,上海 201203
采用UHPLC-Q-Exactive Orbitrap HRMS法对覆盆子不同部位(小核果和花托)化学成分进行分析鉴定,并建立快速测定覆盆子中9种成分含量的方法。采用Acquity UPLC HSS T3(100 mm×2.1 mm,1.8 µm)色谱柱,以0.1%甲酸水与乙腈为流动相,梯度洗脱;覆盆子化学成分鉴定时采用正负离子Full MS/dd-MS2模式,通过化合物的一级、二级质谱信息,结合对照品比对确认,进行覆盆子不同部位主要化学成分的快速、精准识别。采用ACQUITY BEH C18(50 mm×2.1 mm,1.7 µm)色谱柱在负离子Full MS/SIM模式,建立快速测定覆盆子不同部位中9种成分(没食子酸、芦丁、鞣花酸、金丝桃苷、山柰酚-3--芸香糖苷、紫云英苷、椴树苷、槲皮素和山柰酚)含量的UHPLC-Q-Exactive Orbitrap HRMS方法,并测定其含量。从覆盆子小核果和花托中共鉴定122种化学成分,包括黄酮类66种、有机酸类28种、萜类24种、其他类4种。成功建立一种6 min完成覆盆子中9种成分含量测定的方法,各成分在其线性范围内线性关系良好;精密度、重复性及稳定性良好(RSD≤6.30%);加样回收率在99.45%~105.30%(RSD≤4.43%),并发现小核果中芦丁的含量显著高于花托;而花托中的鞣花酸、山柰酚-3--芸香糖苷和椴树苷的含量显著高于小核果。覆盆子小核果和花托部位的化学成分存在差异性,运用UHPLC-Q-Exactive Orbitrap HRMS建立的定量方法分析时间短、灵敏度高、准确性好,方法学考察结果均符合含量测定的要求,可用于覆盆子中9种成分的快速测定。
覆盆子;小核果;花托;超高效液相色谱-四极杆/静电场轨道阱高分辨质谱;没食子酸;芦丁;鞣花酸;金丝桃苷;山柰酚-3--芸香糖苷;紫云英苷;椴树苷;槲皮素;山柰酚
覆盆子为蔷薇科悬钩子属植物华东覆盆子Hu.的干燥果实,具有益肾固精缩尿、养肝明目的功效[1],应用历史悠久[2]。覆盆子在我国浙江、福建、江苏等地区有广泛分布,于2002年被中华人民共和国卫生部认定为既是食品又是中药材的两用品种,兼具药食两用性,具备极高的研究和开发价值。覆盆子为聚合果,由多数小核果聚合而成,其构造可分为小核果和花托2部分(图1)。现代研究表明,覆盆子中主要含黄酮类、有机酸类、萜类、甾体及多糖类等成分[3-7],然而,至今尚未发现对覆盆子不同部位的化学成分进行分析的研究报道,导致其不同部位的化学成分及其含量的差异尚不明确。目前《中国药典》2020年版以鞣花酸和山柰酚- 3--芸香糖苷作为含量测定项[1],已有文献报道[8-9]通过HPLC法在254、315、344 nm波长切换下测定了覆盆子中7种成分的含量和在360 nm下测定6种成分的含量,采集时间约60 min。本研究利用高分辨质谱的优势特点,一级质谱精确定量保证稳定性和准确度的同时,简化了操作处理流程,节省分析时间;首次对覆盆子不同部位(小核果和花托)化学成分进行分析鉴定,并采用UHPLC-Q-Exactive-Orbitrap HRMS对小核果和花托中没食子酸、芦丁、鞣花酸、金丝桃苷、山柰酚-3--芸香糖苷、紫云英苷、椴树苷、槲皮素和山柰酚共9种成分进行测定,以期为覆盆子不同部位的合理利用及质量评价提供参考依据。

图1 覆盆子构造图
1 仪器与试药
1.1 仪器
Dionex Ultimate 3000高压液相色谱、Q Exactive四极杆/静电场轨道阱高分辨质谱仪(Thermo Fisher Co.,美国)、Sartorius BP211D电子分析天平(北京赛多利斯科学仪器有限公司)、微量移液器(Eppendorf,美国)、高速离心机(Eppendorf,德国)、HH-4型数码恒温水浴锅(国华仪器制造有限公司)。
1.2 试药与试剂
10批次覆盆子中药材(批号S220501~S220510)购自瑞辉中药材有限公司,产地杭州千岛湖,经过浙江中医药大学药学院秦路平教授鉴定为蔷薇科植物华东覆盆子Hu.的干燥果实。
对照品水杨酸(批号AF21052253)购自成都埃法生物科技有限公司;没食子酸(批号D0409AS)、槲皮素(批号0821AS)、紫云英苷(批号MB7087)、阿魏酸(批号M1102AS)、金丝桃苷(批号00807AS)、橙皮苷(批号A1006AS)、柚皮苷(批号J1110AS)、奎宁酸(批号MB6731)、芦丁(批号J0509AS)购自大连美仑生物技术有限公司;新绿原酸(批号15020503)、咖啡酸(批号190425)、绿原酸(批号15020601)、异绿原酸A(批号15030201)、异绿原酸B(批号15030202)、异绿原酸C(批号15030203)、隐绿原酸(批号15020603)购自上海融禾医药科技发展有限公司;儿茶素(批号PRF21062821)、原儿茶醛(批号PRF10041021)、鞣花酸(批号PRF21030521)、山柰酚-3--芸香糖苷(批号PRF20071321)、银椴苷(批号PRF21031542)、木犀草素(批号BP0899)、木犀草苷(批号BP0899)、刺芒柄花素(批号BP0592)、异槲皮苷(批号PRF10032142)、原儿茶酸(批号PRF10061151)均购自成都普瑞法科技开发有限公司;以上对照品质量分数均大于98%。色谱纯甲醇与乙腈购自美国赛默飞科技有限公司。色谱纯甲酸购自美国天地股份有限公司。分析纯无水乙醇购自中国杭州悦耳科技有限公司。超纯水通过Milli-Q Academic System制备获得。
2 方法与结果
2.2 覆盆子中化学成分鉴定
2.2.1 色谱条件 使用Acquity UPLC HSS T3(100 mm×2.1 mm,1.8 µm)色谱柱,流动相0.1%甲酸水与乙腈,梯度洗脱:0~1 min,2%乙腈;1~10 min,2%~48%乙腈;10~11 min,48%乙腈;11~12 min,48%~95%乙腈;12~14 min,95%乙腈;14~45 min,2%乙腈;柱温40 ℃;体积流量0.3 mL/min;进样量3 µL。
2.2.2 质谱条件 采用Q Exactive四极杆/静电场轨道阱高分辨质谱仪(H-ESI)作为分析检测的仪器,电喷雾离子源(ESI),正、负离子Full MS/dd-MS2模式全扫描。正离子模式参数:扫描范围(/100~1500);分辨率70 000;喷雾电压3.5 kV;毛细管温度320 ℃;辅助加热器温度300 ℃;鞘气(N2)流量35 arb;辅助气(N2)流量13 arb;自动增益控制(AGC)106;s-lens 射频水平50。负离子模式参数:扫描范围(/100~1500);分辨率70 000;喷雾电压3.2 kV;毛细管温度320 ℃;辅助加热器温度300 ℃;鞘气(N2)流量35 arb;辅助气(N2)流量10 arb;自动增益控制(AGC)106;s-lens 射频水平50。
2.2.3 对照品溶液的制备 取各对照品适量,精密称定,分别溶于20%甲醇中,配成质量浓度为1.0 mg/mL的混合对照品储备液,待用。所有对照品溶液均在4 ℃条件下贮藏,用于化学成分鉴定用。
2.2.4 供试品溶液的制备 将批号S220503覆盆子整果分离为小核果和花托,粉碎,过60目筛。分别精密称取供试品(覆盆子小核果、花托)粉末1.0 g,加60%乙醇50 mL,称定质量,加热回流60 min,放冷,再称定质量,用60%乙醇补足减失的质量,摇匀,放置,取上清液滤过,取续滤液1 mL超纯水稀释至10 mL,在12 000×、4 ℃条件下离心10 min,待用。
2.2.5 鉴定结果 按照“2.2.1”及“2.2.2”项下色谱、质谱条件进样,根据高分辨质谱提供的准分子离子和加荷离子等信息推测并得到一级质谱的精确相对分子质量,经Xcalibar 3.0软件拟合分子式。对在高分辨质谱下获取的各成分推测,再通过与对照品、文献、Mass Bank等数据库及碎片离子信息,进一步对覆盆子所含化学成分进行定性分析。从覆盆子中鉴定出122种化学成分,包括黄酮类66种、有机酸类28种、萜类24种、其他类4种成分,其中27种化学成分通过对照品比对确认,44个化合物与文献报道一致,其他化合物根据数据库一级、二级碎片比对获得。覆盆子整果、小核果及花托提取液正负离子模式下的总离子流图见图2,结果见表1。
2.2.6 化合物结构鉴定及质谱特征
(1)黄酮类成分:从覆盆子中鉴定的黄酮类成分多达66种,见表1。黄酮类化合物大多以A-C-B3个环状结构连接,其A环7位和C环3位连接的--糖苷键容易断裂产生[M-H2O]−、[M-H-rha]−、[M-H-glc]−、[M-H-rutinose]−等碎片,C环C--C键断裂或发生重排。在MS条件下,在负离子模式下有较好的响应。以《中国药典》控制成分山柰酚-3--芸香糖苷和椴树苷为例,一级质谱得到山柰酚-3--芸香糖苷/593.151 9 [M-H]−准分子离子峰,化学式为C27H30O15,在二级质谱下失去-C12H20O9碎片得到/284.032 8 [M-H-C15H10O6]−离子碎片,该碎片进一步失去-CH2O碎片得到/255.029 8 [M-H-C14H8O5]−,该碎片失去-CO碎片最终得到/227.034 4 [M-H-C13H6O4]−离子碎片。从裂解获得的一级、二级质谱离子碎片/值分析,化合物裂解途径符合黄酮类的裂解规律,与文献报道裂解途径相似[15],通过对照品比对确定化合物为山柰酚-3--芸香糖苷,相应质谱裂解途径见图3。椴树苷/593.130 6 [M-H]−准分子离子峰,化学式为C30H26O13。在二级质谱下失去-C15H16O7碎片得到/285.040 5 [M-H-C15H10O6]−碎片,该碎片进一步裂解得到/255.029 7 [M-H-C14H8O5]−,最终得到/227.029 7 [M-H-C7H2O3]−离子碎片。从裂解获得的一级、二级质谱离子碎片/值分析,化合物裂解途径符合黄酮类的裂解规律,与对照品一致,通过对照品比对确定化合物为椴树苷,相应质谱裂解途径见图3。

图2 覆盆子整果(A) 及其不同部位(B:小核果;C:花托) 提取液的总离子流图

表1 覆盆子不同部位(小核果和花托)的化学成分鉴定

续表1

续表1

续表1

续表1
续表1
*经对照品指认;+表示测出 −表示未测出
*Confirmed with reference substance; +detected −not detected
(2)有机酸类成分:研究表明有机酸是植物中共有成分,且大多有生物活性。本次建立的分析方法从覆盆子中共鉴定出28个有机酸类成分,见表1。此类化合物在负离子模式下有较好的响应,因含有-COOH官能团,一般容易断裂产生[M-H-H2O]−、[M-H-CO2]−、[M-H-CO]−等小分子基团。以没食子酸和鞣花酸的裂解规律为例,一级质谱得到没食子酸/169.013 1 [M-H]−准分子离子峰,化学式为C7H6O5,在高能H-ESI质谱离子源碰撞离子作用下获得主要二级碎片离子信息为/150.969 4 [M-H-H2O]−、/97.028 0 [M-H-2CO2-O]−和/125.023 0 [M-H-CO2]−3个离子碎片。鞣花酸一级质谱得到/300.998 9 [M-H]−准分子离子峰,化学式为C14H6O8,二级质谱获得/283.994 0 [M-H-H2O]−和/257.008 8 [M-H-CO2]−离子碎片。从裂解获得的一级、二级质谱离子碎片/值分析,没食子酸和鞣花酸化合物裂解途径符合有机酸的裂解规律,与文献报道裂解途径相似[16],同时通过对照品的一级、二级质谱裂解碎片和提取离子峰位置、相对保留时间比对,最终确定化合物分别为没食子酸和鞣花酸,相应质谱裂解途径见图4。

图3 山柰酚-3-O-芸香糖苷与椴树苷的质谱棒状图 (A、B) 和裂解途径(C、D)
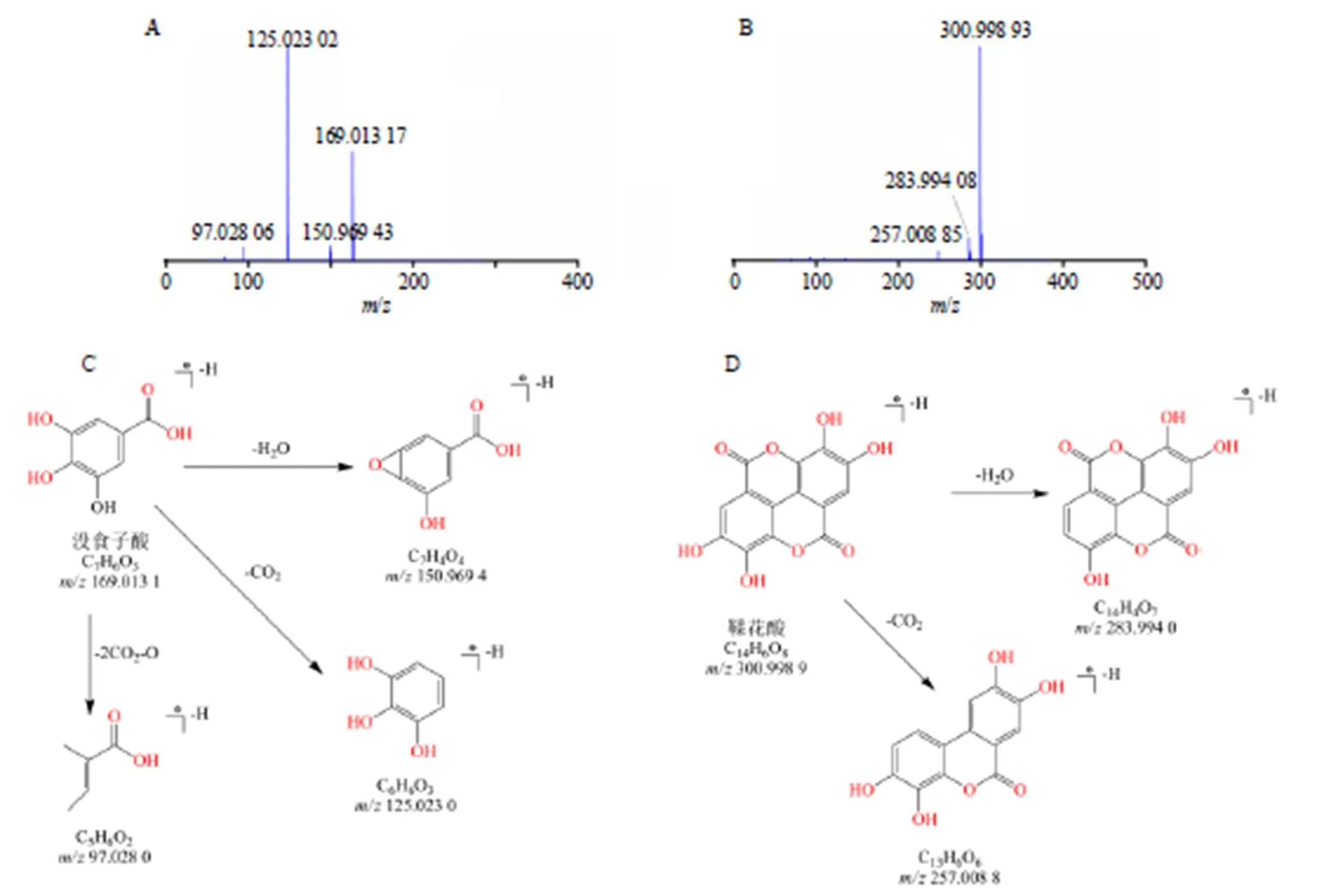
图4 没食子酸与鞣花酸的质谱棒状图(A、B) 和裂解途径(C、D)
(3)萜类成分:从覆盆子中鉴定的萜类成分24种,见表1。萜类化合物是以异戊二烯结构单元为基本骨架的烃类及其其含氧衍生物,以5个碳为基本单位,按单位数量分为单萜、二萜、三萜等。此类化合物一般在[M+H]+、[M+Na]+、[M-H]−、[M+COOH]−等多种模式下均有响应,通常容易发生糖苷键断裂,丢失[M-H2O]−、[M-CO2]−、[M-Rha]−、[M-Glc]−、[M-Rutinose]−等碎片。以覆盆子酸为例,该化合物在正离子模式下响应较好,一级质谱得到覆盆子酸/485.328 4 [M+H]+准分子离子峰,化学式为C30H44O5,在二级质谱条件下获得失去1分子H2O,得到/467.312 7 [M+H-H2O]+,该碎片进一步裂解失去1分子-CO得到/439.319 6 [M+H-CO]+碎片,覆盆子酸的裂解途径与数据库萜类化合物的裂解规律相符合。
(4)其他类成分:从覆盆子中鉴定出的其他类成分4种,分别位香草醛、白藜芦醇和stellarin-2、根皮酸。
2.3 覆盆子中9种成分定量测定
2.3.1 色谱条件 使用Acquity UPLC BEH C18(50 mm×2.1 mm,1.7 µm)色谱柱,流动相为0.1%甲酸水与乙腈,梯度洗脱:0~0.6 min,5%乙腈;0.6~1.0 min,5%~25%乙腈;1.0~3.5 min,25%~48%乙腈;3.5~4.0 min,48%~95%乙腈;4.0~5.0 min,95%乙腈;5.01~6.0 min,5%乙腈;柱温40 ℃;体积流量0.3 mL/min;进样量3 µL。
2.3.2 质谱条件 参数为负离子Full MS/SIM模式全扫描,分辨率70 000;喷雾电压3.2 kV;毛细管温度320 ℃;辅助加热器温度300 ℃;鞘气(N2)流量35 arb;辅助气(N2)流量10 arb;自动增益控制(AGC)106;s-lens射频水平50。扫描范围(/100~1500);碰撞能梯度为10、20、40 eV。
2.3.3 对照品溶液的制备 精密称取各对照品没食子酸10.9 mg、芦丁14.7 mg、鞣花酸13.3 mg、金丝桃苷11.8 mg、山柰酚-3--芸香糖苷11.4 mg、紫云英苷12.5 mg、椴树苷11.3 mg、槲皮素12.5 mg、山柰酚20.0 mg,柳氨酚(内标)10.0 mg于10 mL量瓶中,加入甲醇定容,分别配制成没食子酸1.09 mg/mL、芦丁1.47 mg/mL、鞣花酸1.33 mg/mL、金丝桃苷1.18 mg/mL、山柰酚-3--芸香糖苷1.14 mg/mL、紫云英苷1.25 mg/mL、椴树苷1.13 mg/mL、槲皮素1.25 mg/mL、山柰酚2.00 mg/mL、柳氨酚1.00 mg/mL的单一对照品储备液。
2.3.4 供试品溶液的制备 将不同批号覆盆子整果分离为小核果和花托,粉碎,过60目筛。分别精密称取供试品(覆盆子小核果、花托)粉末1.0 g,加60%乙醇50 mL,称定质量,加热回流60 min,放冷,再称定质量,用60%乙醇补足减失的质量,摇匀,放置,取上清液滤过,取续滤液1 mL超纯水稀释至10 mL(含柳氨酚质量浓度50 ng/mL)12 000×g、4 ℃离心10 min,备用。
2.3.5 线性关系考察 分别精密量取混合对照品储备液适量,用柳氨酚内标质量浓度为50 ng/mL的20%甲醇稀释并定容,因鞣花酸相对含量较高,为了保证被测样品含量符合线性范围,故鞣花酸对照品溶液依次配制成54.47、136.19、340.48、851.20、2 128.00、5 320.00、13 300.00 ng/mL的梯度溶液;其他8种对照品溶液依次配制成3.20、8.19、20.48、51.20、128.00、320.00、800.00 ng/mL的梯度溶液。在“2.3.1”及“2.3.2”项所述色谱质谱条件进样分析,记录峰面积。采用Xcalibur软件对结果数据处理,以各待测物的质量浓度为横坐标(),待测物峰和内标峰面积比值为纵坐标()绘制标准曲线,得线性回归方程、相关系数()及线性范围。线性关系考察结果发现9种成分(没食子酸、芦丁、鞣花酸、金丝桃苷、山柰酚-3--芸香糖苷、紫云英苷、椴树苷、槲皮素和山柰酚)在质量浓度范围内线性关系良好,鞣花酸线性范围为54.47~13 300.00 ng/mL,其他成分线性范围均在3.26~800.00 ng/mL,线性回归方程、见表2。
2.3.6 精密度考察 配制没食子酸、芦丁、鞣花酸、金丝桃苷、山柰酚-3--芸香糖苷、紫云英苷、椴树苷、槲皮素和山柰酚的质量浓度分别为3.39、8.43、8.17、3.48、3.36、3.26、3.33、3.28、3.28 ng/mL含用柳氨酚内标质量浓度为50 ng/mL的混合对照品溶液,按“2.3.1”及“2.3.2”项所述条件,连续进样6次,记录色谱图,以对照品和内标物峰面积的比值计算9种成分的RSD,同1 d内连续进样6次来计算日内精密度,连续3 d,每天进样6次来计算日间精密度,结果见表3,表明该方法精密度良好。
2.3.7 重复性考察 按照“2.3.4”项方法平行制备的6份覆盆子供试液,分别进样测定并计算各成分质量分数的RSD值。结果见表3,表明该方法重复性良好。

表2 各对照品线性关系
2.3.8 稳定性考察 取3份按照“2.3.4”项方法制备的覆盆子提取液,放置于室温(25±2)℃,分别于0、4、8、12、24 h进样分析,计算9种成分质量分数的RSD值。结果见表3,表明该供试品溶液24 h内稳定。
2.3.9 加样回收率 按照“2.3.4”项方法平行制备9份覆盆子提取液,每3份为1组,根据各成分在样品中量,加入配制好的含9种成分对照品的混合溶液适量,使加入后各成分的量分别为覆盆子提取液中相应成分量的约50%、100%、150%。计算各待测物的平均回收率及RSD值,加样回收率的考察结果见表3,在建立的方法下9种成分和内标柳胺酚在空白对照溶剂、混合对照品溶液和覆盆子小核果、花托提取液的提取离子流图见图5。
2.4 样品含量检测与结果
取收集的覆盆子样品,按照“2.3”项下方法制备各批小核果和花托供试品溶液,在“2.1”及“2.2”项下色谱质谱条件进样分析,计算食子酸、芦丁、鞣花酸、金丝桃苷、山柰酚-3--芸香糖苷、紫云英苷、椴树苷、槲皮素和山柰酚苷在各样品中的含量。实验结果见表4,发现不同批次样品的含量存在一定差异,10批次样品小核果中没食子酸0.006~0.023 mg/g、芦丁0.05~0.20 mg/g、鞣花酸1.06~4.48 mg/g、金丝桃苷0.005~0.078 mg/g、山柰酚- 3--芸香糖苷0.15~0.41 mg/g、紫云英苷0.05~0.17 mg/g、椴树苷0.04~0.40 mg/g、槲皮素0.001 6~0.011 6 mg/g、山柰酚0.003 2~0.009 1 mg/g;花托中没食子酸0.013~0.024 mg/g、芦丁0.01~0.09 mg/g、鞣花酸2.97~5.69 mg/g、金丝桃苷0.004~0.056 mg/g、山柰酚-3--芸香糖苷0.21~0.62 mg/g、紫云英苷0.06~0.21 mg/g、椴树苷0.17~0.43 mg/g、槲皮素0.001 6~0.007 5 mg/g、山柰酚0.000 3~0.011 5 mg/g。

表3 9种成分的精密度、重复性、稳定性和回收率

A-空白溶剂对照 B-混合对照品溶液 C-覆盆子小核果提取液 D-覆盆子花托提取液;1-没食子酸 2-芦丁 3-鞣花酸 4-金丝桃苷 5-山柰酚-3-O-芸香糖苷 6-紫云英苷 7-椴树苷 8-槲皮素 9-山柰酚 IS-柳胺酚
统计结果显示,小核果中芦丁的含量显著性高于花托 [(0.111±0.042)mg/g(0.045±0.028)mg/g,<0.01],而花托中鞣花酸[(4.653±0.916)mg/g(2.890±1.232)mg/g,<0.01]、山柰酚-3--芸香糖苷 [(0.423±0.124)mg/g(0.302±0.095)mg/g,<0.05)]、椴树苷 [(0.318±0.087)mg/g(0.162±0.125)mg/g,<0.01)]的含量显著性高于小核果,其他成分在小核果和花托中的含量分布无显著性差异。

表4 不同批次、不同部位覆盆子中9种成分含量
检验,与小核果比较:#< 0.05##< 0.01
test,#< 0.05##< 0.01drupelet group
3 讨论
覆盆子为聚合果,其构造可分为小核果和花托两部分。迄今为止,所有关于覆盆子的化学及药理方面的研究报道以及临床应用都是局限于覆盆子整果,导致覆盆子不同部位的化学成分及其含量的差异尚不明确,本研究首次将覆盆子分为小核果和花托2个部分,对其化学成分及含量差异进行分析。近年来UHPLC-Q-Extactive Orbitrap HRMS联用技术,因其具有高分辨力、强分离能力、高灵敏度、稳定性好等特点,已较广泛应用于中药或复杂基质中待测成分的筛选、鉴定及定量分析[17-20]。本研究采用HRMS技术,首先基于化合物的一级、二级质谱信息,结合对照品比对确认等方法,从覆盆子小核果和花托中快速推测鉴定出122种化学成分,包括黄酮类66种,有机酸类28种,萜类24种,其他类4种。其中枸橼酸(2)、刺芒柄花素(57)、野鸢尾黄素(89)、3,4-二羟基-7,5-二甲氧基黄酮(90)为小核果特有成分;白杨素-6--α--阿拉伯糖- 8--β--葡萄糖苷(72)、佛来心苷(88)、白杨素- 6--β--葡萄糖-8--α--阿拉伯糖苷(92)和川陈皮素(103)为花托成分,其余成分皆为共有成分。
另外,《中国药典》2020年版以鞣花酸和山柰酚-3--芸香糖苷作为覆盆子的含量测定项,针对中药多成分、多靶点的特点,若能实现其多成分的定性及定量分析,从而可以从整体上更好地进行覆盆子质量评价,本研究利用HRMS高分辨的功能特点,采用一级质谱精确定量方法建立了快速测定覆盆子中包括药典含量测定项在内的9种成分(没食子酸、芦丁、鞣花酸、金丝桃苷、山柰酚-3--芸香糖苷、紫云英苷、椴树苷、槲皮素和山柰酚)含量的方法,并发现了小核果中芦丁(<0.01)的含量显著性高于花托,而花托中鞣花酸(<0.01),山柰酚-3--芸香糖苷(<0.05),椴树苷(<0.01)的含量显著性高于小核果,其他成分在小核果和花托中的含量分布虽有差别,但无显著性差异,提示了按照现行标准,花托部位对覆盆子整果的质量达标发挥重要作用。该方法在保证极高的稳定性和准确度的同时简化了操作处理流程,节省了分析时间(单个样品分析时间为6 min),为覆盆子的鉴别和质量评价提供了参考,有一定推广应用前景。
覆盆子作为药食同源品种,同时作为新“浙八味”培育品种,在我国拥有特定的资源优势,本研究结果发现覆盆子小核果和花托的化学成分及其含量存在差异性,不同的化学成分将导致功效的差异性,根据中药加工精深化的趋势,如何有效使用覆盆子的不同部位,合理确定其具体应用范围,使覆盆子的利用效益达到最大化,将是今后研究的方向。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 399-400.
[2] 柯创, 张婷婷, 刘考铧, 等. 覆盆子的基原植物考证 [J]. 浙江中医药大学学报, 2021, 45(9): 1026-1032.
[3] 郭卿. 覆盆子化学成分及质量标准研究 [D].南昌: 江西中医药大学, 2015.
[4] 邓俊杰. HPLC-Q-TOF-MS技术在覆盆子指纹图谱建立和化学成分归属中的应用 [J]. 海峡药学, 2020, 32(5): 23-26.
[5] Li X B, Jiang J Y, Chen Z,. Transcriptomic, proteomic and metabolomic analysis of flavonoid biosynthesis during fruit maturation in[J]., 2021, 12: 706667.
[6] Chen Y, Chen Z Q, Guo Q W,. Identification of ellagitannins in the unripe fruit ofhu and evaluation of its potential antidiabetic activity [J]., 2019, 67(25): 7025-7039.
[7] Chen Y, Xu L L, Wang Y J,. Study on the active polyphenol constituents in differently coloredHu and the structure-activity relationship of the main ellagitannins and ellagic acid [J]., 2020, 121: 108967.
[8] 张晶, 汤尘尘, 方艳. HPLC法同时测定覆盆子中7个成分的含量 [J]. 中国药师, 2020, 23(12): 2496-2499.
[9] 张玲, 邱晓霞, 岳婧怡. HPLC法同时测定覆盆子中鞣花酸和5种黄酮成分的含量 [J]. 中药材, 2017, 40(11): 2625-2628.
[10] 王静宜, 余俊东, 陈悦, 等. 覆盆子的化学成分研究 [J]. 中草药, 2022, 53(13): 3897-3903.
[11] Sheng J Y, Wang S Q, Liu K H,.Hu: An overview of botany, traditional uses, phytochemistry, and pharmacology [J]., 2020, 18(6): 401-416.
[12] 孙金旭, 朱会霞, 肖冬光. 覆盆子中有机酸含量的测定 [J]. 现代食品科技, 2013, 29(6): 1374-1376.
[13] 毛菊华, 刘敏, 吴查青, 等. 华东覆盆子不同药用部位化学成分的含量分析 [J]. 中国药师, 2018, 21(4): 626-630.
[14] 曹富, 邱晓霞, 张玲, 等. 反向高效液相色谱法测定覆盆子中3种三萜酸的含量 [J]. 安徽中医药大学学报, 2017, 36(4): 79-82.
[15] 王晴, 黄政海, 于红红, 等. UPLC-Q-TOF/MS.E结合诊断离子过滤方法快速分析大黄中酚类成分 [J]. 中国中药杂志, 2017, 42(10): 1922-1931.
[16] 廖强. UPLC-Q-Exactive四级杆/静电场轨道阱高分辨质谱仪在复方扶芳藤合剂中定性与定量的应用研究 [D].南宁: 广西中医药大学, 2019.
[17] 王永丽, 张聪聪, 张凤, 等. UHPLC-Q-Exactive Orbitrap HR-MS分析荆银颗粒的化学成分及其组织分布特征 [J]. 中国中药杂志, 2020, 45(22): 5537-5554.
[18] 刘伟, 葛广波, 王永丽, 等. 基于UHPLC-Q-Orbitrap HRMS技术研究清肺排毒汤化学成分及小鼠组织分布 [J]. 中草药, 2020, 51(8): 2035-2045.
[19] 刘亚涛, 刘芳, 贺晓立, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱测定五味子和醋五味子中8种木脂素成分含量 [J]. 中国医院药学杂志, 2020, 40(13): 1421-1427.
[20] 张聪聪, 刘瀚泽, 王永丽, 等. UHPLC-Q-Exactive Orbitrap HRMS法同时测定大黄-桃仁药对中16种成分及其溶出规律探究 [J]. 中成药, 2022, 44(4): 1177-1183.
Analysis of chemical components in different parts ofand rapid determination of its nine main components by UHPLC-Q-Orbitrap high resolution mass spectrometry
SHEN Yao1, HUANG Si-hong2, LIU Yi-ru1, LI Jing-lei1, CHEN Chang-lun1, LIU Kao-hua1, LIU Wei3, QIN Lu-ping1, LI Rong-sheng3, WU Jian-jun1
1. School of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 310053, China 2. Department of Pediatric, Baoshan Branch, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 201900, China 3. Institute of Liver Diseases, Key Laboratory of Liver and Kidney Diseases, Ministry of Education, Shanghai Key Laboratory of Traditional Chinese Clinical Medicine, Shuguang Hospital Affiliated to Shanghai University of Traditional Chinese Medicine (TCM), Shanghai 201203, China
UHPLC-Q-Exactive Orbitrap HRMS was used to analyze and identify the chemical components in different parts (drupelets and receptacles) of, and a rapid method for the determination of nine components in drupelets and receptacles ofwas established, and to provide the basis for the rational application of different parts ofand its quality evaluation.Using Acquity UPLC HSS T3(100 mm×2.1 mm, 1.8 µm) column with 0.1% formic acid water and acetonitrile as mobile phase, and gradient elution was performed. The identification of chemical components inadopted the positive and negative ion Full MS/dd-MS2mode, combined with the primary and secondary mass spectrometry information of the compound, from the comparison and confirmation of reference substances, the main chemical components ofcan be identified quickly and accurately. The UHPLC-Q-Exactive Orbitrap HRMS method for rapid determination of nine components inwas established by using Acquity BEHC18(50 mm×2.1 mm, 1.7 µm) column in negative ion Full MS-SIM mode, and the contents of 10 batches ofwere determined.A total of 122 chemical components in drupelets and receptacle ofwere identified, including 66 flavonoids, 28 organic acids, 24 terpenoids and 4 other chemical components. Established a method successfully for the determination of nine components ofin 6 min, and the linear relationship of each component was good in its linear range. The precision, repeatability and stability were good (RSD≤6.30%); The recoveries were 99.45%−105.30% (RSD≤4.43%). Comparing the average content of nine components in 10 batches of drupelet and receptacle samples, the content of rutin in drupelets is higher than in receptacle, while the contents of ellagic acid, kaempferol 3-rutinoside and tiliroside are higher in receptacles than in drupelets of.The chemical compositions of different parts (drupelets and receptacles) ofwere different. UHPLC-Q-Exactive Orbitrap HRMS method is achieved the rapid identification of chemical components in. The established quantitative method has the advantages of short analysis time, high sensitivity and good accuracy, and the results of methodological investigation meet the requirements of content determination. It can be used for rapid determination of nine components in, which can provide some scientific reference for its quality evaluation.
Hu.; drupelet; receptacle; UHPLC-Q-Exactive Orbitrap HRMS; gallic acid; rutin; ellagic acid; hyperoside; kaempferol-3--rutinoside; astragalin; tiliroside; quercetin; kaempferol
R284.1
A
0253 - 2670(2023)15 - 4789 - 15
10.7501/j.issn.0253-2670.2023.15.004
国家自然科学基金项目(81803794);浙江中医药大学“5151远志人才工程”(112123A12201/001/004/019)
沈 瑶(2001—),在读本科生,中药学专业。Tel: 15857227126 E-mail: shenyao0923@163.com
通信作者:吴建军,博士,副教授,从事中药化学方向的研究。Tel: (0571)61768150 E-mail: wjjpharmacy@zcmu.edu.cn
李荣胜,硕士,工程师,从事药物分析及药物代谢动力学研究。Tel: (021)20256526 E-mail: rongsheng.li@shhhzy.com
2023-01-17
[责任编辑 王文倩]
