皮肤病药物临床试验的质量控制要点及特征分析
2023-08-03时歆未崔贞黄艳平朱全刚
时歆未 崔贞 黄艳平 朱全刚
摘 要 本文以2020年版《药物临床试验质量管理规范》《药物临床试验数据现场核查要点》《药物临床试验机构管理规定》为基础,以试验合规性、数据真实性、操作规范性、记录完整性为核心,归納皮肤病药物临床试验中知情同意、入排审核、研究病历书写、实验室检查、药物疗效评估、药物和生物样本管理等环节的质量控制要点,着重分析皮肤病药物临床试验的质量控制特点,以期为皮肤病药物临床试验质量控制提供参考,从而为安全、有效的皮肤病药物上市保驾护航。
关键词 皮肤病 药物临床试验 质量控制
中图分类号:R-3; R951 文献标志码:C 文章编号:1006-1533(2023)11-0059-04
引用本文 时歆未, 崔贞, 黄艳平, 等. 皮肤病药物临床试验的质量控制要点及特征分析[J]. 上海医药, 2023, 44(11): 59-62; 70.
基金项目:上海市科学技术委员会课题(20DZ2255200;21S21900900;23S21900800)
Key points and characteristics of quality control in clinical trials of dermatological drugs
SHI Xinwei, CUI Zhen, HUANG Yanping, ZHU Quangang
(PhaseⅠClinical Trial Center of Shanghai Skin Disease Hospital, Shanghai 200443, China)
ABSTRACT Based on the 2020 edition of “Good Clinical Practice”, “Key Points of On-site Drug Clinical Trial Date Inspection”, and “Regulations on the Management of Drug Clinical Trial Institutions”, with test compliance, data authenticity, operation standardization, and record integrity as the core, the key points of quality control in clinical trials of dermatological drugs such as informed consent, inclusion review, research medical record writing, laboratory examination, drug efficacy evaluation, drug and biological sample management were summarized and the quality control characteristics of clinical trials of dermatological drugs were focused on, so as to provide reference for the quality control of clinical trials of dermatological drugs and escort for their safe and effective marketing.
KEY WORDS skin disease; drug clinical trials; quality control
药物是皮肤病治疗最主要的手段,临床试验作为皮肤病治疗药物研发的关键环节及药品审评、审批的重要依据,也是皮肤病药物上市的必经之路。2020年中国药物临床试验登记与信息公示平台登记的皮肤类药物注册临床试验占同期全部药物临床试验的6.16%[1],2021年皮肤类药物临床试验项目登记量达到186项,较2020年增长18.4%。近年来,诺华、赛诺菲、礼来、杨森、辉瑞等知名跨国医药企业纷纷涉足皮肤病新药研发领域,多个重磅产品获准上市,皮肤科创新药的临床试验项目日趋增多。为进一步提高皮肤科新药临床试验质量,亟需加强皮肤病药物临床试验的质量控制,通过质量控制的事先预防和事后整改,确保试验合规、数据真实、操作规范、记录完整,也有利于提升药物临床试验机构的竞争力。
目前与质量控制密切相关的法规、规范包括《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》《药物临床试验质量管理规范》(Good Clinical Practice, GCP)等。其中,GCP是保证药物临床试验过程规范、结果科学可靠、保护受试者权益并保障其安全的有效手段,是包括方案设计、组织实施、监查、稽查、记录、分析总结和报告等临床试验全过程的标准规定。本文根据2020版GCP以及《药物临床试验数据现场核查要点》,结合我院药物临床试验质量控制的实际情况,详细分析皮肤病药物临床试验的质量控制特点,以期为皮肤病药物临床试验质量控制提供参考。
1 皮肤病药物临床试验质量控制要点
药物临床试验质量控制的核心包括试验的合规性、数据的真实性、操作的规范性、记录的完整性。试验合规性和数据真实性的质量控制要点主要来源于《药物临床试验数据现场核查要点》,操作规范性的质量控制要点来源于《药物临床试验机构管理规定》《药物临床试验伦理审查工作指导原则》以及国家卫生健康委员会的《涉及人的生命科学和医学研究伦理审查办法》等。本文现以4个核心和上述文件为基石,归纳皮肤病药物临床试验质量控制要点(图1)。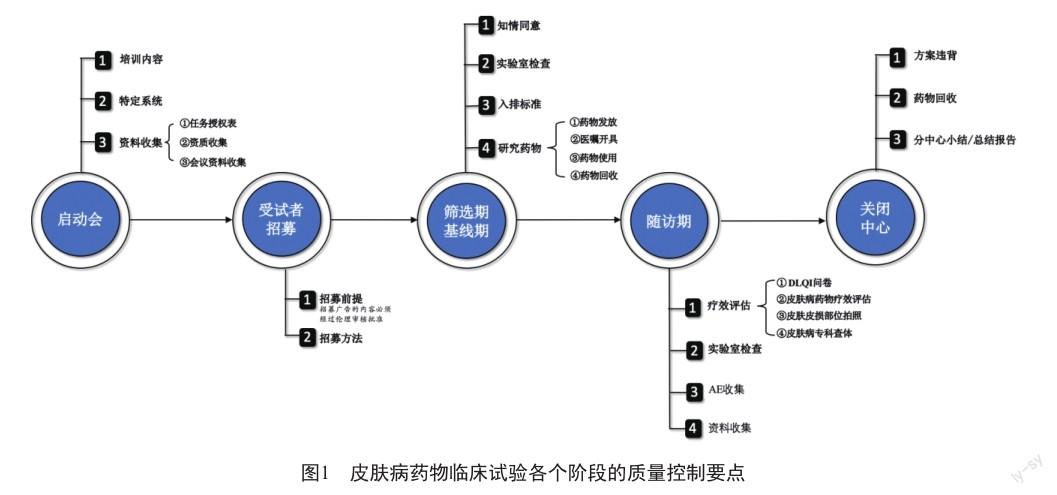
1.1 知情同意书
确认签署的知情同意书应是中心伦理批准版本,知情同意书签署时间/日期应先于任何研究程序,知情同意书签署时间不得早于伦理批准时间,筛选时间不得早于知情同意书签署时间;修订版的知情同意书在通过伦理审批后,所有未结束试验流程的受试者,都应当签署新修订的知情同意书;确认执行知情同意过程的研究人员须被授权;确认研究者未以各种方式“诱导”受试者参加临床试验,签署知情同意书;知情同意书一式2份,其中1份须交予受试者保存。
1.2 入排审核
涉及入排(纳入与排除)标准的相关病史资料务必齐全;妥善保存受试者的既往病史和合并用药等资料;确保研究者审签入排相关资料;随机分组前研究者务必逐条仔细核对入排标准,确保受试者的入排符合方案与GCP的规定。
1.3 研究病历
知情同意详细过程的表述性文字完整且无误;修订版的知情同意书的签署过程应及时记录于研究病历中;研究病历中入排的流程,应符合试验方案的入排标准;研究药物、背景药物、急救药物的使用情况与研究方案的药物使用要求没有分歧;研究病历中访视内容遵守方案流程;合并用药记录完整无缺漏;不良事件(adverse event, AE)及严重不良事件(serious adverse event, SAE)填写规范,分级正确、内容完善;研究病历中数据应当与源文件一致。
1.4 安全性检查
安全性检查源数据,应及时、准确地由操作者记录于源文件并交予研究者判定;研究者应按照临床试验方案规定的实验室检查项目开具医嘱;对受试者的相关医学判断和临床决策必须由中心具有执业资格的研究者执行;研究者对检验报告单的签署未存在时间逻辑性问题;签署完成的检查报告单应规范保存于受试者文件夹内;研究者对异常无临床意义/有临床意义(non-clinical significance/clinical significance, NCS/CS)的医学判定应保持前后一致;不同研究者对于同一指标的判定应该有统一的标准。
1.5 药物疗效评估及相关评分
药物疗效评估数据核算无误;须受试者独立自评的问卷务必先于其他研究流程前完成,最大化减少研究者对受试者的影响;研究病历中须记录与皮肤专科查体的描述具有一致性的療效评估结果;尽量保证每位受试者所有访视中的药物疗效评估是由同一研究者判定,以规避研究者之间的差异;确认研究者及时完成药物耐受性评估。
1.6 AE
判断AE分级准确,AE与研究药物的因果关系判定合理;AE记录是否全面涵盖跟踪至转归;AE和SAE的报告和随访应及时;不同研究者对AE判断尺度、标准和方法应具有统一性。
1.7 试验药物管理
保证试验药物的接收、保存、发放、使用和回收的原始表设计合理;发药系统账号及药物编号填写无误;药物发放回收记录表、药物库存表填写无误;随机邮件经由研究者签署确认后归纳于受试者文件夹中;研究者开具的医嘱中药物编号、用药方式填写准确无误;确保研究者完成对受试者的用药指导;药物依从性计算准确无误。
1.8 临床试验的生物样本采集、保存、运送与交接
生物样本采集、处理、保存、转运过程的原始记录应当规范填写。
1.9 研究者文件夹
启动会会议资料应收集完备;研究人员资质文件、授权分工表、签名样张签署规范;授权分工表中授权开始、结束的日期与实际试验开展情况无时间逻辑问题;应有药物临床试验相关的实验室检测正常值范围及更新文件、医学或实验室操作的质量控制证明以及中心实验室资质文件材料;监督方案偏移/违背方案的处理是否规范,方案偏移应有伦理备案或递交信存档,严重方案违背须进行伦理审核。
2 皮肤病药物临床试验质量控制特点分析
2.1 知情同意
知情同意书是受试者自愿参加药物临床试验的证明文件。需要研究者详细解释其中的重要内容,包括试验性质、试验目的、试验的流程、可能的获益和风险(不良反应)、除了参加试验外可供选用的其他治疗方法、试验期间的随访次数、试验检查、相关的补偿事宜等内容。由于受试者与研究者对疾病认识程度存在差异,受试者在接受试验前应有充分的知情权,务必予以其充分的时间考虑,自愿参加,不受其他隐性诱导或胁迫,受试者和研究者双方须共同于已经生效的知情同意书上正确填写签名、日期和时间后,方可进入临床试验筛选流程。
2.2 入排标准审核
入排标准是关乎受试者能否成功入组的决定性因素,合理的入排标准是保证临床试验顺利开展的前提。入排标准的审核应包括以下内容:①受试者年龄是否达标且自愿签署知情同意书。②受试者皮肤病的严重程度在研究方案规定的特定范围内,参与临床试验的受试者被要求能最大程度地代表目标皮肤病人群。但通常处在不同发展阶段的皮肤病治疗方式不尽相同,因此很多皮肤病药物临床试验不仅对皮肤病做了诊断性的准入限制,还对其进展程度做了限定。③既往治疗史及用药史收集完备,为了排除某些既往用药、疾病等干扰因素对药效评估的影响,药物临床试验对受试者的既往用药史有明确严格限制。④入组受试者具备研究方案规定的身体基础条件,须对受试者的基础健康指标、生活习惯等有所要求,以保证参与的受试者能够具备完成该试验所必需的身体条件。⑤确保入排资料的收集完整且判断客观。
2.3 皮肤病药物疗效评估及评分
药物有效性是药品上市的奠基石,药物疗效评估作为临床试验中极具重要性的环节之一。疗效观测指标和以疗效观测指标为基础确定药物疗效的评估指标,疗效评价的关键因素就是药物的疗效评价指标。我院药物临床试验机构近几年承接各类临床试验项目,涉及的适应证有银屑病、特应性皮炎、荨麻疹、斑秃、带状疱疹等,积累了丰富临床试验经验。其中,前两位的适应证为银屑病与特应性皮炎。
银屑病是一种慢性非传染性疾病,引起全身炎症的同时并伴有多种合并症[2]。银屑病的临床诊断基于患者的病史评估,以及是否存在具有特征性形态和分布的皮损[3]。银屑病面积及严重程度指数(psoriasis area and severity index, PASI)是国际医学界观察斑块面积及外观以评估病情的标准,是临床试验中最广泛使用的测量银屑病严重程度的工具[4],是临床医生治疗决定的基础。
特应性皮炎是一种慢性、瘙痒性、炎症性和复发性皮肤病,影响高达15%~25%的儿童和约2%~3%的成年人。其临床表现包括红斑、皮肤水肿、干燥、糜烂/擦伤、渗出、结痂和苔藓化[5],在日常临床实践和临床试验中,缺乏充足的实验室检测方案以满足疾病严重程度的精确评估和治疗情况的监测。目前,特应性皮炎严重程度的衡量是基于主观症状的评估,为了能够客观评估患者特应性皮炎的严重程度,临床试验多采用特应性皮炎评分(severity scoring of atopic dermatitis, SCORAD)、湿疹面积及严重程度指数(eczema area and severity index, EASI)作为疾病严重程度评估工具[6]。
在临床试验中,药物疗效的评估指标是考察研究药物是否有效的关键。但伴随患者年龄和病变的慢性程度,皮肤类疾病严重程度也会趋于变化。疾病严重程度的衡量是基于主观症状的评估,而主观症状的评估很大程度依赖于医生对临床表现的评估。尽可能客观地评估疾病的严重程度是极其重要的,上述的疗效评估指标具备能够帮助研究者客观判断药物的治疗效果。因此,研究者评估结果的一致性对于皮肤病治疗药物临床试验的成功十分重要。但在不同治疗进程中的药物疗效评估结果分析方面存在较大的挑战,其原因在于:皮肤病药物疗效评估的历程通常会耗费研究者较长时间,较难避免主观感受带给药物疗效评估的影响,因此,申办方应制定完备的疗效评估流程和执行充分的培训,记录研究者试验中的评估结果,及时发现并总结已有的问题。
皮肤类疾病会对患者生活质量造成负面影响是不言而喻的。生活质量问卷作为药物疗效评估的内容之一,已广泛用于皮肤病药物临床试验。其中,皮肤病学生活质量指数(dermatology quality of life index, DLQI)作为目前皮肤病治疗药物临床试验中使用最广泛的生活质量指標[7-9],是目前许多皮肤病治疗药物临床试验的主要结果指标之一。因此,作为应由受试者独立自评的DLQI问卷,理应最大化减少研究者对受试者生活质量评估的影响,确保生活质量问卷先于其他研究流程内容。在质量控制的工作中,应查看研究者是否完成DLQI的审阅,确保研究者对受试者情况的充分掌握。
多数临床试验项目要求研究者在进行药物疗效评价的同时对皮损部位拍摄标准化照片。标准化照片不能涵盖识别受试者身份的信息,但应体现不同访视期不同皮损部位的关键信息,若缺乏关键信息,则不利于后续数据的整理及数据分析。
2.4 AE的记录与跟踪
除了皮肤病药物疗效评估,安全性评价也是全面、客观评价皮肤病研究药物必不可少的实质内容。安全性评价不仅可以评估受试者安全风险,为研究药物能否获批上市提供充分证据,而且是起草和撰写药物安全性信息的重要根据。AE作为药物临床试验安全性评价指标之一,是否被正确收集和评估,将直接影响试验药物的安全性评价,进而会影响到试验结果的科学可靠和药品上市后的用药安全。质量控制工作中务必检查AE的记录及判断的错漏:无常见不良反应术语评定标准(common terminology criteria for adverse events, CTCAE)分级、未跟踪记录转归,各方对AE判断尺度、标准和方法认识不统一,导致AE的规范化判断、记录及统计存在差异;完善包括访视问诊、实验室检查结果、外院就诊记录、受试者日记卡在内的AE收集方式;密切关注SAE处理、报告和记录问题,SAE的及时上报关系到对药物严重不良反应的及时监测,能否及时采取措施降低受试者风险,对受试者进行损害赔偿,维护受试者权益等[10]。
2.5 方案偏离/违背
在质量控制工作中应核对偏离/违背方案的处理是否符合规范,确保方案偏离/违背有伦理备案或已经存档递交信,其中严重方案违背有伦理审核意见是质量控制过程中不可或缺的环节。对此,加强对研究人员的培训能够一定程度避免研究者在试验中根据经验处理问题,因为方案偏离/违背的发生往往是因为临床经验与试验方案不一致,或不熟悉方案和相关标准操作规程造成。
3 结语
皮肤病药物临床试验质量控制要点涉及知情同意、入排审核、研究病历书写、实验室检查、药物疗效评估、药物和生物样本的管理等环节,这些环节贯穿于药物临床试验的全过程,需要对药物临床试验实施全过程动态管理。因此,药物临床试验机构应严格执行GCP,在实践中不断完善皮肤病药物临床试验质量控制体系,强化对临床试验的监管,着力提高临床试验水平,切实保障受试者权益,保证药物临床试验规范化运行,为安全、有效的皮肤病药物上市保驾护航。
参考文献
[1] 朱蓓蓓, 李婧, 黄慧瑶, 等. 2020年中国皮肤病药物临床试验分析[J]. 中华皮肤科杂志, 2021, 54(11): 1001-1004.
[2] Langley RGB, Krueger GG, Griffiths CEM. Psoriasis: epidemiology, clinical features, and quality of life[J]. Ann Rheum Dis, 2005, 64(Suppl 2): ii18-ii23.
[3] Griffiths CEM, Armstrong AW, Gudjonsson JE, et al. Psoriasis[J]. Lancet, 2021, 397(10281): 1301-1315.
[4] Cabrera S, Chinniah N, Lock N, et al. Inter-observer reliability of the PASI in a clinical setting[J]. Australas J Dermatol, 2015, 56(2): 100-102.
[5] Eichenfield LF, Tom WL, Chamlin SL, et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis[J]. J Am Acad Dermatol, 2014, 70(2): 338-351.
[6] Bo?ek A, Reich A. Assessment of intra- and interrater reliability of three methods for measuring atopic dermatitis severity: EASI, objective SCORAD, and IGA[J]. Dermatology, 2017, 233(1): 16-22.
[7] Mermin D, Boursault L, Milpied B, et al. DLQI as a major criterion for introduction of systemic agents in patients with mild psoriasis[J]. J Eur Acad Dermatol Venereol, 2016, 30(11): 1961-1964.
[8] Silverberg JI, Gelfand JM, Margolis DJ, et al. Severity strata for POEM, PO-SCORAD, and DLQI in US adults with atopic dermatitis[J]. Ann Allergy Asthma Immunol, 2018, 121(4): 464-468. e3.
[9] Gergely LH, Gáspár K, Brodszky V, et al. Validity of EQ-5D-5L, Skindex-16, DLQI and DLQI-R in patients with hidradenitis suppurativa[J]. J Eur Acad Dermatol Venereol, 2020, 34(11): 2584-2592.
[10] 張莉, 康长清, 舒鹤, 等. 药物临床试验受试者损害赔偿方案调研[J]. 中国医学伦理学, 2015, 28(5): 758-761.
