雌激素相关受体a对脑胶质瘤细胞耐受替莫唑胺的影响
2023-08-03张留弟王天笑陈海飞李群益施孝金
张留弟 王天笑 陈海飞 李群益 施孝金


摘 要 目的:探究雌激素相关受体a对脑胶质瘤细胞耐受替莫唑胺(temozolomide,TMZ)的调控作用及其机制。方法:建立耐受TMZ的胶质瘤细胞株,并构建胶质瘤裸鼠移植模型;从离体和在体层面分析特异性敲减ERRa或使用ERRα反向激动剂XCT790对耐药胶质瘤细胞增殖的影响;并结合荧光定量PCR实验检测Wnt通路相关基因的表达。结果:敲减ERRα或给予XCT790均显著抑制耐药胶质瘤细胞增殖,并抑制Wnt5a信号通路关键基因的表达,动物模型中XCT790联用TMZ可有效抑制耐受TMZ的胶质瘤细胞生长。结论:抑制ERRa功能可逆转胶质瘤细胞对替莫唑胺的耐药性,这一作用可能与抑制Wnt5a信号通路的功能密切相关。
关键词 雌激素相关受体a 胶质瘤 替莫唑胺 XCT790 Wnt5a
中图分类号:R73-3; R739.41 文献标志码:A 文章编号:1006-1533(2023)11-0051-05
引用本文 张留弟, 王天笑, 陈海飞, 等. 雌激素相关受体a对脑胶质瘤细胞耐受替莫唑胺的影响[J]. 上海医药, 2023, 44(11): 51-55.
基金项目:国家自然科学基金面上项目(81973399);国家自然科学基金青年科学基金项目(81901399);上海市卫生健康委员会科研基金项目(20184Y0194, 20204Y0445)
Effect of estrogen-related receptor α on temozolomide resistance in glioma cell
ZHANG Liudi, WANG Tianxiao, CHEN Haifei, LI Qunyi, SHI Xiaojin
(Department of Pharmacy, Huashan Hospital, Fudan University, Shanghai 200040, China)
ABSTRACT Objective: To investigate the regulatory effect and mechanism of estrogen-related receptor a (ERRa) on temozolomide resistance in glioma cells. Methods: A temozolomide (TMZ) resistant glioma cell line and a nude mouse model of glioma orthotopic transplantation were established. The effects of specific ERRa knockdown or the use of the ERRα reverse agonist XCT790 on the proliferation of TMZ-resistant glioma cells were analyzed in vitro and in vivo. The expression of Wnt pathway-related genes was detected by fluorescence quantitative PCR. Results: Knocking down ERRa or administration of XCT790 could significantly inhibit the proliferation of TMZ-resistant glioma cells and the expression of the key genes in Wnt5a signaling pathway, and prolong the survival period of model animals. Conclusion: Inhibition of ERRa function can reverse TMZ resistance in glioma cells, which may be closely related to inhibiting the function of Wnt5a signaling pathway.
KEY WORDS estrogen related receptors a; glioma; temozolomide; XCT790; Wnt5a
腦胶质瘤是成年人颅内最常见、恶性程度最高及预后情况最差的肿瘤[1]。其中胶质母细胞瘤(glioblastoma, GBM, WHO Ⅳ级)是恶性程度最高的脑胶质瘤,发病率约为3.2/10万,在所有胶质瘤患者中占46.1%[2]。目前治疗方案以手术切除为主。但由于胶质瘤细胞生长迅速,侵袭能力强,与正常脑组织无明显界限,且瘤体分布较为分散,手术很难彻底清除肿瘤病灶,因此术后须结合放化疗。在临床化疗用药中,替莫唑胺(temozolomide, TMZ)的应用最为广泛。TMZ为咪唑并四嗪类具有抗肿瘤活性的第二代口服烷化剂,是目前临床治疗脑胶质瘤的标准一线化疗药[3]。多项国际大型随机对照研究证实,胶质瘤患者手术后服用TMZ同步进行放化疗,相比于术后单纯放疗的病人,中位数生存期由12个月提高到14.6个月,其中部分患者术后生存期达到5年以上[4-5]。证实了术后通过化疗可以进一步杀灭残存肿瘤细胞,有助于提高患者无进展生存期和总生存期。然而在临床治疗过程中后期,部分患者对替莫唑胺的敏感性逐渐降低,肿瘤复发概率提升,导致疾病根治难度加大[6]。因此,寻找一种有效降低胶质瘤患者对TMZ耐药性的方案对肿瘤治疗和延长患者生存周期至关重要。
雌激素相关受体a(estrogen-related receptor a,ERRa)在体内广泛表达,参与调控组织器官发育、细胞衰老、肿瘤发生和发展等[7]。近年来,大量研究揭示ERRα的表达与乳腺癌、子宫内膜癌、前列腺癌、胃腺癌和胶质瘤等肿瘤疾病的发生发展和临床预后密切相关[8-9]。杜克大学的McDonnell等[10]的研究证实,ERRa反向激动剂可以抑制线粒体的功能从而抑制乳酸的利用,特异性导致肿瘤细胞的持续凋亡,并显著增敏PI3K抑制剂或者PI3K/mTOR双重抑制剂的体内抗肿瘤活性,因此,联合应用ERRa拮抗剂/反向激动剂可能成为新的抗肿瘤治疗策略。本研究拟通过建立耐受TMZ的胶质瘤细胞株,并构建胶质瘤裸鼠原位移植模型;从细胞到动物层面评估特异性敲减ERRa或使用ERRa反向激动剂XCT790对逆转胶质瘤细胞耐受TMZ的潜力,并探讨其作用机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞和动物
人类神经胶质瘤细胞系U87和U251购自中国科学院细胞库。构建胶质瘤裸鼠原位移植模型所用雄性裸鼠(BALB/c nude)购自上海西普尔-必凯实验动物有限公司。
1.1.2 试剂
XCT 790(HY-10426)、TMZ(HY-17364)均购自MedChemExpress公司;上海吉凯基因生物技术有限公司提供了本研究使用的ERRα敲减慢病毒载体和阴性对照品。
1.2 方法
1.2.1 细胞培养
两种胶质瘤细胞均在添加10%澳洲胎牛血清(翌圣生物科技有限公司)和100 U/mL青霉素/链霉素(碧云天生物技术有限公司)的最低必需培养基(中桥新舟生物技术有限公司)中培养。细胞在含有5% CO2和95%空气的湿化培养箱中于37 ℃培养。
为了探究ERRα对耐受TMZ的神经胶质瘤细胞的治疗作用,我们参考先前研究建立耐受TMZ的胶质瘤细胞系[11]。U87和U251细胞分别用低浓度TMZ(10 mmol/L)作为初始浓度,TMZ剂量每2周增加1倍,直到药物浓度达到640 mmol/L。
1.2.2 细胞活力测定
使用细胞计数试剂盒-8(CCK-8,Proteintech Group公司)进行细胞活力测定。将胶质瘤细胞以6×103个细胞/孔的密度接种到96孔板中,并在标准培养条件下孵育24 h。药物处理后,将10 μL/孔CCK-8试剂加入96孔板中,并在37 ℃下孵育1 h。使用多功能酶标仪在450 nm处检测光密度(OD)值。每个实验均独立进行了3次,每次实验有5份重复。
1.2.3 荧光定量PCR测定
胶质瘤细胞实验处理后,利用RNA提取试剂盒(康为生物技术有限公司)从细胞中分离总RNA。使用逆转录试剂盒(Takara生物技术公司)将2 mg总RNA逆转录成cDNA。并在ABI 7500 PCR系统(Applied Biosystems公司)中使用SYBR Green PCR试剂盒(Takara生物技术公司)进行定量实时逆转录聚合酶链式反应(RT-PCR)反应。为了标准化检测基因的表达水平,利用GAPDH基因作为内参进行检测。检测基因的引物序列设计参考RTPrimerDB数据库 (http://medgen.ugent. be/rtprimerdb/)。
1.2.4 建立胶质瘤裸鼠异种移植模型
雄性BALB/c裸鼠(6~8周龄,22 g)背部皮下注射2×106个U87 TMZ耐药细胞,建立胶质瘤异种移植模型。胶质瘤细胞植入后每天给予药物治疗,并在第5天开始,每隔5 d记录瘤体生长情况并绘制肿瘤生长曲线,移植瘤体积[V(cm3)]=0.5×L×S2(L,移植瘤最大长径cm,S移植瘤横径cm)。实验开始后第30天处死动物对瘤体进行称重。
1.2.5 统计学分析
使用GraphPad Prism 7.0和SPSS 16.0软件对数据进行统计分析。单因素方差分析和Dunnetts post-hoc检验比较实验中的组间差异。在分析之前,所有数据都经过了Kolmogorov-Smirnov正态性检验和Levene检验。Compusyn软件用于绘制Chou-Tallay等剂量图评估XCT790与TMZ联合用药的协同作用。数据以平均值±标准差表示。P<0.05提示差异具有统计学意义。
2 结果
2.1 建立胶质瘤TMZ耐药细胞株
TMZ已被证实是胶质瘤的一线化疗药物,可以延长患者生存期。然而,连续使用TMZ治疗引起的获得性化疗抵抗严重限制了治疗效果,成为胶质瘤患者治疗失败的主要原因。我們通过长期给予梯度增高的TMZ,建立对TMZ耐药的胶质瘤细胞株。并利用CCK-8检测TMZ在亲本细胞和耐药细胞中IC50的变化情况。结果显示,U87亲本细胞TMZ IC50为796 mmol/L,而耐药细胞TMZ IC50达到了2 314 mmol/L,提高了约2.9倍;U251亲本细胞TMZ IC50为434 mmol/L,耐药细胞TMZ IC50为1 138 mmol/L,提高了约2.6倍(图1)。这些结果证实我们成功建立了对TMZ耐药的胶质瘤细胞株。
2.2 敲减ERRα逆转胶质瘤细胞对TMZ的耐药性
在已建立的对TMZ耐药的胶质瘤细胞基础上,我们利用慢病毒转染的手段,特异性敲减耐药细胞株的ERRα表达,并观察敲减ERRα是否影响TMZ的治疗效果。结果显示,敲减ERRα后,U87 TMZ耐药细胞的TMZ IC50降低了45.6%,而U251 TMZ耐药细胞的TMZ IC50降低了35.5%(图2),证实敲减ERRα可显著逆转胶质瘤细胞对TMZ的耐药性。
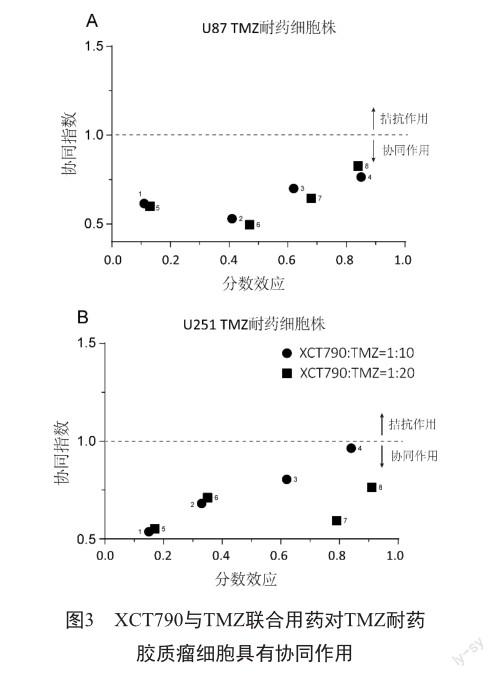
2.3 XCT790与TMZ联合用药对胶质瘤治疗具有协同作用
之前的研究结果已经敲减ERRα可有逆转胶质瘤细胞对TMZ的耐药性,我们推测ERRα特异性反向激动剂XCT790与TMZ联合治疗耐药胶质瘤细胞能发挥协同作用,并采用了Chou-Talay联合用药协同分析方案来评估协同作用效果。利用梯度浓度XCT790和指定浓度的TMZ处理胶质瘤细胞24 h,组合指数(CI)小于1表明XCT790和TMZ的组合具有协同作用。结果显示,XCT790和TMZ的组合协同产生了胶质瘤抗TMZ的活性(CI<1.0,图3)。这一结果证实,XCT790与TMZ的协同用药方案对治疗TMZ耐药的胶质瘤具有较大潜力。

2.4 ERRα调控TMZ耐药胶质瘤细胞WNT通路相关基因表达
为了探究ERRα对胶质瘤TMZ耐药调控的机制,我们利用PCR对给予XCT790(2 mmol/L)和敲减ERRα后U87 TMZ耐药细胞株Wnt5a、GSK3β、Axin、APC、β-catenin基因表达进行检测,结果表明,给予XCT790和敲减ERRα均降低U87耐药细胞株Wnt通路相关基因的表达(图4)。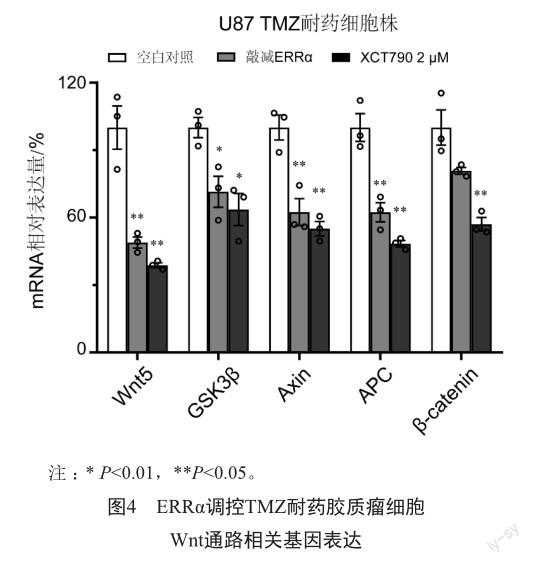
2.5 XCT790抑制TMZ耐药的胶质瘤异种移植小鼠瘤体生长
基于我们在体外研究中的发现,有理由认为XCT790在体内同样具有逆转胶质瘤对TMZ耐药性的作用。为了验证XCT790对TMZ耐药的胶质瘤的治疗作用,我们在裸鼠中建立了TMZ耐药胶质瘤细胞异种移植模型。12只模型动物等分为3组,空白对照组动物给予溶剂对照,TMZ治疗组每日腹腔注射100 mg/kg TMZ,联合治疗组在给予TMZ治疗的基础上额外给予20 mg/kg的XCT790。结果显示,与单用TMZ治疗组相比,XCT790+TMZ治疗组模型动物移植瘤生长速度和瘤体重量均显著降低(图5)。
3 讨论
本研究发现,敲减ERRα能有效逆转胶质瘤细胞TMZ耐药;接着又证实了ERRα反向激动剂XCT790联用TMZ在离体和在体实验中对TMZ耐药的胶质瘤细胞的治疗均体现出显著协同作用。进一步研究发现,敲减ERRα和XCT790联用逆转胶质瘤对TMZ耐药性的作用可能与抑制耐药细胞中Wnt5a信号通路密切相关。以上结果证实了抑制ERRα功能可逆转胶质瘤细胞对TMZ耐药性,这一作用可能与抑制Wnt5a信号通路的功能密切相关。
作为极具潜力的抗肿瘤药物靶点,近年来,关于ERRα的研究受到极大关注。ERRα全长423个氨基酸,其编码基因位于人染色体11q13位点,全长约20 kb,包括7个外显子和6个内含子。ERRα在体内广泛表达,从心肌、消化道、大脑、骨骼肌、棕色脂肪以及乳腺癌、卵巢癌等恶性肿瘤等均能检出。ERRα以二聚体形式与雌激素反应元件结合来发挥其生物学效应,还能以单体形式与雌激素相关受体反应元件结合。ERRα对于代谢靶基因的精确调控在机体的能量代谢中起着重要的作用。ERRα在机体中参与的代谢过程主要有:糖代谢、脂代谢、线粒体氧化代谢、自适应能量代谢等。这些功能的发挥与组织器官的发育、细胞的衰老、肿瘤的发生和发展等密切相关。ERRα在多种肿瘤中过表达,如乳腺癌、卵巢癌、胶质瘤、前列腺癌、结直肠癌、宫颈癌、子宫内膜癌等,而且与肿瘤的迅速发展、预后不良密切相关[12-14]。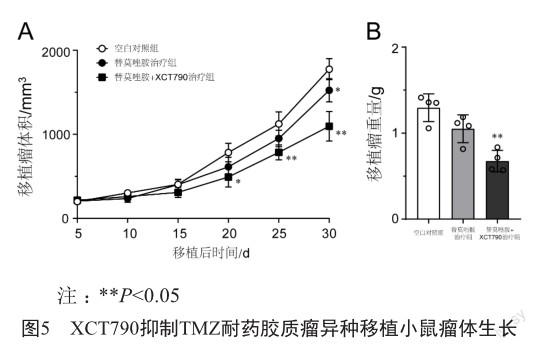
近年來,由Wnt5a所调控的Wnt信号通路在神经胶质瘤中的作用引起了广泛关注,为胶质瘤靶向治疗提供了新思路。Wnt信号转导通路常见于胚胎发育和某些正常生理过程,并参与了干细胞的多能性维持或分化,以及细胞增殖。迄今为止,已发现至少19个Wnt家族成员。其中, Wnt5a在肿瘤的发生发展中发挥多种功能,其在组织中可对细胞的迁移、侵袭及血管的生成产生影响,并且对组织的修复和维持组织的稳态起着极其重要的作用。Wnt5a既能作用于经典的Wnt/β-catenin通路,又能活化非经典的Wnt/Ca2+及Wnt/PCP通路。近期研究表明,Wnt5a在胶质瘤中高表达,并与恶性胶质瘤侵袭性、病情进展及预后不良显著相关[15-16]。Wnt5a通过结合Ryk受体,调控MMP-2表达促进胶质瘤侵袭与浸润[17]。Wnt5a还参与了胶质瘤上皮间质转化[18]。
总体而言,我们的研究明确了抑制ERRα功能可有效逆转胶质瘤对TMZ的耐药性,这一作用可能与抑制耐药胶质瘤细胞Wnt5a信号通路的功能密切相关。这一发现为胶质瘤耐受TMZ问题的解决提供了新的思路和见解。
参考文献
[1] Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109.
[2] Dimitrov L, Hong CS, Yang C, et al. New developments in the pathogenesis and therapeutic targeting of the IDH1 mutation in glioma[J]. Int J Med Sci, 2015, 12(3): 201-213.
[3] Hombach-Klonisch S, Mehrpour M, Shojaei S, et al. Glioblastoma and chemoresistance to alkylating agents: involvement of apoptosis, autophagy, and unfolded protein response[J]. Pharmacol Ther, 2018, 184: 13-41.
[4] Stewart LA. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials[J]. Lancet, 2002, 359(9311): 1011-1018.
[5] Stupp R, Hegi ME, Mason WP, et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTCNCIC trial[J]. Lancet Oncol, 2009, 10(5): 459-466.
[6] Messaoudi K, Clavreul A, Lagarce F. Toward an effective strategy in glioblastoma treatment. Part Ⅱ: RNA interference as a promising way to sensitize glioblastomas to temozolomide[J]. Drug Discov Today, 2015, 20(6): 772-779.
[7] 陸蕴红,李群益,施孝金. 雌激素相关受体a(ERRa)与肿瘤疾病的研究进展[J]. 复旦学报(医学版), 2014, 41(1): 126-132.
[8] Ranhotra HS. The estrogen-related receptor alpha: the oldest, yet an energetic orphan with robust biological functions[J]. J Recept Signal Transduct Res, 2010, 30(4): 193-205.
[9] Suzuki T, Miki Y, Moriya T, et al. Estrogen-related receptor alpha in human breast carcinoma as a potent prognostic factor[J]. Cancer Res, 2004, 64(13): 4670-4676.
[10] Park S, Chang CY, Safi R, et al. ERRa-regulated lactate metabolism contributes to resistance to targeted therapies in breast cancer[J]. Cell Rep, 2016, 15(2): 323-335.
[11] Munoz JL, Rodriguez-Cruz V, Greco SJ, et al. Temozolomide resistance in glioblastoma cells occurs partly through epidermal growth factor receptor-mediated induction of connexin 43[J]. Cell Death Dis, 2014, 5(3): e1145.
[12] Tam IS, Giguere V. There and back again: the journey of the estrogen-related receptors in the cancer realm[J]. J Steroid Biochem Mol Biol, 2016, 157: 13-19.
[13] Gandhari MK, Frazier CR, Hartenstein JS, et al. Identification and characterization of estrogen receptor-related receptor alpha and gamma in human glioma and astrocytoma cells[J]. Mol Cell Endocrinol, 2010, 315(1-2): 314-318.
[14] Zhang L, Zhu Y, Cheng H, et al. The increased expression of estrogen-related receptor alpha correlates with wnt5a and poor prognosis in patients with glioma[J]. Mol Cancer Ther, 2019, 18(1): 173-184.
[15] Zhang L, Liu P, Chen H, et al. Characterization of a selective inverse agonist for estrogen related receptor alpha as a potential agent for breast cancer[J]. Eur J Pharmacol, 2016, 789: 439-448.
[16] Du Y, Song L, Zhang L, et al. The discovery of novel, potent ERR-alpha inverse agonists for the treatment of triple negative breast cancer[J]. Eur J Med Chem, 2017, 136: 457-467.
[17] Ning Y, Chen H, Du Y, et al. A novel compound LingH2-10 inhibits the growth of triple negative breast cancer cells in vitro and in vivo as a selective inverse agonist of estrogenrelated receptor alpha[J]. Biomed Pharmacother, 2017, 93: 913-922.
[18] Binda E, Visioli A, Giani F, et al. Wnt5a drives an invasive phenotype in human glioblastoma stem-like cells[J]. Cancer Res, 2017, 77(4): 996-1007.
