SGLT2抑制剂卡格列净通过调控AngⅡ/TRPC6通路保护肾病综合征大鼠肾功能
2023-08-02张文,张颜
张 文,张 颜
(云南省第三人民医院 肾内血液风湿免疫科,云南 昆明 650011)
肾病综合征(nephrotic syndrome,NS)是临床常见的肾脏疾病,其是由肾小球滤过膜损伤后增加基膜通透性所致,主要表现为大量蛋白尿、低白蛋白血症、高脂血症和水肿等[1]。据数据统计显示[2],肾病综合征占儿童肾小球疾病的70%~90%和成人肾小球疾病的20%~30%。目前临床治疗肾病综合征主要是以激素和免疫抑制剂为主,但长时间的使用会导致免疫系统的紊乱,极易诱发并发症和感染,且复发率较高[3]。钠-葡萄糖协同转运蛋白2抑制剂(sodium glucose cotransporter 2 inhibitor,SGLT2i)是近年来新发现的口服降糖药物之一,其对近曲小管中葡萄糖共转运体活性发挥抑制作用,通过诱导糖尿和渗透性利尿而降低葡萄糖的再吸收[4]。近年来有学者研究发现[5],SGLT2i除降血糖外,还具有多种生物学作用,例如降低血肌酐、减少蛋白尿及治疗肾脏疾病引起死亡等。但目前关于SGLT2i对肾病综合征大鼠肾功能的保护机制尚不清楚。肾病综合征发病机制复杂,学者研究发现血管系统可能是治疗肾病综合征的重要突破点。血管紧张素Ⅱ(angiotensin,Ang Ⅱ)是renin-angiotensin system(RAS)或肾素-血管紧张素系统(RAS)中常见的强收缩血管活性因子,其可参与多种病理反应,包括血管收缩、钠水潴留、促炎、促纤维化等[6]。文献显示[7],Ang Ⅱ在肾小球病变患者肾组织中水平明显高于正常患者。瞬时受体电位阳离子通道6(transient receptor potential cation channel 6,TRPC6)是维持足细胞骨架稳定性的常见通道蛋白,其在肾小球足细胞中广泛分布,对胞内钙信号可发挥调节作用[8]。有学者研究发现[9],在肾小球疾病中均发现了TRPC6表达异常,且证实Ang Ⅱ可通过增强TRPC6通道的电流诱导Ca2+过度内流。但目前关于Ang Ⅱ/TRPC6通路对肾病综合征肾保护作用的影响尚不清楚。因此,本研究旨在探究SGLT2i通过调控Ang Ⅱ/TRPC6通路对肾病综合征模型大鼠肾功能的保护作用。
1 资料与方法
1.1 实验动物 SPF级、雄性SD大鼠50只,8周龄,体质量180~200 g,均购自北京维通利华公司,许可证号:SCXK(皖)2017-0001。统一饲养大鼠,保持动物房温度恒定22~26 ℃,室内相对湿度50%~60%,光照模拟昼夜交替12 h一循环,标准饲料饲养大鼠,自由饮食饮水。所有大鼠均进行2次尿蛋白定性实验均为阴性,适应性喂养7 d。
1.2 试剂和仪器 SGLT2抑制剂卡格列净片(阿斯利康制药有限公司);阿霉素(北京百奥莱博科技有限公司);Ang Ⅱ(上海江莱生物技术有限公司);TRPC6阻断剂(SAR7334)(美国Cayman公司);ELISA试剂盒(北京雷根生物技术有限公司);Ang Ⅱ、β-actin抗体(成都正能生物技术有限责任公司);TRPC6抗体(上海钰博生物科技有限公司);CL-8000型全自动生化分析仪(日本Shimadzu公司);CX33型光学显微镜(日本Olympus公司);UC-7型超薄切片机(德国Leica公司)。
1.3 分组和模型制备[10]将50只大鼠随机分为对照组(Control组)、肾病综合征大鼠模型组(NS组)、NS组+卡格列净片干预组(SGLT2i组)、SGLT2i组+Ang Ⅱ干预组(SGLT2i+Ang Ⅱ组)、SGLT2i+Ang Ⅱ组+SAR7334干预组(SGLT2i+Ang Ⅱ+SAR7334组),每组10只。除Control组外,其余各组大鼠制备NS模型,单次用阿霉素溶液以7.5 mg/kg的计量于尾静脉内注射,Control组大鼠尾静脉注射等容积的生理盐水。注射7 d后进行24 h尿蛋白定性,在++或以上提示模型制备成功。观察各大鼠生长情况6周,动态监测24 h尿蛋白定量(24 h HUPQ)及其他生化指标。
制备模型成功后24 h,按照人与大鼠用药量换算方法,SGLT2i组大鼠清晨空腹灌胃31.5 mg/kg的卡格列净,灌胃量1 mL/100 g,1次/d;SGLT2i+Ang Ⅱ组在SGLT2i组的基础上,尾静脉注射10 μmol/L Ang Ⅱ干预,1次/周;SGLT2i+Ang Ⅱ+SAR7334组在SGLT2i+Ang Ⅱ组的基础上,尾静脉注射10 μmol/L SAR7334,1次/周;Control组和NS组大鼠给予等量的生理盐水干预。各组大鼠均连续给药4周。
1.4 检测24 h尿蛋白定量 各组小鼠在造模成功后7 d、给药后2、4周时,将小鼠置于代谢笼中,大鼠均禁食,但不禁水,分别收集各组大鼠24 h尿液并记录,采用生化自动检测仪检测小鼠24 h尿蛋白定量。
1.5 生化指标检测 麻醉各组大鼠,腹主动脉取血5 mL,在4 ℃环境中,以3 000 r/min速度离心10 min,分离血浆,采用全自动生化分析仪检测大鼠血清中ALB、尿素氮(BUN)、肌酐(SCr)、总蛋白(TP)、总胆固醇(TC)、甘油三酯(TG)水平。
1.6 HE染色检测肾组织病理学变化 取各组大鼠肾脏组织,部分存于-80 ℃冰箱,剩余肾组织固定于多聚甲醛溶液中24 h,取出肾组织用石蜡包埋,后切片机连续切片肾组织,切片厚度为4 μm,将组织切片经将苏木素-伊红染色,后中性树脂封片肾组织切片,于显微镜下观察组织切片病理学变化。
1.7 透射电镜观察肾脏显微结构 取1.6中新鲜的肾组织标本,浸泡于2.5%戊二醛中,PBS冲洗肾组织,经酒精梯度脱水后,石蜡包埋组织,超薄切片机连续切片组织,厚度为40~60 nm,用醋酸铀染色组织切片,漂洗组织切片,干燥箱干燥组织切片,将组织切片置于电镜下,观察足细胞足突超微结构形态,并计算足突触融合率。
1.8 ELISA检测血浆中Ang Ⅱ和CaN含量 取1.5中腹主动脉血,分别加入各抗体孵育24 h,后置于抗兔免疫分离机中,在室温环境中放置15 min,于离心机3 500 r/min速度离心15 min;弃掉上清液,测定血浆中Ang Ⅱ和钙调神经磷酸酶(CaN)含量。
1.9 蛋白质印迹法检测肾组织中Ang Ⅱ、TRPC6、cas pase-3蛋白表达 取各组大鼠肾组织织50 mg,将脑组织充分剪碎,用EP管收集粉末并用RIPA裂解液裂解,在冰上迅速研磨组织,静置后收集上清液,根据蛋白试剂盒说明提取脑组织中总蛋白。将蛋白上样缓冲液加入到总蛋白中,煮沸使其变性,经SDS-PAGE后湿转膜,用脱脂奶粉在室温孵育1 h封闭蛋白,后加入一抗兔抗大鼠Ang Ⅱ、TRPC6(1∶1 000),兔抗大鼠caspase-3(1∶1 000),内参β-actin(1∶2 000);在4 ℃环境中孵育一抗过夜,TBST洗膜后加入山羊抗兔二抗(1∶5 000),孵育二抗2 h后TBST洗膜,用化学发光剂显影曝光,采用Image J软件分析蛋白灰度值。

2 结果
2.1 各组大鼠24 h尿蛋白定量比较 与Control组相比,NS组、SGLT2i组、SGLT2i+Ang Ⅱ组和SGLT2i+Ang Ⅱ+SAR7334组大鼠在造模成功7 d后、药物干预2、4周时24 h尿蛋白定量均明显升高(P<0.05);在给药造模成功7 d后时NS组、SGLT2i组、SGLT2i+Ang Ⅱ组和SGLT2i+Ang Ⅱ+SAR7334组大鼠24 h尿蛋白定量相比无明显差异(P>0.05);与NS组相比,SGLT2i组大鼠给药后2、4周时24 h尿蛋白定量明显降低(P<0.05);与SGLT2i组相比,SGLT2i+Ang Ⅱ组大鼠给药后2、4周时24 h尿蛋白定量明显升高(P<0.05);SGLT2i+Ang Ⅱ+SAR7334组给药后2、4周时24 h尿蛋白定量明显低于SGLT2i+Ang Ⅱ组(P<0.05,表1)。
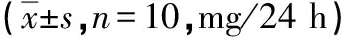
表1 各组大鼠24 h尿蛋白定量比较
2.2 各组大鼠生化指标比较 与Control组相比,NS组大鼠ALB、TP含量明显降低,BUN、SCr、TC、TG含量明显升高(P<0.05);与NS组相比,SGLT2i组大鼠ALB、TP含量升高,BUN、SCr、TC、TG含量明显降低(P<0.05);与SGLT2i组相比,SGLT2i+Ang Ⅱ组大鼠ALB、TP含量明显降低,BUN、SCr、TC、TG含量明显升高(P<0.05);与SGLT2i+Ang Ⅱ组相比,SGLT2i+Ang Ⅱ+SAR7334组大鼠ALB、TP含量升高,BUN、SCr、TC、TG含量明显降低(P<0.05,图1)。

A:ALB含量比较;B:BUN含量比较;C:SCr含量比较;D:TP含量比较;E:TC含量比较;F:TG含量比较;a:与Control组比较,P<0.05;b:与NS组比较,P<0.05;c:与SGLT2i组比较,P<0.05;d:与SGLT2i+Ang Ⅱ组比较,P<0.05。
2.3 各组大鼠肾组织病理学变化比较 Control组大鼠肾小球结构清晰,肾小球无明显病理变化;NS组大鼠肾组织病理改变明显,肾小球系膜增生严重,毛细血管有折叠现象,基底膜厚度明显增加,系膜区有大量的炎性细胞浸润;SGLT2i组大鼠肾组织较NS组明显改善,症状较NS组均明显减轻;与SGLT2i组相比,SGLT2i+Ang Ⅱ组肾组织有明显的病理学变化,和NS组相似;与SGLT2i+Ang Ⅱ组相比,SGLT2i+Ang Ⅱ+SAR7334组大鼠肾组织病理学变化有所改善,症状有所减轻(图2)。

A:Control组;B:NS组;C:SGLT2i组;D:SGLT2i+Ang Ⅱ组;E:SGLT2i+Ang Ⅱ+SAR7334组;HE染色,×200。
2.4 各组大鼠足细胞超微结构比较 Control组大鼠足细胞结构无明显变化,未见明显的足细胞融合;NS组大鼠足细胞排列紊乱,足突融合率明显高于Control组(P<0.05);与NS组相比,SGLT2i组大鼠足细胞排列、足突融合及基底膜和内皮细胞均明显改善,且足突融合率明显降低(P<0.05);与SGLT2i组相比,SGLT2i+Ang Ⅱ组足细胞结构紊乱,足突融合率明显增加(P<0.05);SGLT2i+Ang Ⅱ+SAR7334组足细胞排列、足突融合及基底膜和内皮细胞明显好于SGLT2i+Ang Ⅱ组,足突融合率低于SGLT2i+Ang Ⅱ组(P<0.05,图3)。

A:Control组;B:NS组;C:SGLT2i组;D:SGLT2i+Ang Ⅱ组;E:SGLT2i+Ang Ⅱ+SAR7334组;F:各组大鼠足突融合率比较;a:与Control组比较,P<0.05;b:与NS组比较,P<0.05;c:与SGLT2i组比较,P<0.05;d:与SGLT2i+Ang Ⅱ组比较,P<0.05;×20 000。
2.5 各组大鼠血浆中Ang Ⅱ和CaN含量比较 与Control组相比,NS组大鼠血清中Ang Ⅱ和CaN含量明显增加(P<0.05);与NS组相比,SGLT2i组大鼠血清中Ang Ⅱ和CaN含量明显降低(P<0.05);与SGLT2i组相比,SGLT2i+Ang Ⅱ组大鼠血清中Ang Ⅱ和CaN含量明显增加(P<0.05);与SGLT2i+Ang Ⅱ组相比,SGLT2i+Ang Ⅱ+SAR7334组大鼠血清中Ang Ⅱ和CaN含量明显降低(P<0.05,图4)。
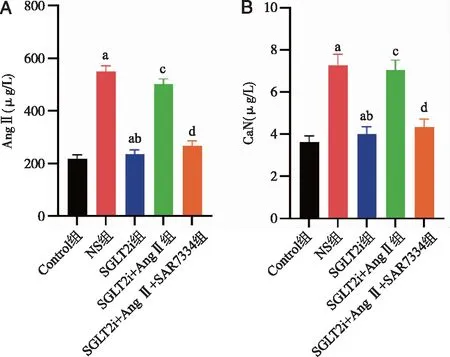
A:各组大鼠血浆中Ang Ⅱ含量比较;B:各组大鼠血浆中CaN含量比较;a:与Control组比较,P<0.05;b:与NS组比较,P<0.05;c:与SGLT2i组比较,P<0.05;d:与SGLT2i+Ang Ⅱ组比较,P<0.05。
2.6 各组大鼠肾组织中Ang Ⅱ、TRPC6、cleaved-caspase 3蛋白表达比较 与Control组相比,NS组大鼠肾组织中Ang Ⅱ、TRPC6、cleaved-caspase 3蛋白表达明显增加(P<0.05);与NS组相比,SGLT2i组大鼠肾组织中Ang Ⅱ、TRPC6、cleaved-caspase 3蛋白表达明显降低(P<0.05);与SGLT2i组相比,SGLT2i+Ang Ⅱ组大鼠肾组织中Ang Ⅱ、TRPC6、cleaved-caspase 3蛋白表达升高(P<0.05);SGLT2i+Ang Ⅱ+SAR7334组大鼠肾组织中Ang Ⅱ、TRPC6、cleaved-caspase 3蛋白表达明显低于SGLT2i+Ang Ⅱ组(P<0.05,图5)。

A:肾组织中Ang Ⅱ、TRPC6、cleaved-caspase 3蛋白条带;B:肾组织中Ang Ⅱ蛋白表达比较;C:肾组织中TRPC6蛋白表达比较;D:肾组织中cleaved-caspase 3蛋白表达比较;a:与Control组比较,P<0.05;b:与NS组比较,P<0.05;c:与SGLT2i组比较,P<0.05;d:与SGLT2i+Ang Ⅱ组比较,P<0.05。
3 讨论
目前,临床多采用糖皮质激素及细胞毒药物治疗肾病综合征[11]。但由于部分肾病综合征患者对激素类药物的敏感性较低,还有部分患者因且长时间服用产生依赖而停药等因素,从而导致疾病再次复发;细胞毒性药物也有较大的不良反应,真菌感染和器官毒性会导致其治疗受到一定的临床限制。因此,探寻治疗NS的有效药物是临床研究的热点。
阿霉素可通过导致肾脏损伤诱发NS,由于该方法简便、具有很好的重现性,同时能很好的模拟肾病综合征等肾脏疾病的发病机制,因此该造模方法被学者们广泛应用[12]。NS发生时肾小球滤过功能损伤,大量白蛋白会从尿排出形成蛋白尿,是肾脏疾病常见的临床表现之一。当尿液中蛋白的含量上升是肾脏滤过功能受损的主要现象,同时也预示着其他肾脏疾病的发生。研究发现[13],总甘油三酯与总胆固醇升高代表肾脏血液流变异常。血肌酐和尿素氮作为机体蛋白质的代谢产物,其浓度可有效反应肾小球滤过功能。本研究结果显示,阿霉素诱导的NS模型大鼠24 h 尿蛋白定量、BUN、SCr、TC、TG含量均明显升高,且通过HE染色和透射电镜证实大鼠肾组织明显损伤,提示本研究成功制备了NS大鼠模型。
文献显示[14],SGLT2i不仅能降低血糖,且对肾脏还具有独立的保护作用。SGLT2i可通过降低尿蛋白治疗NS等慢性肾病,其机制是对钠-葡萄糖协同转运蛋白2发挥抑制作用,从而阻断近端小管对Na+的摄取,最终降低肾小球内高血压。本研究结果显示,SGLT2i组大鼠24 h 尿蛋白定量、BUN、SCr、TC、TG含量均明显降低,且肾组织病理学变化减轻,足突融合率降低,提示SGLT2i可降低肾病综合征大鼠24 h尿蛋白定量,并改善肾组织。洪文娟等[15]研究证实,SGLT2i可通过降低NS大鼠尿蛋白而治疗NS,治疗过程中可导致骨盆骨密度下降。
Ang Ⅱ是RAS系统中最具生物活性的一种物质,其对全身的血流动力学可发挥调控作用[16]。当Ang Ⅱ结合其受体AT1R时,可引发系膜细胞肥大并启动凋亡,通过增加TNF-β表达而引发肾小球高血压、缺血缺氧,从而激发蛋白尿。TRPC6可和多种足细胞蛋白互相联系,对足细胞的Ca2+内流可发挥调控作用,进而介导信号转导和维持足细胞正常功能[17]。在病理状态下,TRPC6的过度激活会引发细胞的环境紊乱,从而导致足细胞蛋白表达异常,甚至增加足细胞的异常凋亡[18]。CaN是介导钙信号转导的丝氨酸蛋白磷酸酶之一,可参与Ca2+内流的调控[19-20]。本研究结果显示,NS大鼠肾组织中Ang Ⅱ、TRPC6、caspase-3表达明显增加,血浆中CaN含量增加,由此提示NS发生时,肾脏缺血而激活RAS系统,使以Ang Ⅱ为主的RAS分子过表达于肾局部组织,通过激活TRPC6而增加CaN表达,导致钙离子过度内流,同时胞内钙离子瞬时超载,激活凋亡蛋白表达,从而引发损伤。SGLT2i组大鼠肾组织中Ang Ⅱ、TRPC6、caspase-3蛋白表达明显减少,CaN含量降低,提示SGLT2i可抑制肾病综合征大鼠肾组织中Ang Ⅱ和TRPC6表达。因此猜测肾组织中Ang Ⅱ和TRPC6表达和SGLT2i改善肾病综合征有关,本研究将SGLT2i和Ang Ⅱ共同干预NS大鼠,发现Ang Ⅱ可逆转SGLT2i对NS大鼠的改善作用。且通过SGLT2i、Ang Ⅱ和TRPC6通道的特异性拮抗剂SAR7334共同干预NS大鼠,发现SAR7334可改善Ang Ⅱ对SGLT2i治疗的逆转作用。由此证实,SGLT2i可通过调控Ang Ⅱ/TRPC6通路保护肾病综合征大鼠肾功能。
综上所述,SGLT2i可降低肾病综合征大鼠尿蛋白,改善肾组织病理学变化和生化功能,对肾组织可发挥保护作用,其作用机制可能和抑制肾组织中Ang Ⅱ/TRPC6通路有关。
