穗花杉双黄酮对急性心肌梗死大鼠心肌纤维化的影响
2023-08-02陈文明陈嘉敏蹇明辉
陈文明,陈嘉敏,蹇明辉
(遵义医科大学附属医院 1.心血管内科,2.儿科,3.呼吸与危重症医学科,贵州 遵义 563099)
目前,急性心肌梗死(acute myocardial infarction, AMI)是心血管系统最常见、最危重的急症之一,病情发展迅速且死亡率较高[1]。近年来,随着经皮冠状动脉介入治疗和溶栓治疗得到不断的发展,心肌梗死的救治成功率得到了显著提高,但梗死后心肌的损伤以及心室的重构严重影响心肌正常的舒缩功能[1-2]。因此,如何减轻心肌梗死患者的心肌损伤、改善心功能显得尤为重要。近年来研究表明,中药在心肌梗死方面的研究取得不错的效果。含有黄酮类化合物的中草药是中医药防治心血管疾病的主要选择之一。石上柏含有多种生物活性成分,包括双黄酮、生物碱和有机酸等化合物,其中穗花杉双黄酮是石上柏中主要的双黄酮类化合物,具有抗炎、抗氧化、抗病毒及改善心脑血管的药理作用[3-4]。有文献报道,穗花杉双黄酮对心肌缺血再灌注损伤有保护作用[5],那么其对AMI是否有影响。基于此,本文通过建立大鼠AMI模型,探究穗花杉双黄酮对AMI模型大鼠心功能及心肌纤维化的影响,为穗花杉双黄酮应用于临床提供新的实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取健康雄性Sprague Dawley大鼠60只,体重为(300±20)g,由遵义医科大学实验动物中心提供,动物使用合格证号:SYXK(黔)2021-0004。动物饲养于安静、通风良好和有空气过滤系统的环境中,动物饲养室内温度:(22.0±2.0)℃,相对湿度:(40.0±5.0)%。本实验遵守实验动物福利与伦理有关准则。动物伦理委员会批准号:KLL-2021-128。
1.1.2 主要试剂与仪器 穗花杉双黄酮(纯度>98%,批号:160523)购自成都瑞芬恩科技有限公司;Ⅰ型前胶原蛋白的羧基末端肽(carboxy-terminal peptide of type Ⅰ procollagen, PⅠCP)、Ⅲ型前胶原蛋白的氨基末端肽(amino terminal peptide of type Ⅲ procollagen, PⅢNP)试剂盒、兔抗转化生长因子-β1(transforming growth factor-β1, TGF-β1),基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)多克隆抗体等均购于成都海利源生物科技有限公司;MMP-2和TGF-β1引物、Real-Time PCR试剂盒和RNA逆转录试剂盒均购于宝生物工程(大连)有限公司;IX-73型显微镜购自日本 OLYMPUS公司;PowerPac通用电泳仪购自美国BIO-RAD公司;iE33型心脏超声仪购自Philips公司;ALC-V8S-621型小动物呼吸机购自上海奥尔特公司;CFX96 型PCR仪购自美国BIO-RAD公司。
1.2 方法
1.2.1 实验动物分组 将大鼠随机分为假手术组,模型组,穗花杉双黄酮低剂量组(50 mg/kg),穗花杉双黄酮高剂量组(100 mg/kg),每组15只(n=15,其中用于HE和Masson染色,n=5;用于mRNA和蛋白检测,n=10)。穗花杉双黄酮的给药剂量是依据文献[5],并结合前期的预实验来确定。采用左前降支冠状动脉结扎法建立心肌梗死模型,建模成功后,待大鼠清醒后,当天开始灌胃给药,假手术和模型两个组给予等量生理盐水,连续28 d。
1.2.2 建立心肌梗死模型 本实验大鼠AMI模型制备参照本课题组前期的实验方法[6]。大鼠用异氟烷吸入麻醉,然后固定于手术台上,剪开颈部皮肤,行气管分离,剪开气管,气管插管后固定,连接小型动物呼吸机。设置呼吸机参数,潮气量:12 mL/kg,呼吸频率:30~45次/min,吸呼频率比为1∶1。四肢皮下插入电极,连接BL-420E生物机能实验系统,观察标准导联心电图(Ⅱ导联)。于胸骨左缘第3、4肋间打开胸腔,撕开心包,使心脏充分暴露;于肺动脉圆锥与左心耳根部交叉点顺左冠状静脉下方约1 mm处为结扎点,用6.0的无损伤缝合线结扎左冠脉前降支(进针深度约1.5 mm),结扎冠脉供血区域心肌因缺血而变苍白,心电图II导联ST段明显抬高和出现Q波,则模型建立成功。为了预防感染,术后5 d内,每天给予大鼠肌肉内注射青霉素30万U。假手术组仅在大鼠心脏左冠脉前降支同一位置穿线,不结扎,其余操作方法同上。
1.2.3 心功能测定 给药处理28 d后,麻醉大鼠,用心脏超声仪对大鼠心脏进行检测并记录左室收缩末内径(left ventricular end systolic dimension, LVESD)、左室舒张末内径(left ventricular end diastolic dimension, LVEDD)、左室缩短分数(left ventricular fractional shortening, LVFS)和左室射血分数(left ventricular ejection fraction, LVEF)连续检测 3 次心脏周期,计算平均值[6]。
1.2.4 用酶联免疫吸附法(enzyme-linked immun osorbent assay, ELISA)测定血清中胶原代谢产物PⅠCP和PⅢNP的表达水平 给药处理28 d后,麻醉大鼠,分离颈总动脉,采取动脉血,将其离心处理后,收集血清,根据ELISA 试剂盒方法检测血清中胶原代谢产物PⅠCP和PⅢNP的表达水平[6]。
1.2.5 苏木精-伊红(hematoxylin eosin, HE)、Masson染色 大鼠经颈总动脉采血后,快速打开胸腔,于下腔静脉注射10%氯化钾(3 mL/kg),使心脏在舒张期停搏后,取出心脏,放置于4%多聚甲醛固定24 h,然后进行石蜡包埋。石蜡经切片后,进行HE和Masson染色。在显微镜下观察心肌形态学变化和心肌纤维化程度,每张切片分别选取4~6个不重复视野并于高倍镜下拍照[6]。
1.2.6 Real-time PCR检测MMP-2和TGF-β1的mRNA表达情况 大鼠经颈总动脉采血后,快速打开胸腔,取出大鼠心脏,去除发白梗死区域部分,留取心脏梗死边缘区心肌组织。用TRIzol试剂提取心肌组织中总RNA,然后用PrimeScript RT试剂盒逆转录成cDNA。使用Bio-Rad CFX96定量PCR系统和SYBR green mix进行RT-PCR。PCR的条件包括:95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火30 s,使用GAPDH进行归一化,采用2(-ΔΔCt)方法进行统计[7]。引物序列(表1)。

表1 引物序列
1.2.7 使用蛋白质免疫印迹(Western blot)法检测MMP-2、TGF-β1的蛋白表达情况 大鼠经颈总动脉采血后,快速打开胸腔,取出大鼠心脏,去除发白梗死区域部分,留取心脏梗死边缘区心肌组织。用含有蛋白酶抑制剂的组织裂解液裂解心肌组织,提取总蛋白。用二喹啉甲酸(bicinchoninic acid, BCA)法检测心肌组织蛋白浓度,确定蛋白质上样量后,通过凝胶电泳对蛋白质进行分离;用湿转法将分离的蛋白质转移至聚偏氟乙烯膜上;在室温条件下,用5%脱脂奶粉封闭 1 h;加入稀释的一抗(MMP-2和TGF-β1按1∶200稀释、GAPDH按1∶1 000稀释)溶液,4 ℃孵育过夜;加入二抗溶液,在室温条件下孵育1 h,加入化学发光剂,采用全自动凝胶成像系统进行拍照,利用 Gel-Pro analyzer软件分析目的蛋白的表达变化。

2 结果
2.1 AMI大鼠心电图变化 心电图结果显示:与假手术相比,模型组大鼠心电图ST 段抬高,呈“弓背向上”型,说明大鼠急性心肌梗死模型建立成功(图1)。
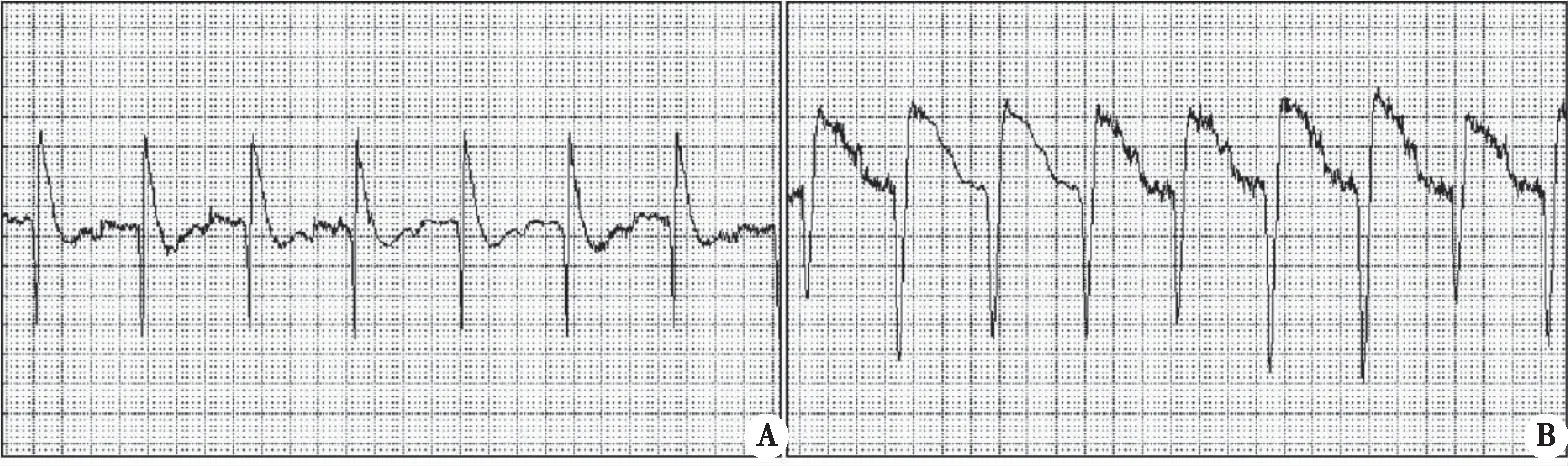
A:假手术组;B:模型组。
2.2 穗花杉双黄酮对AMI大鼠心功能及相关指标的影响 心脏超声结果显示,与假手术组比较,模型组大鼠左心室前壁运动明显减弱,室壁明显变薄,左心室腔径明显增大,LVEF、LVFS值明显降低(P<0.05),LVESD、LVEDD值显著升高(P<0.05),心功能恶化;与模型组比较,穗花杉双黄酮低、高剂量组大鼠左心室前壁运动显著增强,室壁明显增厚,腔径显著缩小,扩张程度明显减轻,LVEF、LVFS值显著升高(P<0.05),LVESD、LVEDD值明显降低(P<0.05),心功能明显改善(图2、表2)。
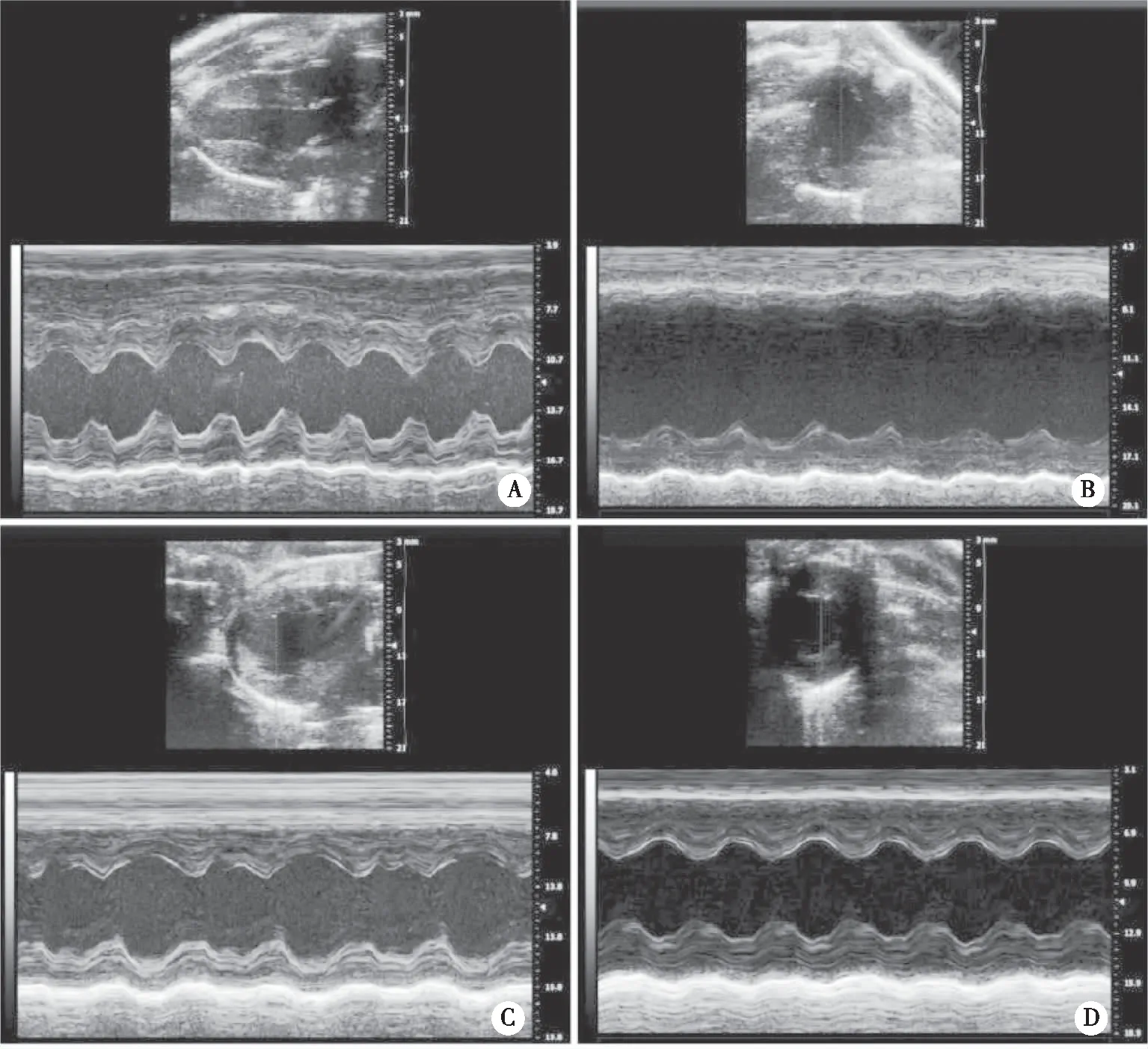
A:假手术组;B:模型组;C:穗花杉双黄酮低剂量组;D:穗花杉双黄酮高剂量组。

表2 穗花杉双黄酮对AMI大鼠LVEF、LVFS、LVEDD和LVESD的影响
2.3 穗花杉双黄酮对AMI大鼠心肌形态结构的影响 HE染色结果显示,与假手术组比较,模型组大鼠心脏梗死区域心肌组织大多被瘢痕组织所替代,细胞核发生固缩或溶解,存活的心肌细胞较少,呈排列松散、凌乱状态;与模型组相比,穗花杉双黄酮低、高剂量组大鼠左心室梗死区域心肌瘢痕组织明显减少,存活心肌细胞明显增多(图3)。
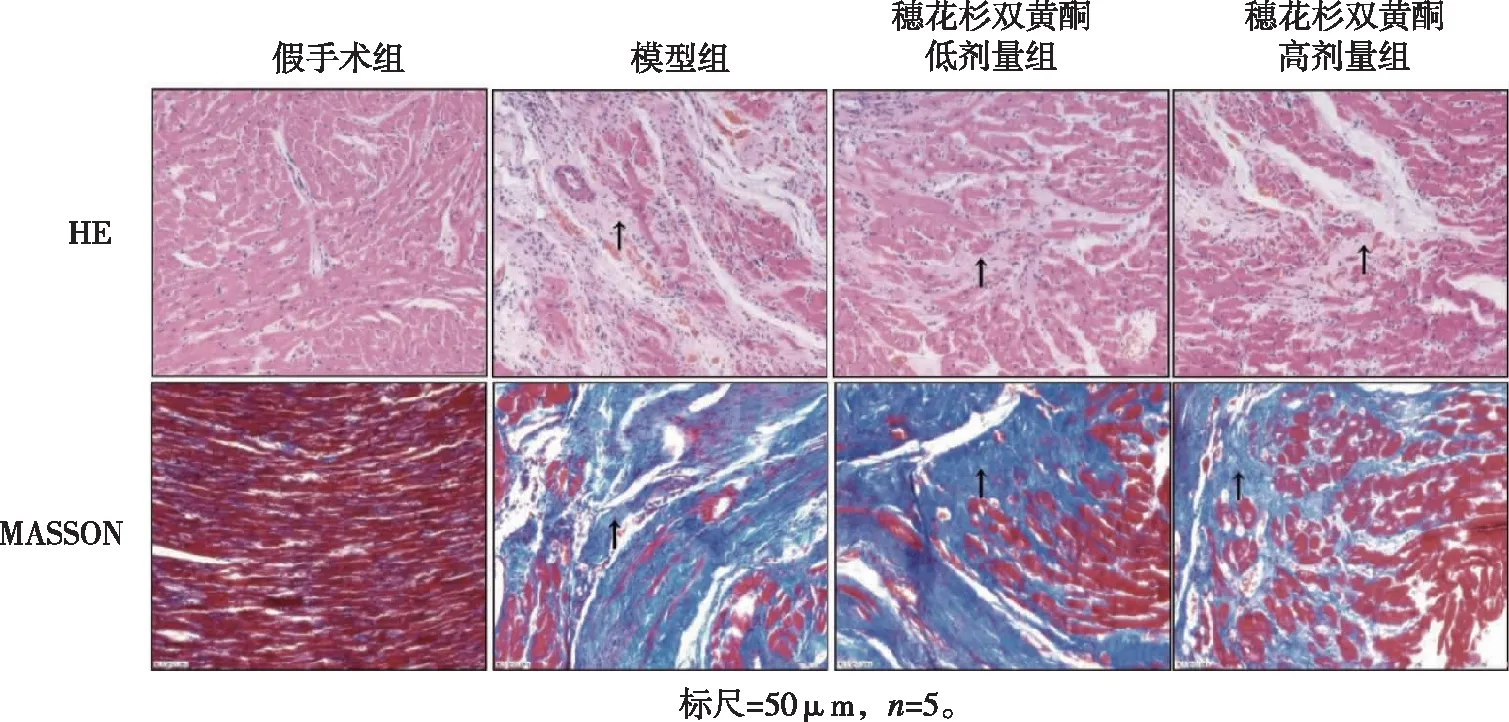
图3 穗花杉双黄酮对AMI大鼠心肌形态结构的影响
Masson 染色结果显示,与假手术组比较,模型组大鼠左心室梗死区有大量的蓝色胶原纤维,呈条索状,部分胶原纤维融合;与模型组比较,穗花杉双黄酮低、高剂量组大鼠左心室梗死区域蓝色胶原纤维明显减少(图3)。
2.4 穗花杉双黄酮对AMI大鼠血清中PⅠCP和PⅢNP表达的影响 ELISA检测结果显示,与假手术组比较,模型组大鼠血清中PⅠCP和PⅢNP蛋白水平均增强(P<0.05);与模型组比较,穗花杉双黄酮低、高剂量组大鼠血清中PⅠCP和PⅢNP蛋白浓度明显降低(P<0.05,表3)。
表3 穗花杉双黄酮对AMI大鼠血清中PⅠCP和PⅢNP表达的影响
2.5 穗花杉双黄酮对AMI大鼠心肌组织MMP-2和TGF-β1的mRNA表达水平的影响 Real-time PCR检测结果显示,与假手术组相比,模型组大鼠心肌组织MMP-2和TGF-β1的mRNA表达水平显著升高(P<0.05);与模型组比较,穗花杉双黄酮低、高剂量组大鼠心肌组织MMP-2和TGF-β1的mRNA表达水平显著降低(P<0.05,表4)。

表4 穗花杉双黄酮对AMI大鼠心肌组织MMP-2和TGF-β1 mRNA表达水平的影响
2.6 穗花杉双黄酮对AMI大鼠心肌中MMP-2和TGF-β1的蛋白表达水平的影响 Western blot检测结果显示,与假手术组相比,模型组大鼠心肌梗死边缘区MMP-2和TGF-β1的蛋白水平显著升高(P<0.05);与模型组比较,穗花杉双黄酮低、高剂量组大鼠心肌梗死边缘区MMP-2和TGF-β1的蛋白水平显著降低(P<0.05,图4、表5)。

图4 穗花杉双黄酮对AMI大鼠心肌中MMP-2和TGF-β1的蛋白水平的影响

表5 穗花杉双黄酮对AMI大鼠心肌中MMP-2和TGF-β1蛋白水平的影响
3 讨论
研究数据显示,心血管疾病仍是全球死亡的主要原因之一,约有1 790万人死于心血管疾病,占全球死亡人数的31%[8]。据估计,到 2030 年死亡人数将增加到 2 360 万以上[9]。AMI为一种严重的心血管疾病,是引起心源性休克的主要原因,占80%以上[10]。AMI后引起不同程度的左心室重构,常使冠脉血流量减少,心肌纤维化加剧,心功能恶化,使患者的临床症状和预后无根本改善[11]。AMI 后的心肌纤维化对患者的生存至关重要。因此,延缓或预防心肌纤维化是防治AMI后心室重构和心力衰竭的关键。
目前,在临床上,心脏超声是评估心功能的常规方法,在心肌梗死的诊断中扮演着非常重要的角色[2]。在本研究中,心动超声图结果所示,在造模28 d后,大鼠左心室室壁运动幅度、室壁厚度明显低于正常大鼠,且LVESD、LVEDD值明显升高,LVEF值明显降低,与以往研究一致[6];连续给予穗花杉双黄酮处理 28 d后,发现大鼠心肌梗死后左心室室壁运动幅度明显增强,室壁增厚,LVESD、LVEDD值明显降低,LVEF值明显回升,表明穗花杉双黄酮可有效改善心肌梗死后大鼠的心功能。
心肌梗死后,受损的心肌组织在缺血缺氧条件下,引起局部心肌细胞发生凋亡,增强了心肌成纤维细胞的增殖能力,以胶原纤维为主的细胞外基质增多,并过量沉积,各型胶原比例失调,导致心肌纤维化的发生[12]。心肌纤维化过程同时伴随着多种心肌胶原代谢相关产物(如:PⅠCP、PⅢNP等)的增加。PⅠCP和 PⅢNP 是心肌Ⅰ型和Ⅲ型胶原的前体多肽,是前胶原转换为胶原过程中脱离前胶原的游离肽段,其随胶原纤维合成的增加而增加[12]。近年来研究表明,在大鼠心肌梗死模型血清中PⅠCP 和PⅢNP的表达高于正常对照组[6],另外,在心肌梗死患者PⅠCP 和PⅢNP的表达也明显高于正常人群[13]。本研究结果发现,模型组大鼠血清中PⅠCP 和PⅢNP表达明显高于假手术组,在连续给予穗花杉双黄酮处理 28 d后,心肌梗死大鼠血清中PⅠCP 和PⅢNP表达明显降低,结合HE染色结果,表明穗花杉双黄酮能抑制大鼠心肌梗死后心肌纤维化。
心肌梗死后,神经体液发生异常,进而刺激心肌细胞、成纤维细胞、肌成纤维细胞合成分泌基质金属蛋白酶(matrix metalloproteinase,MMP)[14-15]。MMP被丝氨酸蛋白酶、纤溶酶、胰蛋白酶、弹性蛋白酶、激肽及组织蛋白酶G等激活后降解基质胶原,使心肌失去基质胶原支持并出现排列紊乱。有研究表明,MMP2在心肌梗死后迅速上调,加速胶原代谢,促进心肌纤维化[15]。在心肌纤维化过程中,TGF-β1参与了调节心脏成纤维细胞的增殖、转化、迁移和细胞外基质的产生[16]。本研究结果发现,模型组大鼠心肌组织中MMP-2、TGF-β1的mRNA和蛋白表达水平明显高于假手术组,在连续给予穗花杉双黄酮处理28 d 后,发现心肌组织中MMP-2、TGF-β1的mRNA和蛋白表达水平均呈不同程度的降低。表明穗花杉双黄酮能降低大鼠心肌梗死后心肌纤维化可能与下调MMP-2、TGF-β1的表达有关。
综上所述,穗花杉双黄酮能够改善心肌梗死大鼠心肌纤维化,进而改善心功能,该作用可能与抑制MMP-2、TGF-β1的表达有关。
