MALAT1参与非小细胞肺癌厄洛替尼耐药的体内实验研究
2023-08-02刘晓曦刘大海何思思周建国柏玉举
刘晓曦,罗 杰,刘大海,何思思,周建国,柏玉举,马 虎
(1.遵义医科大学 第一临床学院,贵州 遵义 563099;2.遵义医科大学附属医院 规培科,贵州 遵义 563099;3.遵义医科大学第二附属医院 胸部肿瘤科,贵州 遵义 563006)
癌症是全球主要死亡原因之一[1],据中国癌症登记年报2022年数据显示,目前我国最常见的恶性肿瘤仍是肺癌,同时也是中国癌症死亡的最主要原因[2]。根据病理学类型通常将肺癌分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC),其中NSCLC约占肺癌的85%[1]。近年来随着医学技术的发展,分子靶向治疗(molecular targeted therapy)已广泛应用于各种恶性肿瘤,基于其在临床中取得的显著疗效,成功地开创了晚期恶性肿瘤精准治疗的新时代,特别是携带EGFR突变的分子靶向治疗更为常见[3]。在驱动基因突变的晚期NSCLC患者一线使用疗效显著优于传统化疗[4]。近年来用于EGFR突变IB-IIIA期NSCLC患者的术后辅助治疗[5]也获得不俗的疗效而被多个国家指南推荐使用。但不幸的是用药过程中均不可避免出现耐药,进一步探索EGFR-TKIs耐药的机制,找到特异性的耐药靶点从而克服耐药的发生成为临床之需。
近来诸多的研究证明LncRNA对于调控肿瘤的发生发展和耐药起着极其重要的作用[6-7],大量证据表明LncRNA 可参与 microRNA(miRNA)功能的调控[8-9],而miRNA能够在转录后水平对其靶基因进行负调控[10]。国内外研究证实,miRNA 不但在维持癌干细胞恶性表型中起重要作用,在耐药调控中也扮演着十分重要的角色[11-12]。有研究发现 MALAT1 可调节 miR-125a-5p的表达促进肿瘤干细胞的功能从而影响肿瘤的发生发展[13-14]。
我们在前期研究中发现MALAT1在肺腺癌耐药细胞中高表达而miR-125a-5p低表达,同时Rab25表达上调,并且运用双荧光素酶报告基因系统验证了MALAT1与miR-125a-5p有直接结合位点,Rab25基因是miR-125a-5p直接作用的靶基因,进一步发现MALAT1通过调控miR-125a-5p及其靶基因Rab25参与第一代EGFR-TKI耐药[15-17]。本研究通过将过表达MALAT1的PC9细胞注入裸鼠皮下成瘤,在体内发现MALAT1通过调控miR-125a-5p及其靶基因Rab25参与第一代EGFR-TKI耐药,有望为逆转NSCLC的厄洛替尼耐药提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 实验动物 BALB/c-nu雄性裸鼠,4周龄,14~16 g,SPF级包装,均购自北京华阜康生物科技股份有限公司(许可证号为 SCXK(京)2019-0008),分为两组,A组接种PC9 细胞,B组接种PC9-MALAT1细胞(每组5只)。裸鼠饲养条件:于遵义医科大学基础药理教育部重点实验室SPF级动物房[许可证号:SYXK(黔)2018-0005],12 h/12 h昼夜交替,室温(23±1)℃,湿度50%~60%,实验期间自由获取水和食物。本实验已获遵义医科大学动物伦理委员会批准(编号:伦审[2016]1-002号)。
1.1.2 材料 人肺腺癌PC9细胞(EGFR 19外显子缺失突变且对厄洛替尼敏感)惠赠于重庆陆军军医大学,经SAM(synergistic activasion mediator)双载体(上海吉凯基因医学科技股份有限公司)技术过表达MALAT1的PC9细胞(PC9-MALAT1)由本课题组构建。SAM技术是通过两个慢病毒分别向细胞中导入dCAS9-VP64蛋白和sgRNA-MS2-P65-HSF1序列表达框,从而实现对目的基因的过表达,其中CAS9蛋白载体用嘌呤霉素标记,sgRNA带有新霉素抗性。RPMI 1640培养基(美国Hyclon公司);厄洛替尼(Erlotinib上海腾准生物科技有限公司);PBS缓冲液、胰蛋白酶、青链霉素、谷氨酰胺(北京索莱宝科技有限公司);RNAiso Plus试剂盒、qRT-PCR试剂盒(大连TaKaRa生物工程有限公司);二甲苯(成都科龙化工试剂厂);苏木素染液、伊红染色、中性树胶、4%多聚甲醛、RIPA裂解液、PMSF、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶试剂盒、TBS、吐温20(北京索莱宝科技有限公司);牛血清白蛋白(BBI Life Science公司);PVDF膜(0.22 μm)(美国Millipore公司);氯仿、无水乙醇、甲醛、异丙醇(上海化学试剂有限公司);兔抗人Rab25抗体(上海爱必信科技生物有限公司);ECL曝光液(北京索莱宝科技有限公司);3%过氧化氢消毒液(安捷高科消毒科技有限公司);柠檬酸盐抗原修复液、山羊血清、Ki67免疫组化一抗、HRP标记的山羊抗兔二抗、组化试剂盒DAB显色剂(武汉塞维尔生物科技有限公司);CO2孵箱、荧光定量PCR仪、低温高速离心机(赛默飞世尔科技有限公司);稳压稳流电泳仪、曝光仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养及计数收集 人肺腺癌PC9细胞、SAM双载体转染PC9-MALAT1细胞于含10%胎牛血清、1%谷氨酰胺、1%青-链霉素双抗RPMI 1640培养基中培养(孵箱条件:温度37 ℃、相对湿度95%、5% CO2),PC9-MALAT1细胞还需另外加125 μg/mL的新霉素维持。在倒置显微镜下观察细胞生长情况及细胞汇合度,肉眼观察细胞培养基颜色变化来确定是否更换培养基,一般为24~48 h更换1次,更换培养基时,用37 ℃ PBS 4~5 mL将细胞清洗3遍,完全吸尽PBS后再加入新培养基,选择对数期生长良好的细胞收集计数并用生理盐水重悬为5×107个/mL的单细胞悬液。
1.2.2 裸鼠移植瘤模型的建立与移植瘤剥除 将浓度为5×107个/mL的单细胞悬液,对应地接种于A、B组裸鼠的右侧肩部,每只裸鼠接种0.1 mL,A组接种PC9 细胞,B组接种PC9-MALAT1细胞。1周后裸鼠全部成瘤,成瘤率为100%。待移植瘤体积平均达100 mm3予厄洛替尼(50 μg/g)灌胃治疗,灌胃体积为0.1 mL/10 g,每天灌胃1次,连续2周。灌胃处理后正常喂养,每天观察裸鼠生长状态及厄洛替尼的抗肿瘤情况,每2天称量裸鼠体重及测量瘤体长径a及短径b并计算体积V=(a×b2)/2。2周后,颈椎脱臼法处死裸鼠并拍照,完整剥取瘤体,拍照并称量瘤体重量(全程于冰上)。每个移植瘤组织分为3份,其中1份用4%多聚甲醛固定24 h,用于HE染色及免疫组织化学实验,另外2份保存于-80 ℃冰箱中用于相关RNA和蛋白的检测。
1.2.3 裸鼠移植瘤HE染色 10%多聚甲醛固定24 h,脱水后进行石蜡包埋、切片,切片厚度为4 μm,于60 ℃烘箱中烤片30~40 min以备用。经脱蜡、复水、苏木素核染色、盐酸酒精分化、伊红细胞质染色、脱水、二甲苯透明、中性树胶封片,光学显微镜观察肿瘤组织病理类型。
1.2.4 免疫组织化学检测移植瘤中Ki67蛋白表达水平 石蜡切片经脱蜡、复水、3%H2O2阻断内源性过氧化物酶、柠檬酸盐抗原修复、血清封闭、一抗孵育、二抗孵育、滴加辣根酶标记链酶卵白素工作液孵育、DAB显色、苏木素复染细胞核、盐酸酒精分化、脱水中性树胶封片,显微镜镜检,图像采集并用Image J软件进行Ki67蛋白相对表达量分析(设定阈值行阳性区域面积的比值计算相对表达量)。
1.2.5 qRT-PCR检测移植瘤组织中MALAT1、miR-125a-5p、Rab25 mRNA表达水平 称取50 mg各组移植瘤组织,充分研磨后用RNAiso Plus试剂盒提取总RNA并进行逆转录,再将cDNA进行扩增。MALAT1的引物为GAPDH,miR-125a-5p的引物为U6,Rab25的引物为β-actin。MALAT1逆转录分两步,首先在冰上配置逆转录反应体系一(RT-Primer Mix:2 μL、RNase free ddH2O:6 μL、总RNA:4 μL,800 ng)。反应条件:70 ℃ 10 min后在冰上急冷5 min。第1步反应期间在冰上配置好逆转录反应体系二(5×M-MLV Buffer:4 μL、dNTP Mixture:1 μL、RNase Inhibitor:0.5 μL、RTase M-MLV(RNase H-): 0.5 μL、RNase free ddH2O: 2 μL),然后加入到反应后的体系一中混匀进行第2步反应,反应条件:30 ℃ 10 min、42 ℃ 1 h、70 ℃ 15 min。miR-125a-5p及Rab25逆转录反应条件:42 ℃ 15 min、85 ℃ 5 s、4 ℃ ∞。qRT-PCR反应条件:95 ℃ 5 s、95 ℃ 5 s、60 ℃ 30 s,共循环40次,qRT-PCR相关引物及序列见表1。根据2-△△Ct分析法计算各目的基因相对表达量。

表1 qRT-PCR相关引物及序列
1.2.6 Western blot检测移植瘤组织中Rab25蛋白表达变化 称取50 mg移植瘤组织,充分研磨后加裂解液提取总蛋白,并用BCA法测定蛋白浓度。将提取的蛋白溶液与缓冲液混匀后进行煮沸变性、电泳、转膜、封闭、一抗、二抗孵育、洗膜、曝光显影、数据分析采用Quantity One 软件(Bio-Rad Laboratories)对条带的灰度值进行计算,利用目的蛋白灰度值比上β-Actin的灰度值的算法得到样本的蛋白相对值。

2 结果
2.1 过表达MALAT1后移植瘤对Erlotinib的敏感性降低 培养PC9及PC9-MALAT1细胞,接种于裸鼠皮下后裸鼠全部成瘤(成瘤率100%),待移植瘤平均体积达100 mm3用Erlotinib连续灌胃治疗2周(图1)。治疗期间观察移植瘤发现PC9-MALAT1组的移植瘤对厄洛替尼的敏感性比PC9组降低,差异有统计学意义(P< 0.05,图2)。各组之间裸鼠体重变化幅度大不,差异无统计学意义(P> 0.05,图3)。连续灌胃2周后颈椎脱臼法处死裸鼠(图4A),剥离移植瘤瘤体(图4B)。测量PC9+Erlotinib、PC9-MALAT1+Erlotinib组移植瘤体积分别为(207.72±89.75、293.82±85.36)mm3(图4C),移植瘤重量分别为(0.31±0.07、0.41±0.18)g(图4D),表明过表达MALAT1后移植瘤对Erlotinib的敏感性降低,表现为移植瘤体积更大,差异有统计学意义(P< 0.05);重量更重,差异有统计学意义(P< 0.05)。进一步对移植瘤组织进行病理类型鉴定,HE染色显示均为腺癌成分(图5A)。免疫组织化学技术检测移植瘤组织中Ki67的蛋白表达情况, PC9-MALAT1+Erlotinib组较PC9+Erlotinib组Ki67的表达量增加,差异有统计学意义(P< 0.05,图5B)。以上结果说明过表达MALAT1后移植瘤对厄洛替尼治疗的敏感性降低。
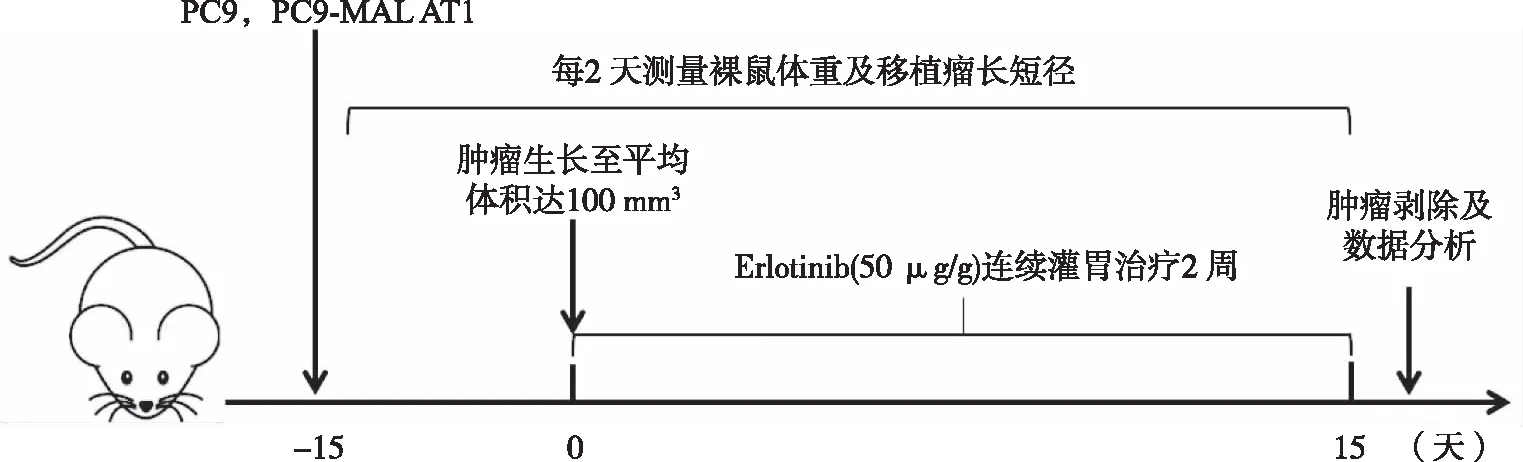
图1 异种移植瘤模型的建立及治疗示意图

*:与PC9+Erlotinib组比较,P < 0.05

A:裸鼠成瘤情况;B:裸鼠成瘤大体标本;C:移植瘤体积;D:移植瘤重量;*:与PC9+Erlotinib组比较,P < 0.05。

A:移植瘤组织HE染色;B:移植瘤组织中Ki67蛋白相对表达量;*:与PC9+Erlotinib组比较,P < 0.05。
2.2 MALAT1过表达抑制移植瘤组织miR-125a-5p及促进Rab25的表达 通过qRT-PCR实验检测移植瘤组织中对应RNA相对表达差异(图6)。MALAT1的表达情况在PC9-MALAT1+Erlotinib组较PC9+Erlotinib 组表达升高,差异有统计学意义(P< 0.05,图6A)。miR-125a-5p表达水平在PC9-MALAT1+Erlotinib组较PC9+Erlotinib组表达降低,差异有统计学意义(P< 0.05,图6B)。Rab25表达水平在PC9-MALAT1+Erlotinib组较PC9+Erlotinib组表达升高,差异有统计学意义(P< 0.05,图6C)。Western blot检测结果显示Rab25在PC9-MALAT1+Erlotinib组较PC9+Erlotinib组表达增加,差异有统计学意义(P< 0.05,图7)。
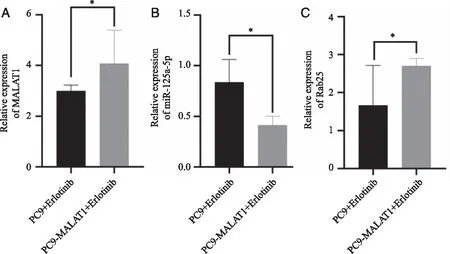
A:MALAT1在移植瘤中的表达;B:miR-125a-5p在移植瘤中的表达;C:Rab25在移植瘤中的表达;*:与PC9+Erlotinib组比较,P< 0.05。
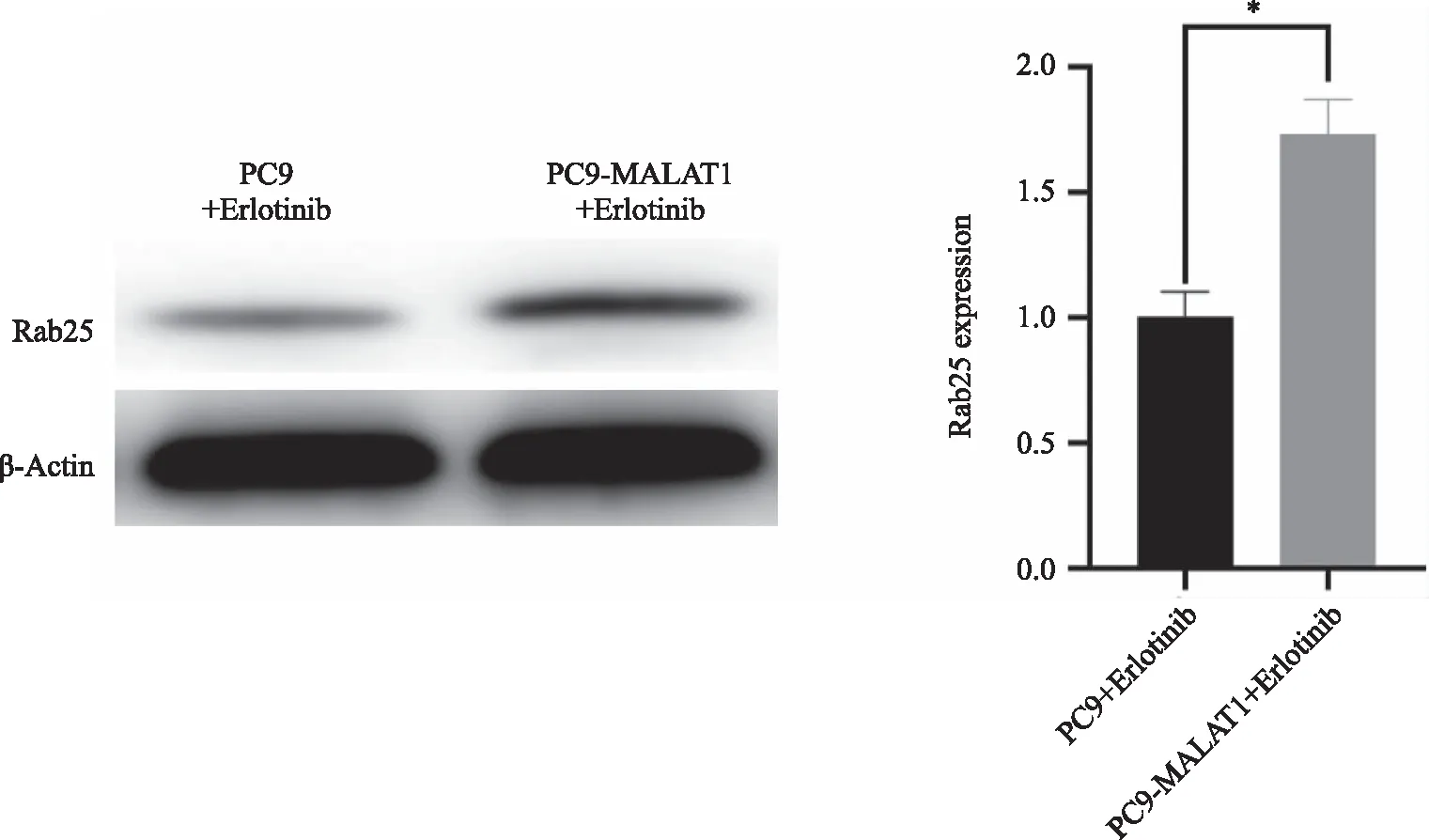
*:与PC9+Erlotinib组比较,P < 0.05。
3 讨论
尽管肺癌分子靶向治疗对基因突变患者有良好的临床疗效和疾病控制率,但这些患者平均在一年左右会出现对EGFR-TKIs的耐药[18],这严重制约其临床疗效,影响了患者的总生存期。通常EGFR-TKIs的耐药分为原发性和继发性,其中原发性耐药占30%左右,而大部分患者都为继发性耐药。原发性耐药是指患者第1次使用就没有疗效,并且其耐药机制研究相对清楚,而继发性耐药通常由EGFR依赖性二次突变(如T790M突变)和EGFR非依赖性(绕过EGFR信号传导的旁路激活和组织学或表型转化的突变等)所导致[3]。其中最常见的EGFR T790M突变占比60%,是EGFR 20号外显子第790位点上的苏氨酸被甲硫氨酸取代,导致氨基酸发生改变后EGFR-TKI对药物的结合作用受限,引起下游相关信号通路的变化,从而产生获得性耐药[19]。目前针对T790M突变患者可口服第三代EGFR-TKIs,包括奥西替尼、伏美替尼及阿美替尼等,可使经EGFR-TKI治疗后出现进展携带T790M突变的NSCLC患者生存获益[20]。而EGFR罕见突变也占到了10%,如Asp761Tyr、Thr854Ala及Leu747Ser等靶点[21]。然而对于第一和/或第二代EGFR-TKIs耐药后目前无明确突变靶点的NSCLC肺癌患者,寻找与耐药相关的分子标志物逆转其耐药是我们急需解决的临床问题。
非编码RNA已被证实在肿瘤的发生发展及耐药中起重要作用,其中LncRNA的异常表达与肺癌的发生发展密切相关[22-23]。LncRNA MALAT1长6.7kb,位于11q13.1也被称为NEAT2(核丰富聚集的转录本2),不编码蛋白质,首次发现于非小细胞肺癌的研究中[24]。有研究表明MALAT1通过调控miR-3129-5p/Nova1轴介导肝癌阿霉素耐药[25]。同时有研究显示,MALAT1通过靶向miR-618/MAEL调控肿瘤EMT过程从而导致肝癌对表阿霉素的耐药性[26]。此外有研究已证明MALAT1可调节NSCLC细胞的药物敏感性[27]。同时有研究表明,在乳腺癌中MALAT1高表达,且参与乳腺癌对阿霉素的耐药[28]。有研究显示在直肠癌中降低MALAT1的表达可逆转其对奥沙利铂的耐药[29]。本研究中,将PC9细胞过表达MALAT1后,移植瘤的体积更大(P< 0.05)、重量更重(P< 0.05)、Ki67表达量增加(P< 0.05),对厄洛替尼的敏感性降低。
有大量证据表明在表观遗传学调控中扮演重要角色的LncRNA,参与调控miRNA的表达[30-31],而miRNA是一种小的非编码RNA包含20~23个核苷酸分子,它通常结合靶基因3′UTR(非翻译区)的互补序列,影响基因的表达。有研究显示LncRNA MALAT1通过调控miR-142-3p导致卵巢癌对氟尿嘧啶及顺铂的化疗耐药[9]。同时多项研究显示,长链非编码RNA MALAT1与微小RNA miR-125a-5p对于多种肿瘤的耐药及发生发展密切相关[32-33]。Li等[34]研究发现在恶性肿瘤中MALAT1高表达与患者的预后及总生存期呈负相关。同时有些研究发现上调miR-125a-5p能抑制人骨肉瘤细胞对阿霉素的耐药[35]。为了阐明MALAT1与miR-125a-5p在NSCLC中的表达及作用关系,基于我们之前的工作发现在PC9及PC9厄洛替尼耐药细胞株(PC9/ER)中,MALAT1于耐药细胞中高表达而miR-125a-5p低表达,并且利用双荧光素酶报告基因系统验证了MALAT1与miR-125a-5p有直接结合位点[15]。在这项研究中我们用体外构建的MALAT1过表达PC9细胞(PC9-MALAT1)皮下注射裸鼠成瘤,并用Erlotinib灌胃治疗,发现相较于亲本PC9细胞移植瘤组,过表达MALAT1后移植瘤中miR-125a-5p表达量降低(P< 0.05),为过表达MALAT1可降低miR-125a-5p表达量进一步提供了体内实验证据。
Rab25是一种受体循环蛋白,据报道在具有侵袭表型和化疗耐药的肿瘤中增强,有研究表明Rab25参与非小细胞肺癌及肾细胞癌的耐药[36-37]。另外有研究显示Rab25在直肠癌化疗耐药细胞中低表达且与多药耐药标志物ABCB1、ABCC1及ABCG2呈负相关,上调Rab25可增强顺铂对耐药细胞G0/G1期的阻滞,显著降低结直肠癌耐药细胞株的化疗耐药性[38],这与本研究NSCLC厄洛替尼耐药细胞中Rab25表达升高相反。并且有证据表明Rab25在NSCLC厄洛替尼获得性耐药细胞中高表达且起着促进耐药的作用[39]。同时有研究显示,在卵巢癌中Rab25通过改变卵巢癌细胞的线粒体凋亡信号而导致化疗耐药[40]。我们的前期研究发现Rab25作为miR-125a-5p的靶基因,miR-125a-5p通过调控靶基因Rab25及PI3K/AKT信号通路导致了NSCLC对厄洛替尼的耐药[16-17]。本研究在移植瘤模型中发现,过表达MALAT1后移植瘤中Rab25表达升高。综上所述,过表达MALAT1可使miR-125a-5p表达下降、Rab25表达升高并且对Erlotinib产生耐药,为MALAT1调控miR-125a-5p及Rab25参与厄洛替尼耐药进一步提供了体内实验证据。但miR-125a-5p及Rab25是否与细胞周期及线粒体凋亡信号相关而诱发耐药尚需进一步验证。
虽然MALAT1调控miR-125a-5p及Rab25导致NSCLC厄洛替尼耐药的具体机制未完全明确,尚需进一步实验深入研究。总的来说,我们的研究结果表明,过表达MALAT1能在一定程度上降低PC9细胞裸鼠移植瘤对Erlotinib的敏感性,其机制可能与LncRNA MALAT1通过调控miR-125a-5p及其靶基因Rab25有关。这些发现表明,MALAT1可能作为肺癌精准治疗的潜在靶点和新型生物标志物。
