囊胚玻璃化冷冻预平衡时间对辅助生殖妊娠结局的影响
2023-08-01张留光李宁李玉虎蔡雪想
张留光,李宁,李玉虎,蔡雪想
·论 著·
囊胚玻璃化冷冻预平衡时间对辅助生殖妊娠结局的影响
张留光,李宁,李玉虎,蔡雪想
海口玛丽医院生殖中心,海南海口 570102
探讨囊胚激光皱缩后缩短玻璃化冷冻预平衡时间对临床妊娠及新生儿结局的影响。回顾性分析2018年1月至2021年12月于海口玛丽医院进行囊胚复苏移植患者的临床资料,从中筛选501例患者518个移植周期。根据实验室囊胚玻璃化冷冻技术标准操作程序修订前后的预平衡时间将其分为A组(9~10min)和B组(7~8min),比较两组间的妊娠结局和新生儿结局。两组患者的年龄、移植胚胎数、卵泡刺激素、体质量指数、不孕年限、原发不孕比例、移植日内膜厚度和内膜方案比较,差异均无统计学意义(>0.05);两组的囊胚存活率、着床率、临床妊娠率、活产率、早期流产率、多胎妊娠率、母体并发症比较,差异均无统计学意义(>0.05)。两组的新生儿性别比、孕周、早产儿比例、出生体质量、低出生体重儿、巨大儿、剖宫产、出生缺陷比较,差异均无统计学意义(>0.05)。囊胚激光皱缩后,缩短玻璃化冷冻预平衡时间不影响囊胚复苏移植的妊娠结局。
玻璃化冷冻;囊胚;时间;妊娠结局
近年来,国内囊胚复苏移植的比例不断扩大。囊胚移植有诸多优点,如有助于胚胎质量自我筛选、提高成功率、有效降低多胎率、减少卵裂期胚胎保存数量、进行胚胎植入前遗传学诊断等。玻璃化冷冻方法在辅助生殖领域的成功运用和快速发展,使得胚胎冻存更为简便、高效和安全[1]。目前,国内多数中心采用商品化试剂盒进行囊胚玻璃化冷冻。然而,玻璃化冷冻试剂中通常含有乙二醇和二甲基亚砜,这些物质对胚胎的细胞毒性并未得到大家的足够重视。众所周知,冷冻保护剂的暴露时间和浓度是影响细胞内冰晶形成和细胞毒性的两个重要因素。为降低冷冻保护剂对囊胚的细胞毒性,多数中心将胚胎暴露于高浓度冷冻液中的时间限制在40~60s,但在低浓度冷冻保护剂中的预平衡时间不尽相同[2-5]。在行囊胚玻璃化冷冻之前进行激光皱缩,可使囊胚在平衡液中的暴露时间更加灵活[6-10]。研究显示,卵裂期胚胎不同的玻璃化冷冻预平衡时间可对临床结局产生影响,而囊胚方面是否影响临床及新生儿结局却少有报道[11-12]。本研究拟评价人类囊胚激光皱缩后行玻璃化冷冻,其较短的预平衡时间是否对临床妊娠及新生儿结局产生影响。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月至2021年12月就诊于海口玛丽医院生殖中心的501例患者518个囊胚复苏移植周期的临床资料。纳入标准:①年龄<35岁;②内膜无明显异常;③囊胚评分3BB以上。排除标准:①囊胚复苏后2h囊胚腔未扩张者;②卵裂期胚胎和囊胚期胚胎序贯移植者。本研究进行胚胎冷冻的原因:①预防卵巢过度刺激;②促排卵方案不适宜移植;③孕酮升高;④子宫内膜薄或内膜有炎症等内膜因素;⑤个人原因及其他。根据实验室囊胚玻璃化冷冻技术标准操作程序修订前后的预平衡时间将其分为两组,即9~10min为A组(269例患者278个周期);7~8min为B组(232例患者240个周期)。本研究获得海口玛丽医院生殖医学伦理委员会审批通过(伦理审批号:2021-10-02)。
1.2 方法
1.2.1 囊胚准备 当有2个以上卵泡的直径≥18mm时,当晚肌内注射重组人绒促性素250μg,37h后经阴道超声引导下取卵。胚胎培养体系:卵冠丘复合物在四孔皿授精液中培养并进行受精,在培养箱(37℃,6% CO2,5% O2)培养约18h后观察卵子受精情况并转移到卵裂液中,每隔24h观察并记录胚胎发育情况。胚胎发育到第3天将胚胎转移到囊胚培养液中继续培养[13]。第5天和第6天时,按照伊斯坦布尔共识标准对囊胚进行形态学观察评估[14]。
1.2.2 激光皱缩 所有囊胚冷冻前进行激光打孔,使扩张囊胚皱缩。具体过程如下:采用激光破膜系统对扩张期囊胚行激光打孔,使用单束激光脉冲(200ms)在滋养层的细胞连接处(远离内细胞团)发射激光进行打孔,囊腔迅速塌陷,腔内水分流出,见图1。在培养箱中放置约10min后进行冷冻。
1.2.3 囊胚冷冻与复苏 采用商品化试剂盒(Kitazato,日本)进行囊胚的玻璃化冷冻与复苏,操作步骤参照说明书进行。在室温条件下,将皱缩后的囊胚置于平衡液中,9~10min或7~8min后将其转入VS液中,最后将胚胎转移到玻璃化冷冻载杆上(Kitazato,日本)并迅速投入液氮中保存,胚胎从转入玻璃化冷冻液到投入液氮中的时间间隔不超过1min(40~60s)。复苏时,将TS液提前预热至37℃,从液氮中迅速取出载体浸入其中,放置1 min,然后依次转移至复苏液(DS液、WS1液、WS2液)放置3min、5min、5min,最后转入含10%人血清替代品的培养基中,在37℃、6% CO2及5% O2的培养箱中培养。2h后观察囊胚色泽及囊胚腔扩张情况,囊腔部分或全部扩张为存活,进行移植。
1.2.4 内膜准备 根据患者自身条件不同,内膜准备方案分为自然周期和人工周期两种。自然周期适用于月经周期规律的患者,于月经周期第10天开始B超监测卵泡发育情况及内膜厚度,综合黄体生成素、雌二醇及孕酮水平确定排卵时间,排卵后第5天进行胚胎移植。人工周期适用于排卵障碍、月经不规律、自然周期内膜发育欠佳者,从月经周期第2~3天起口服戊酸雌二醇,根据B超监测内膜厚度酌情调整戊酸雌二醇剂量,至内膜≥8mm时肌内注射黄体酮(40~60mg/d)转化内膜,5d后在B超引导下进行胚胎移植。所有冷冻复苏移植周期胚胎均为优质囊胚。
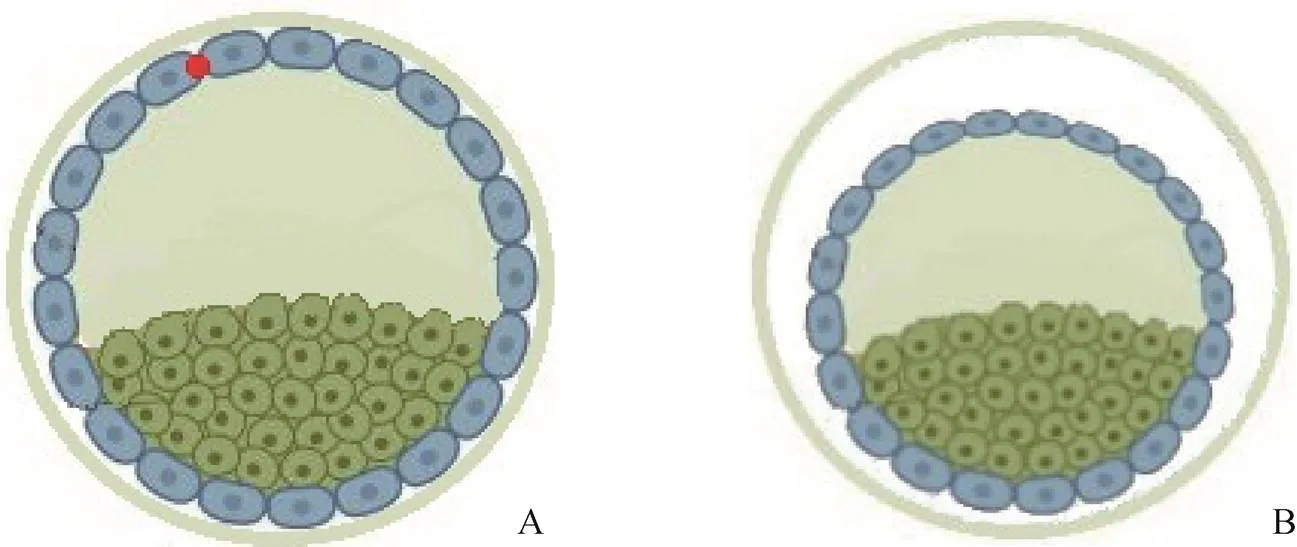
图1 囊胚激光皱缩示意图
A.激光皱缩前;B.激光皱缩后
注:红色为激光打孔位置;蓝色为滋养层细胞;青色为内细胞团
1.3 妊娠判断及观察指标
胚胎移植后常规黄体支持,第14天测定血清人绒毛膜促性腺激素,>25U/L为生化妊娠;1个月后超声检查示宫内有孕囊者视为临床妊娠。
妊娠及新生儿结局的评估:①着床:囊胚移植约5周行阴道B超检查有无孕囊及数目。着床率=孕囊数/移植胚胎数×100%。②临床妊娠:囊胚移植后14d查血人绒毛膜促性腺激素阳性,且移植后4~6周行阴道B超可见孕囊,包括宫外孕。临床妊娠率=临床妊娠周期数/总移植周期数×100%。③早期流产:妊娠后于3个月内终止为早期流产。早期流产率=早期流产周期数/临床妊娠周期数×100%。④活产率=活产周期数/总移植周期数×100%。⑤多胎妊娠率=双胎及以上妊娠周期数/临床妊娠周期数×100%。⑥低出生体重儿:出生体质量<2.5kg。⑦巨大儿:出生体质量>4kg。⑧早产:20~37周分娩。⑨出生缺陷:在出生时或出生后表现出的结构、功能或发育异常,可能是由出生前遗传或非遗传因素造成。⑩母体并发症:主要包括妊娠高血压、妊娠糖尿病、胎膜早破、前置胎盘等。
1.4 统计学方法

2 结果
2.1 两组患者的一般资料比较
两组患者的年龄、移植胚胎数、卵泡刺激素(follicle-stimulating hormone,FSH)、体质量指数、移植日内膜厚度、不孕年限、原发不孕比例及内膜方案比较,差异均无统计学意义(>0.05),见表1。
2.2 两组胚胎冻融周期的临床结局比较
两组的囊胚存活率、着床率、临床妊娠率、活产率、早期流产率、多胎妊娠率、母体并发症比较,差异均无统计学意义(>0.05),见表2。
2.3 两组的新生儿结局比较
本研究共有新生儿366人,两组的新生儿性别比、孕周、早产儿比例、出生体质量、低出生体重儿、巨大儿、剖宫产、出生缺陷比较,差异均无统计学意义(>0.05),见表3。

表1 两组患者的一般资料比较
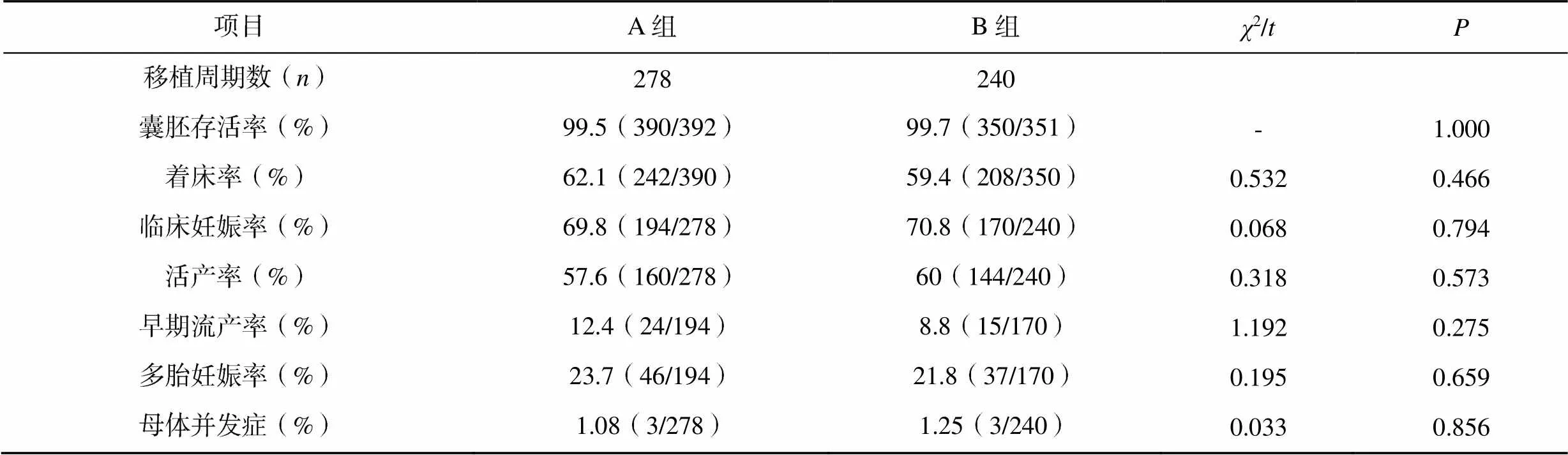
表2 两组胚胎冻融周期的临床结局比较
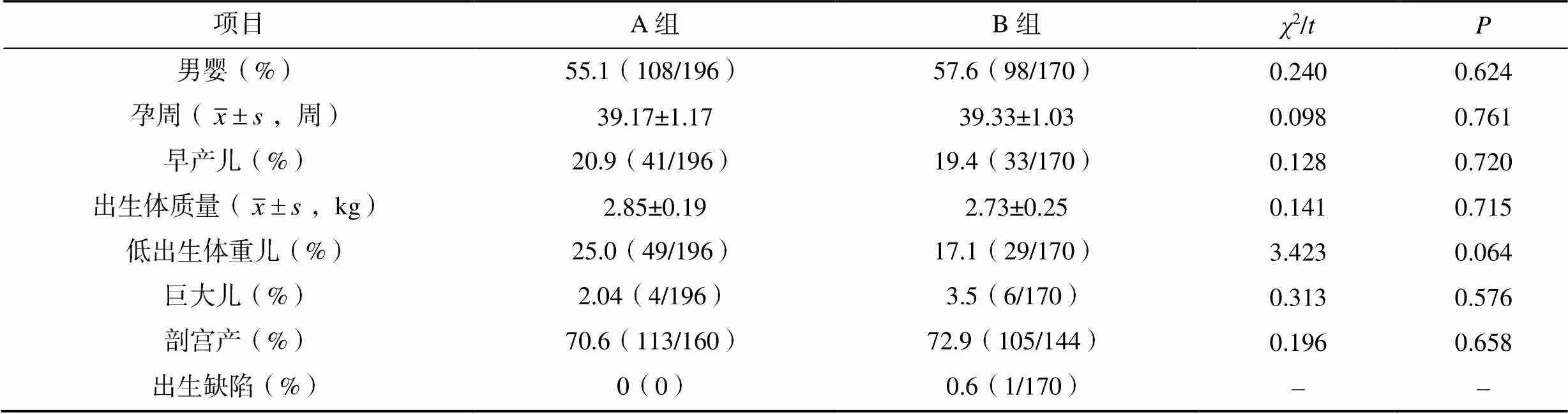
表3 两组的新生儿结局比较
3 讨论
玻璃化冷冻保护剂对胚胎的细胞毒性影响主要由冷冻保护剂的浓度、预平衡时间和温度等几个关键因素决定[5]。本研究表明,较短的预平衡时间可达到较好的玻璃化冷冻效果,而延长预平衡时间至9~10min并未显著提高冷冻效果且降低操作效率。
日本加藤商品化玻璃化冷冻试剂建议囊胚玻璃化冷冻第一步预平衡时间为12~15min。然而,已有研究表明不必要的长时间暴露于玻璃化预平衡液中可能对后期胚胎发育带来不良影响[15-16]。早在1997年,Ishida等[16]就发现在玻璃化冷冻平衡液中暴露时间为5~40min不等的实验组小鼠胚胎在冷冻和解冻后的发育情况相似。但是,暴露5min的实验组小鼠的姐妹染色单体交换数量明显减少,这表明5min是其玻璃化冷冻中最安全的平衡时间。Xiong等[11-12]研究表明,不同的预平衡时间会影响人类早期胚胎玻璃化冷冻的临床结局,适当延长预平衡时间(9~10min)可能会改善临床结局。然而,这几项研究的对象都是卵裂期胚胎,并没有提到预平衡时间对囊胚期胚胎玻璃化冷冻结局的影响。
近年来,随着技术的发展,大量研究证实人工皱缩能改善囊胚玻璃化冷冻的临床结局,但各中心人工皱缩后囊胚的冷冻预平衡时间差异较大(2~15min)[6-10]。研究人员使用冷冻环对第5天的囊胚进行玻璃化冷冻,获得100%的复苏存活率[7]。Levi-Setti等[8]用同样的囊胚玻璃化冷冻方法,获得存活率为97.5%。值得注意的是,在这两项研究中,其囊胚预平衡时间均是37°C下2min。此外,Darwish等[17]报道使用Cryoleaf玻璃化冷冻第5天囊胚的存活率为97.3%,其囊胚在常温下预平衡时间为6~10min。2011年,Zhu等[18]采用Crytop方法在室温下对人工皱缩的囊胚进行12~15min的预平衡,其存活率为85.7%。然而,很少有专门的研究对比皱缩后人囊胚不同的玻璃化预平衡时间对临床结局的影响,尤其是对新生儿的影响。因每个中心的冷冻方法、冷冻保护剂类型、载体类型、患者群体、胚胎师操作水平存在差异,因此很难通过对比不同中心的数据来评判不同预平衡时间对临床结局和新生儿的影响。2010年的一项研究显示,未经人工皱缩的囊胚随着预平衡时间的延长其存活率升高,但人工皱缩后的囊胚在预平衡2、5、10、15min后的存活率无差异,建议皱缩后预平衡较短的时间[11]。本研究中人工皱缩后的囊胚复苏存活率无显著差异,且笔者发现妊娠结局和新生儿结局也无显著差异。Mitsuhata等[19]研究结果表明,用未经人工皱缩的扩张期囊胚行玻璃化冷冻时,延长预平衡时间(12~15min)能显著改善囊胚的存活率、种植率及出生率,而新生儿结局无显著差异。这一结果和本研究结果部分相似,之所以其延长预平衡时间能显著改善存活率、种植率及出生率,可能与未经人工皱缩有较大关系。2021年,李翔等[20]研究结果显示,激光皱缩可增加D5优质单囊胚复苏移植周期的早期流产率,而本研究结果证实延长预平衡时间有增加早期流产率的风险,这从侧面反映囊胚激光皱缩后缩短冷冻预平衡时间的必要性。众所周知,伴随着囊胚的不断发育,其胚胎体积不断变大,细胞数目也逐渐增多,冷冻保护剂在细胞内外达到平衡所需的时间也随之延长。人工皱缩后的囊胚其体积塌陷缩小,囊泡液逐渐流出腔外,这样有利于冷冻保护剂快速渗透到细胞内,从而缩短细胞脱水时间。2018年,Kovačič等[10]在研究人工皱缩能改善囊胚复苏移植周期临床结局时,曾提出一个假设,即其预平衡时间是否可缩短至10min以内;其采用10min的玻璃化预平衡时间,获得97.2%的复苏存活率。本研究结果显示,两组预平衡时间均取得较高的复苏存活率及较好的临床结局和新生儿结局,这进一步证实Kovačič等的假设。
另外,在其他物种上,研究人员也比较了不同的预平衡时间对囊胚玻璃化冷冻所带来的影响。Kader等[15]评估玻璃化冷冻预平衡时间对小鼠囊胚DNA完整性指数的影响,该指数与胚胎的发育潜力呈正相关。结果显示,不同的预平衡时间对扩张期囊胚DNA完整性指数影响不同,其中8min组显著高于4min组和15min组。玻璃化冷冻过程中较短的平衡时间(3min)相比较长的平衡时间(12min)可提高牛的D7和D8扩张囊胚的复苏存活率和孵化率[21]。虽然这些动物和人类的囊胚细胞对冷冻保护剂的渗透速率各不相同,但实验表明预平衡时间是玻璃化冷冻的一个重要因素,过长或过短的预平衡时间都将对囊胚玻璃化冷冻产生不利影响。
综上所述,对于扩张期的囊胚,激光皱缩能缩短囊胚玻璃化冷冻的预平衡时间,且其对临床结局和新生儿结局没有显著影响,这对临床中提高玻璃化冷冻效率很有意义。但由于本研究规模小,还需更多数据来支持这一结论;同时是否还存在更短的玻璃化冷冻预平衡时间也需进一步研究。
[1] WEI D, LIU J Y, SUN Y, et al. Frozen versus fresh single blastocyst transfer in ovulatory women: A multicentre, randomised controlled trial[J]. Lancet, 2019, 393(10178): 1310–1318.
[2] TONG G Q, CAO S R, WU X, et al. Clinical outcome of fresh and vitrified-warmed blastocyst and cleavage-stage embryo transfers in ethnic Chinese ART patients[J]. J Ovarian Res, 2012, 5(1): 27.
[3] COBO A, DE LOS SANTOS M J, CASTELLÒ D, et al. Outcomes of vitrified early cleavage-stage and blastocyst- stage embryos in a cryopreservation program: Evaluation of 3150 warming cycles[J]. Fertil Steril, 2012, 98(5): 1138–1146.
[4] MORI C, YABUUCHI A, EZOE K, et al. Hydroxypropylcellulose as an option for supplementation of cryoprotectant solutions for embryo vitrification in human assisted reproductive technologies[J]. Reprod Biomed Online, 2015, 30(6): 613–621.
[5] COELLO A, MESEGUER M, GALÁN A, et al. Analysis of the morphological dynamics of blastocysts after vitrification/warming: Defining new predictive variables of implantation[J]. Fertil Steril, 2017, 108(4): 659–666.
[6] KOVAČIČ B, TABORIN M, VLAISAVLJEVIĆ V, et al. To collapse or not to collapse blastocysts before vitrification? A matched case-control study on single vitrified-warmed blastocyst transfers[J]. Reprod Biomed Online, 2022, 45(4): 669–678.
[7] DESAI N, SZEPTYCKI J, SCOTT M, et al. Artificial collapse of blastocysts before vitrification: Mechanical vs. laser technique and effect on survival, cell number, and cell death in early and expanded blastocysts[J]. Cell Preserv Technol, 2008, 6(3): 181–190.
[8] LEVI-SETTI P E, MENDUNI F, SMERALDI A, et al. Artificial shrinkage of blastocysts prior to vitrification improves pregnancy outcome: Analysis of 1028 consecutive warming cycles[J]. J Assist Reprod Genet, 2016, 33(4): 461–466.
[9] GUERRERO C A, PEREZ O, GOLDSTEIN J, et al. Effect of artificial collapse and equilibration times on survival of human blastocysts following vitrification using a closed double straw system[J]. Fertil Steril, 2010, 94(4): S30–S31.
[10] KOVAČIČ B, TABORIN M, VLAISAVLJEVIĆ V. Artificial blastocoel collapse of human blastocysts before vitrification and its effect on re-expansion after warming - A prospective observational study using time-lapse microscopy[J]. Reprod Biomed Online, 2018, 36(2): 121–129.
[11] XIONG S, LIU J X, GAO Y, et al. Shortened equilibrationtime can compromise clinical outcomes in human embryo vitrification[J]. Hum Fertil (Camb), 2016, 19(2): 114–119.
[12] XIONG S, LIU J X, HAN W, et al. Effects of equilibration time on clinical outcomes in embryo vitrification procedure[J]. Fertil Steril, 2013, 100(3): S183–S184.
[13] ZHANG L, LI Y, HUANG Y, et al. Successful birth after ICSI with testicular immotile spermatozoa from a patient with total MMAF in the ejaculates: A case report[J/OL]. Zygote, 2021: 1–7. (2021-09-29)[2023-06-16].https://www.cambridge.org/core/journals/zygote/article/abs/successful-birth-after-icsi-with-testicular-immotile-spermatozoa-from-a-patient-with-total-mmaf-in-the-ejaculates-a-case-report/E1D85F861E093B3509E1878E8FA62C74.
[14] GARDNER D K, LANE M, STEVENS J, et al. Blastocyst score affects implantation and pregnancy outcome: Towards a single blastocyst transfer[J]. Fertil Steril, 2000, 73(6): 1155–1158.
[15] KADER A, CHOI A, SHARMA R K, et al. Effect of varying equilibration time in a two-step vitrification method on the post-warming DNA integrity of mouse blastocysts[J]. Fertil Steril, 2010, 93(8): 2640–2605.
[16] ISHIDA G M, SAITO H, OHTA N, et al. The optimal equilibration time for mouse embryos frozen by vitrification with trehalose[J]. Hum Reprod, 1997, 12(6): 1259–1262.
[17] DARWISH E, MAGDI Y. Artificial shrinkage of blastocoel using a laser pulse prior to vitrification improves clinical outcome[J]. J Assist Reprod Genet, 2016, 33(4): 467–471.
[18] ZHU D, ZHANG J, CAO S, et al. Vitrified-warmed blastocyst transfer cycles yield higher pregnancy and implantation rates compared with fresh blastocyst transfer cycles--Time for a new embryo transfer strategy?[J]. Fertil Steril, 2011, 95(5): 1691–1695.
[19] MITSUHATA S, HAYASHI M, FUJII Y, et al. Effect of equilibration time on clinical and neonatal outcomes in human blastocysts vitrification[J]. Reprod Med Biol, 2020, 19(3): 270–276.
[20] 李翔, 罗宇迪, 张炬光, 等. 激光皱缩对不同发育时间和级别的单囊胚冷冻复苏周期临床结局的影响[J]. 昆明医科大学学报, 2021, 42(1): 152–156.
[21] MARTÍNEZ-RODERO I, GARCÍA-MARTÍNEZ T, ORDÓÑEZ-LEÓN E A, et al. A shorter equilibration period improves post-warming outcomes after vitrification and in straw dilution of in vitro-produced bovine embryos[J]. Biology (Basel), 2021, 10(2): 142.
Effect of vitrification pre-balance time of blastula on pregnancy outcome in assisted reproduction
Center for Reproductive Medicine, Haikou Mary Hospital, Haikou 570102, Hainan, China
To investigate the effect of shortening vitrification pre-balance time after laser blastocyst shrinkage on clinical pregnancy and neonatal outcomes.The clinical data of blastocyst resuscitation and transplantation in Haikou Mary Hospital from January 2018 to December 2021 were retrospectively analyzed, and 501 patients for a total of 518 transplantation cycles were screened. The blastocysts were divided into two groups according to the pre-balance time before and after the revision of the standard operating procedure of laboratory vitrification freezing technology: group A (9-10 min) or group B (7-8 min). The pregnancy outcome and neonatal outcomes were compared between the two groups.There were no significant differences in age, number of transplanted embryos, follicle-stimulating hormone, body mass index, infertility years, proportion of primary infertility, intima thickness and intima regimen between the two groups (>0.05). There were no significant differences in blastocyst survival rate, implantation rate, clinical pregnancy rate, live birth rate, early abortion rate, multiple pregnancy rate and maternal complications between the two groups (>0.05). There were no significant differences in neonatal sex ratio, gestational age, preterm birth rate, birth weight, low birth weight, macrosomia, cesarean section and birth defects between the two groups (>0.05).Shortening the vitrification pre-balance time after laser blastocyst shrinkage did not affect the pregnancy outcome of blastocyst resuscitation transplantation.
Vitrification; Blastocyst; Time; Pregnancy outcome
R321
A
10.3969/j.issn.1673-9701.2023.19.002
(2022–12–26)
(2023–06–19)
海南省医药卫生科研项目(2101320319A2003)
张留光,电子信箱:xiaodaoivflab@163.com
