基于增强CT影像组学预测非肌层浸润性膀胱癌的病理分级
2023-08-01谢敏蒋恩琰唐晨野郭晓
谢敏,蒋恩琰,唐晨野,郭晓
·论 著·
基于增强CT影像组学预测非肌层浸润性膀胱癌的病理分级
谢敏1,蒋恩琰2,唐晨野3,郭晓3
1.浙江中医药大学研究生院,浙江杭州 310053;2.中山大学附属第五医院生物医学影像重点实验室,广东珠海 519000;3.嘉兴市第二医院泌尿外科,浙江嘉兴 314000
探讨基于增强CT影像组学建立的非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer,NMIBC)病理分级预测模型的诊断价值。回顾性分析2015年1月至2018年12月嘉兴市第二医院病理确诊的81例NMIBC患者的临床资料,患者术前接受增强CT检查,收集其皮髓期和实质期影像资料,对膀胱肿瘤轮廓进行勾勒,提取一阶变量、纹理变量、形状特征、小波变换变量,总计1980个特征变量。采用最大相关最小冗余(max-relevance and min-redundancy,mRMR)算法与最小绝对收缩和选择算子(least absolute shrinkage and selection operatorLASSO)算法进行特征选择,最后利用多种机器学习算法结合有意义的特征变量建立预测模型,用于比较其预测NMIBC病理分级的敏感度、特异性和准确率。运用mRMR联合LASSO筛选出19个特征变量,使用K近邻分类(K-nearest neighbor,KNN)、神经网络(neural networks,NNET)、随机森林(random forest,RF)、支持向量机(support vector machines,SVM)4种机器学习算法建立模型并验证。4种模型建立成功且结果相对一致,其中RF模型表现相对稳定,在验证集中准确率为91.4%。在测试集中准确率为70.0%。通过术前增强CT影像组学结合机器学习算法可精准预测NMIBC病理分级,对推动膀胱癌个性化治疗具有科学意义。
非肌层浸润性膀胱癌;增强CT;影像组学;机器学习;病理分级
膀胱癌是泌尿生殖系统最常见的恶性肿瘤之一,发病率在恶性肿瘤中居第6位[1-2]。低危非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer,NMIBC)通常在行经尿道膀胱肿瘤切除术(transurethral resection of bladder tumor,TUR-BT)后予膀胱灌注治疗;而高危NMIBC在TUR-BT后需予卡介苗灌注治疗1年以上,必要时行根治性膀胱切除术[2-3]。病理分级对膀胱癌手术方案的选择及术后管理具有重要意义[4]。但术前膀胱镜下病理活检术存在取样组织少、深度不够等不足。影像组学病理模型能更加系统地评估肿瘤的病理分级,有利于膀胱癌的精准化管理[5-6]。研究认为不同病理级别膀胱癌是由异质性表型所致,包括微血管浸润、细胞因子表达和肿瘤免疫微环境等,这些异质性表型可引起图像的细微改变[7-8]。因此,本研究拟以增强CT影像组学运用机器学习算法对NMIBC的病理分级进行预测和评估,现将结果报道如下。
1 资料与方法
1.1 临床资料
回顾性分析2015年1月至2018年12月嘉兴市第二医院病理确诊的NMIBC患者81例。纳入标准:①根据国际抗癌联盟TNM分期标准,术后病理诊断为NMIBC且病理分期为Ta和T1;②术前1个月内行CT尿路造影检查。排除标准:①临床资料不完整,影像资料质量较低;②病理分期为原位癌;③检查前予灌注治疗、化疗或免疫治疗等干预肿瘤进展者;④肌层浸润性膀胱癌、多发性NMIBC或其他病理分型。按3∶1的比例将81例患者分为训练集(=61)和验证集(=20)。本研究经嘉兴市第二医院医学伦理委员会审批通过并获得免除知情同意书许可(伦理审批号:2022ZFYJ248-01)。
1.2 CT资料的获取
CT扫描采用64层螺旋CT(美国GE公司)。造影剂为碘海醇,浓度350mgI/ml,造影剂量80~100ml,注射速度4ml/s。检查前禁食6h,注射造影剂前后分别进行多次扫描。扫描条件:120kV,100mA,扫描厚度0.625mm×64。开始注射造影剂至启动扫描的时间跨度定义为皮髓期延迟扫描时间,采用造影剂跟踪技术,检测腹主动脉CT值,阈值为150HU。实质期扫描延迟时间为55~80s。
1.3 绘制感兴趣体积
为确保病变周围的微环境提供有用信息,勾勒感兴趣体积(volume of interest,VOI)时确保距离肿瘤2mm,瘤体的勾勒包括坏死钙化区。由2名经验丰富的医生使用3D slicer 3.0软件绘制VOI。对有异议的VOI,通过共同商讨重新勾勒,直至意见一致,见图1。
1.4 获取特征变量
在获取VOI后,运用3D slicer 3.0软件处理皮髓期或实质期图像,最终获取4类变量:一阶变量、形状特征、纹理变量、小波变换变量,共计990个。因皮髓期和实质期均进行勾勒,最终每个患者共获得2×990个变量。

图1 膀胱肿瘤在皮髓期和实质期的影像学表现
A.肿瘤皮髓期;B.获取肿瘤皮髓期的VOI;C.肿瘤实质期;D.获取肿瘤实质期的VOI
1.5 最优特征变量选择
所有的特征变量在计算之前均进行均一化处理。在训练集中,采用mRMRe软件包对所有特征变量进行最大相关最小冗余(max-relevance and min- redundancy,mRMR)算法,将特征变量数压缩,以降低冗余并防止将相关特征变量提取出来。然后运用glmnet软件包对压缩后的特征变量进行最小绝对收缩和选择算子(least absolute shrinkage and selection operatorLASSO)算法,通过对回归系数的调整,当确定回归系数最小值时,筛选出有意义的特征变量。
1.6 模型的建立、评价和验证
利用上述获得的1980个特征变量,通过caret软件包采用K近邻分类(K-nearest neighbor,KNN)、神经网络(neural networks,NNET)、随机森林(random forest,RF)、支持向量机(support vector machines,SVM)4种机器学习算法建立模型。采用准确率、敏感度、特异性、阳性预测值、阴性预测值评价测试集模型,最后再应用于验证集。
1.7 统计学方法
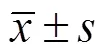
2 结果
2.1 患者临床资料
81例膀胱癌患者,其中高级别38例,固有层浸润25例;低级别43例,固有层浸润8例。所有患者均行TUR-BT,64例患者术后按疗程行膀胱灌注,18例患者复发,7例患者死亡。高级别患者的T1分期占比显著高于低级别患者(<0.05),见表1。
2.2 模型的建立
共获得1980个特征变量,经mRMR算法获得30个相关性最大且冗余最低的特征变量。再采用LASSO算法建立模型,通过10折交叉验证和最小准测对LASSO模型中的惩罚系数进行调整,确定最优为0.0270,log()为–3.6109,此时特征变量为19个。19个特征变量在不同病理结果中的分布情况见图2。
2.3 模型的评价
用4种常见的机器学习算法建立膀胱癌病理分级预测模型。在训练集中,RF算法表现最优,该算法的准确率为91.4%,另外敏感度、特异性、阳性预测值和阴性预测值分别为89.5%、93.0%、91.9%和90.9%;在测试集中,RF算法的准确率为70.0%,同时敏感度、特异性、阳性预测值和阴性预测值分别为75.0%、66.7%、60.0%、80.0%,见表2。使用RF预测NMIBC病理分级的曲线下面积,测试集为0.913,验证集为0.709。

表1 不同病理分级膀胱癌患者的临床资料
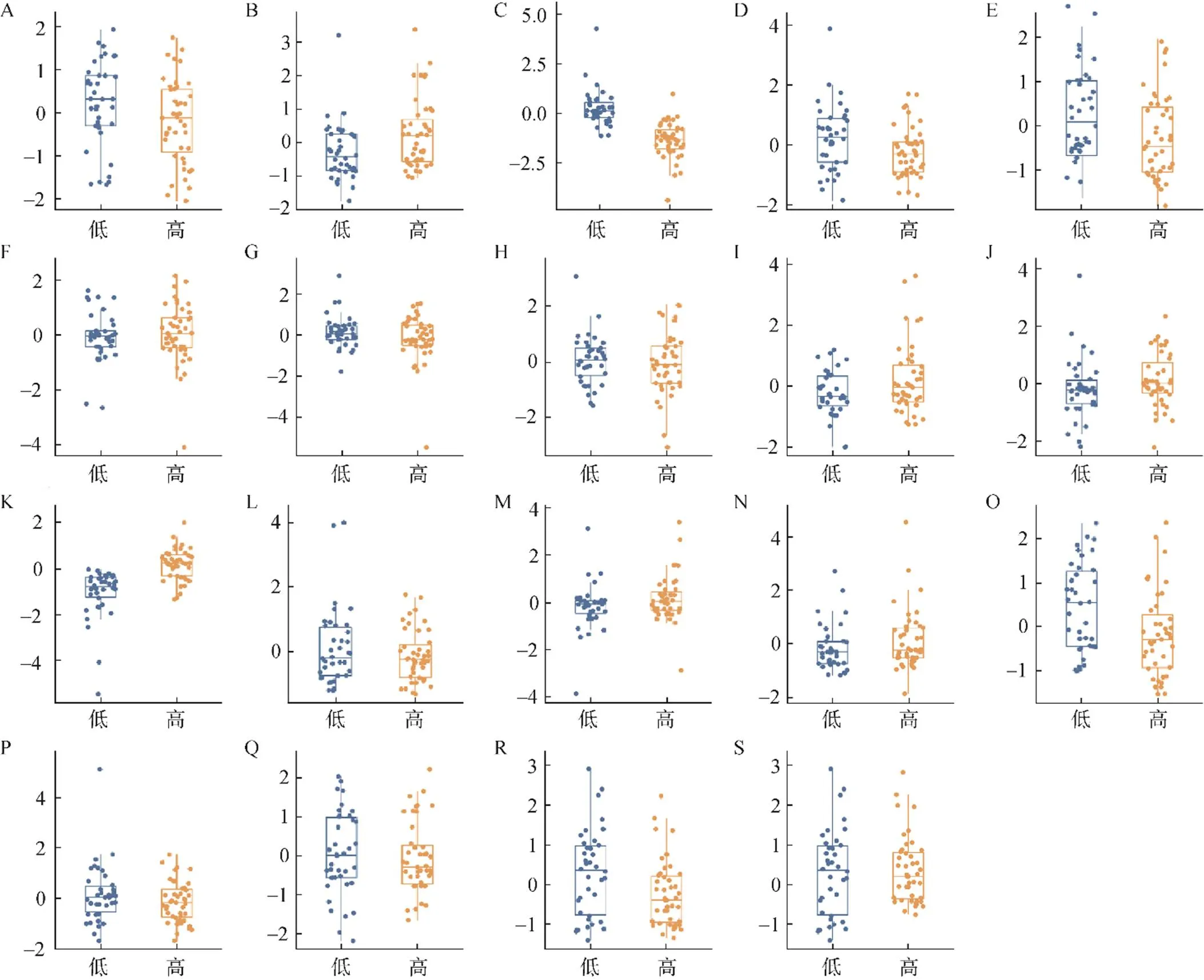
图2 19个特征变量在不同病理级别膀胱癌中的分布情况
注:A.原始图像:形状、延伸率.A;B.原始图像:灰度共生矩阵、相关性信息度量.A;C.小波变换HLL:灰度共生矩阵、逆方差.V;D.原始图像:灰度尺寸区域矩阵、归一化区域大小不均匀性.V;E.原始图像:灰度尺寸区域矩阵、小区域低灰度强调.A;F.小波变换LHL:灰度尺寸区域矩阵、小面积强调.A;G.小波变换HLH:一阶变量、偏度.A;H.原始图像:一阶变量、最小值.V;I.小波变换LHH:一阶变量、四分位距离.V;J.小波变换HLL:灰度共生矩阵、相关性.V;K.小波变换HLL:灰度共生矩阵、逆方差.V;L.小波变换HLL:灰度依赖矩阵、大依赖低灰度强调.V;M小波变换HLH:一阶变量、中位数.V;N.小波变换HLH:灰度共生矩阵、差平均.V;O.小波变换HLH:灰度尺寸区域矩阵、小区域低灰度强调.V;P.小波变换HLL:灰度依赖矩阵、大依赖低灰度强调.V;Q.原始图像:灰度尺寸区域矩阵、归一化区域大小不均匀性.A;R.小波变换LLL:灰度依赖矩阵、依赖方差.V;S.小波变换HLL:灰度依赖矩阵、大依赖低灰度强调.V;后缀A为皮髓期变量;后缀V为实质期变量;小波变换LHL、LHH、HLL、HLH、LLL为小波变换在3个维度中每个维度分别使用高通、低通滤波器所产生的组合

表2 测试集和验证集在不同模型下的诊断效能(%)
3 讨论
本研究尝试利用影像组学和机器学习的方法来预测膀胱癌的病理分级,希望通过无创性描述来丰富和完善膀胱癌的诊治。构建的模型证实增强CT影像组学运用机器学习预测NMIBC病理分级具有一定的可行性。
随着影像技术的成熟,关于对肿瘤病理分级的影像学研究也在不断增加。Ye等[9]利用单层CT切片结合深度学习模型有效地预测头颈癌的病理分期,曲线下面积达0.959。另外,瘤体的参数(如大小、形状、表面积及钙化程度)和异质性相关的指标(如灰度不均匀性、小波繁忙度、复杂性及熵值等)是预测肿瘤微血管浸润的重要因素,也是决定肿瘤异质性的关键因素[10-15]。
近年来,国外指南对不同病理分级的膀胱癌提出不同的治疗建议,越来越多的影像组学研究开始关注膀胱癌的病理分级[16]。Xu等[17]提出基于多参数磁共振影像组学预测膀胱癌病理分级的策略,提取61例膀胱癌患者的弥散加权成像和表面弥散系数序列的影像组学特征变量,验证磁共振影像组学对预测膀胱恶性肿瘤的病理分级具有良好的表现。虽然排泄期CT尿路造影对膀胱癌的诊断更为敏感,但为避免膀胱内高密度造影剂对肿瘤CT值的影响,笔者选择皮髓期和实质期图像进行分析。研究发现皮髓期的特征变量6个,实质期的特征变量13个。在实质期,造影剂已进入肿瘤,可充分显示肿瘤的血管结构和纹理,在区分肿瘤的病理分级时效能更强。其中,回归系数绝对值大于0.5的特征变量有3个,对模型的影响权重较大。它们分别是在实质期中与病理分级呈正相关的灰度共生矩阵(小波变换HHL)和负相关的灰度尺寸区域矩阵(小波变换)及在皮髓期中与病理分级呈正相关的灰度共生矩阵(原始图像)。其中,第一个和第三个特征变量为灰度共生矩阵变量,代表基于预设的像素在图像不同方向出现的频率;第二个特征变量是灰度尺寸区域矩阵中反映小区域低灰度水平的一个值,代表灰度形成的颗粒大小和分布。3个特征变量均反映高级别和低级别膀胱癌在图像灰度、像素等纹理特征上的差异,与用肉眼观察的结果一致。在实质期中,肿瘤的密度表现更加不均,部分强化区域密度更高,相反其他低密度区域密度更低,可见高级别的膀胱肿瘤在实质期图像上表现为熵值更大。
本研究发现,在测试集中NNET和RF的准确率极为接近,两种模型表现相对稳定,其中RF在综合评估方面更优。虽然目前神经网络应用的领域较广泛,但由于本研究的样本量较小,因此NNET算法并没有较大优势[18-20]。
综上,增强CT影像组学结合机器学习可有效预测NMIBC的病理分级。纹理特征和小波变换变量对判断NMIBC的病理分级有重要意义。机器学习对模型的预测结果基本一致,但仍需大样本和多中心研究进行验证。
[1] MARTINEZ RODRIGUEZ R H, BUISAN RUEDA O, IBARZ L. Bladder cancer: Present and future[J]. Med Clin (Barc), 2017, 149(10): 449–455.
[2] DEGEORGE K C, HOLT H R, HODGES S C. Bladder cancer: Diagnosis and treatment[J]. Am Fam Physician, 2017, 96(8): 507–514.
[3] MESSING E M, TANGEN C M, LERNER S P, et al. Effect of intravesical instillation of gemcitabine vs saline immediately following resection of suspected low-grade non-muscle-invasive bladder cancer on tumor recurrence: SWOG S0337 randomized clinical trial[J]. JAMA, 2018, 319(18): 1880–1888.
[4] WANG G, MCKENNEY J K. Urinary bladder pathology: World Health Organization classification and American Joint Committee on cancer staging update[J]. Arch Pathol Lab Med, 2019, 143(5): 571–577.
[5] GE L, CHEN Y, YAN C, et al. Study progress of radiomics with machine learning for precision medicine in bladder cancer management[J]. Front Oncol, 2019, 9: 1296.
[6] HAROON S A, RAHIMI H, MERRITT A, et al. Computed tomography (CT) in the evaluation of bladder and ureteral trauma: Indications, technique, and diagnosis[J]. Abdom Radiol (NY), 2019, 44(12): 3962–3977.
[7] BENOIT T, KELLER E X, WOLFSGRUBER P, et al. High VEGF-D and low MMP-2 serum levels predict nodal- positive disease in invasive bladder cancer[J]. Med Sci Monit, 2015, 21: 2266–2274.
[8] ZHANG G, XU L, ZHAO L, et al. CT-based radiomics to predict the pathological grade of bladder cancer[J]. Eur Radiol, 2020, 30(12): 6749–6756.
[9] YE J, LUO J, XU S, et al. One-slice CT image based kernelized radiomics model for the prediction of low/mid-grade and high-grade HNSCC[J]. Comput Med Imaging Graph, 2020, 80: 101675.
[10] KOCAK B, DURMAZ E S, ATES E, et al. Radiogenomics of lower-grade gliomas: Machine learning-based MRI texture analysis for predicting 1p/19q codeletion status[J]. Eur Radiol, 2020, 30(2): 877–886.
[11] FAN M, YUAN W, ZHAO W, et al. Joint prediction of breast cancer histological grade and Ki-67 expression level based on DCE-MRI and DWI radiomics[J]. IEEE J Biomed Health Inform, 2020, 24(6): 1632–1642.
[12] KIM A R, CHOI K S, KIM M S, et al. Absolute quantification of tumor-infiltrating immune cells in high-grade glioma identifies prognostic and radiomics values[J]. Cancer Immunol Immunother, 2021, 70(7): 1995–2008.
[13] XU X, ZHANG H L, LIU Q P, et al. Radiomic analysis of contrast-enhanced CT predicts microvascular invasion and outcome in hepatocellular carcinoma[J]. J Hepatol, 2019, 70(6): 1133–1144.
[14] MARCUCCI F, BELLONE M, CASERTA C A, et al. Pushing tumor cells towards a malignant phenotype: Stimuli from the microenvironment, intercellular communications and alternative roads[J]. Int J Cancer, 2014, 135(6): 1265–1276.
[15] AKAI H, YASAKA K, KUNIMATSU A, et al. Predicting prognosis of resected hepatocellular carcinoma by radiomics analysis with random survival forest[J]. Diagn Interv Imaging, 2018, 99(10): 643–651.
[16] POWLES T, BELLMUNT J, COMPERAT E, et al. Bladder cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up[J]. Ann Oncol, 2022, 33(3): 244–258.
[17] XU X, ZHANG X, TIAN Q, et al. Three-dimensional texture features from intensity and high-order derivative maps for the discrimination between bladder tumors and wall tissues via MRI[J]. Int J Comput Assist Radiol Surg, 2017, 12(4): 645–656.
[18] MELEGH Z, OLTEAN S. Targeting angiogenesis in prostate cancer[J]. Int J Mol Sci, 2019, 20(11): 2676.
[19] SUAREZ-IBARROLA R, HEIN S, REIS G, et al. Current and future applications of machine and deep learning in urology: A review of the literature on urolithiasis, renal cell carcinoma, and bladder and prostate cancer[J]. World J Urol, 2020, 38(10): 2329–2347.
[20] LIN P, WEN D Y, CHEN L, et al. A radiogenomics signature for predicting the clinical outcome of bladder urothelial carcinoma[J]. Eur Radiol, 2020, 30(1): 547–557.
Predicting the pathological grade of non-muscle-invasive bladder cancer based on enhanced CT radiomics
XIE Min, JIANG Enyan, TANG Chenye, GUO Xiao
1.Graduate School of Zhejiang Chinese Medical University, Hangzhou 310053, Zhejiang, China; 2.Key Laboratory of Biomedical Imaging, the Fifth Affiliated Hospital of Sun Yat-sen University, Zhuhai 519000, Guangdong, China; 3.Department of Urology, Jiaxing Second Hospital, Jiaxing 314000, Zhejiang, China
To explore the diagnostic value of pathological grade prediction model of non-muscle-invasive bladder cancer (NMIBC) based on enhanced CT radiomics.The clinical data of 81 patients with NMIBC who were pathologically diagnosed in Jiaxing Second Hospital from January 2015 to December 2018 were retrospectively analyzed. The patients underwent enhanced CT examination before surgery, and the image data of the cortex and medulla stage and parenchyma stage were collected. The contour of the bladder tumor was outlined, and first-order feature variables, texture variables, shape characteristics and wavelet transform variables were extracted, totaling 1980 feature variables. The max-relevance and min-redundancy (mRMR) algorithm and least absolute shrinkage and selection operator (LASSO) algorithm were used for feature selection. Finally, multiple machine learning algorithms were combined with meaningful feature variables to build a prediction model, which was used to compare the sensitivity, specificity and accuracy of predicting NMIBC pathological grade.mRMR and LASSO were used to screen out 19 characteristic variables, and K-nearest neighbor (KNN), neural networks (NNET), random forest (RF) and support vector machines (SVM) were used to established and verified the model. The four models were established successfully and the results were relatively consistent, among which the RF model was relatively stable, with an accuracy of 91.4% in the verification set. In the test set, the accuracy was 70.0%.Preoperative enhanced CT radiomics combined with machine learning algorithm can accurately predict the pathological grade of NMIBC, and it is of scientific significance to promote personalized treatment of bladder cancer.
Non-muscle-invasive bladder cancer; Enhanced CT; Radiomics; Machine learning; Pathological grading
R737.14
A
10.3969/j.issn.1673-9701.2023.19.013
嘉兴市公益性研究计划(财政资助)项目(2021AY30018)
郭晓,电子信箱:gxchpgyc@163.com
(2023–02–03)
(2023–06–13)
