蝴蝶兰杂交F1代的花部性状遗传分析
2023-08-01杨书才蒋拴丽杨录军王瑞华赵玉安王世尧
王 俊, 冯 建, 杨书才, 蒋拴丽, 杨录军, 张 果, 王瑞华, 赵玉安, 王世尧
(郑州市农林科学研究所, 郑州 450005)
蝴蝶兰(Phalaenopsis)泛指蝴蝶兰属植物,有75个野生种与6个自然杂交种,且已经培育出了超5万个人工杂交种。作为兰科植物中最具有园艺价值的类群,因其色彩艳丽,花形似蝶而得名[1],深受各国人民的喜爱,被誉为“兰花皇后”[1-2]。
目前,杂交育种仍是蝴蝶兰新品种选育的主要手段。蝴蝶兰花被片颜色、花斑分布、唇色、花型等主要观赏性状是选育新品种的重要指标,因此,研究其变异特性和遗传规律,能提高目标性状新品种的选育效率。目前,关于蝴蝶兰杂交F1代的观赏性状分离表现,朱娇等[3],宫子惠等[4]研究发现,杂交后代花色呈梯度分布,出现亲本没有的纹案变化,如均匀斑点、不均匀斑块和条纹,获得比亲本更深的纯色个体,表现超亲优势;李佐等[5-6]用含紫红斑纸质花和纯色纸质花做亲本,发现杂交后代出现了与花斑色近似的全深紫色蜡质花;其他的花卉如月季[7]、菊花[8]等杂交后代同样出现了双亲不具有的花色;王欢等[9]用亚洲百合“Renoir”与兰州百合杂交,结果发现,杂交后代内、外花被片均有突起状紫红色斑点,斑点的大小、数量以及在花被片上的分布范围与亲本相比也更为广泛。
对蝴蝶兰花色、花斑、唇色、花型等重要的花部观赏性状遗传规律已有部分研究,而关于唇部肉突和中裂片的颜色研究较少,具体的色素沉着模式和遗传调控机理也有待进一步的探究。除了常见的玫红色蝴蝶兰外,白花紫红斑蝴蝶兰包含多种色素沉着模式,杂交后代会发现新的组合模式,对蝴蝶兰育种具有重要的研究价值。因此,本研究以“Phal.B”为父本,“V 3”“兰九”“双龙”“光芒四射”分别作为母本进行杂交,通过调查杂交F1代的花色、花斑、唇部肉突颜色、中裂片颜色、唇须、花型等花部性状分离表现,探究其遗传规律,以便为杂交育种亲本选择提供科学依据,从而提高育种效率。
1 材料与方法
1.1 材 料
试验于2019—2021年在郑州市农林科学研究所的连栋温室中进行。供试材料为本所收集的蝴蝶兰种质资源“Phal.B”“V 3”“兰九”“双龙”“光芒四射”及4个杂交组合的后代群体。
1.2 方 法
1.2.1采样方法和测定指标
2015年4月进行授粉杂交,同年9月进行无菌播种与增殖扩繁,2017年3月出瓶种植F1代群体,2018年12月F1代群体首次开花。2019—2021年连续3年的1—3月对“V 3”דPhal.B”(376株)“兰九”דPhal.B”(192株)“双龙”דPhal.B”(232株)“光芒四射”דPhal.B”(127株)4个杂交组合F1代进行相关花部性状的调查、记载并拍照,包括:花色、花斑、唇部肉突颜色、唇部中裂片的颜色、唇须及花型。花色、唇部肉突颜色和中裂片颜色均为定性指标,通过赋值将其量化[10],详见表1。

表1 蝴蝶兰花部颜色及分级标准Table 1 Color and grading standard of Phalaenopsis flower parts
1.2.2计算公式
杂交后代的遗传特点相关计算公式如下:
变异系数/%=(杂种后代标准差/杂种后代平均值)×100%;
占中亲值/%=(杂种后代平均值/中亲值)×100%。
1.3 数据分析
采用Excel 2003、SPSS 26软件对数据进行统计分析。
2 结果与分析
2.1 亲本花部性状表现
本研究杂交组合的5个亲本中,“Phal.B”为白花黄唇,花心有紫红色斑块;“V 3”为白花黄唇;“兰九”“双龙”“光芒四射”均为玫红花,具体的花部性状信息见图1、表2所示。

注:A~E为亲本;F~I为杂交F1代花色分离。图1 蝴蝶兰杂交F1代花色群体分离Fig.1 Separation of floral color groups of F1 generation of Phalaenopsis hybrid

表2 蝴蝶兰亲本性状Table 2 Parental traits of Phalaenopsis
2.2 杂交 F1代花部性状的表现
2.2.1杂交 F1代花色的遗传表现
从图1和表3可以看出,以白花紫红斑“Phal.B”为父本的杂种F1代花被片颜色分离广泛,不同组合的性状差异较大。以“Phal.B”为父本,“V 3”为母本的杂种F1代花被片颜色只分离出了与亲本相同的2种颜色:白底紫红斑(类群2)、纯白花,但后代中花斑的大小和分布范围与亲本相比更为广泛,而且白花(类群4)里有一半的花萼片上分布均匀红色斑点(类群4-2)。以“Phal.B”为父本,玫红色系花作母本的3个组合,其后代花被片颜色分离规律基本一致,花色呈梯度分布,均出现了亲本没有的性状,按照花色花斑分为4种类型:类群1(深紫红色)、类群2(紫红花斑)、类群3(玫红色-粉色)、类群4(白色)。其中类群1特征为花被片深紫红色,花瓣触摸有粗糙和绒质光滑感两种;类群2特征为花被片上有紫红花斑分布;类群3特征为玫红色到浅粉色梯度分布;类群4特征为白色花。以玫红色系作母本的3个组合后代花色虽分离一致,但不同组合花斑、条纹分布差异明显,其中“兰九”דPhal.B”组合后代出现了玫红底紫红花斑(类群2)、彩斑和条纹(类群3-2,3-3,3-4);“双龙”דPhal.B”组合后代出现了白底紫红花斑和条纹,“光芒四射”דPhal.B”组合后代出现了白底紫红花斑和玫红底紫红花斑(类群2-1,2-2)。
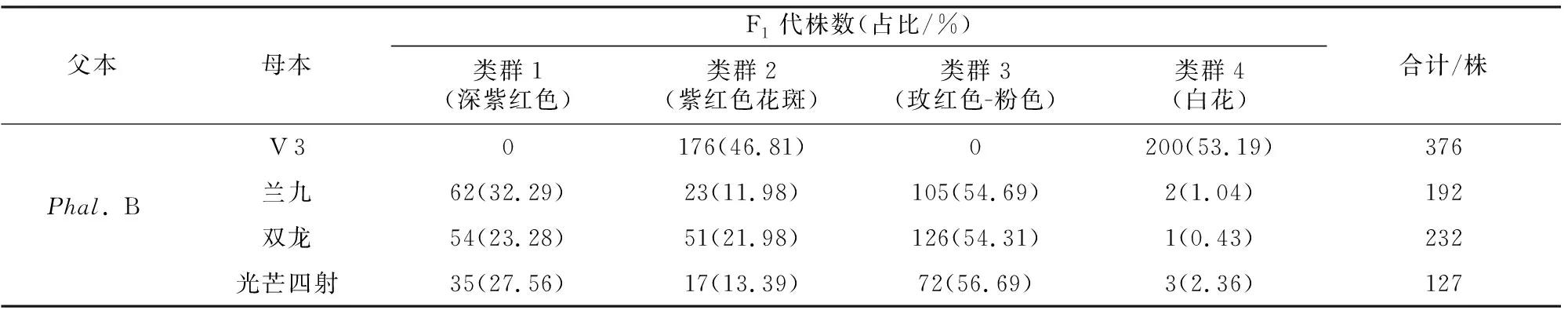
表3 蝴蝶兰杂交F1代花被片颜色分布Table 3 Color distribution of F1 generation tepals of Phalaenopsis hybrids
对比4个杂交组合F1代发现(表3),“V 3”דPhal.B”后代中白底紫红斑和白花所占比例分别为:46.81%,53.19%,有紫红色和无紫红色的分离比为1∶1.14;以玫红色系为母本的3个组合杂交后代中,类群1(深紫红色)和类群2(紫红花斑)为有紫红色,类群3(玫红色-粉色)和类群4(白色)为无紫红色,“兰九”דPhal.B”“光芒四射”דPhal.B”“双龙”דPhal.B”后代中有紫红色与无紫红色的分离比分别为1∶1.23、1∶1.38、1∶1.2。4个组合的后代分离比都趋近1∶1,符合孟德尔一对等位基因的遗传规律,推测紫红色可能是由单基因控制的性状。
以玫红色系作母本的3个组合(表3),“兰九”דPhal.B”“光芒四射”דPhal.B”“双龙”דPhal.B”杂交F1代中类群3(玫红色-粉色)所占比例最高; 类群4(白花)所占比例最低。对比以玫红色系为母本的3个组合杂交F1代发现,“兰九”דPhal.B”“光芒四射”דPhal.B”“双龙”דPhal.B”后代中所占比例类群1(深紫红色)分别为32.29%,23.28%,27.56%,玫红色分别为:20.83%,10.34%,13.39%,类群1(深紫红色)和玫红色所占的比例从大到小均为:“兰九”דPhal.B”、“光芒四射”דPhal.B”、“双龙”דPhal.B”。而且3个组合杂交F1代中类群2虽都表现为紫红花斑,但花的底色有所不同,其中“兰九”דPhal.B”为玫红色,“光芒四射”דPhal.B”为白色和玫红色,“双龙”דPhal.B”为白色。以上结果说明深紫红色花可能是紫红花斑色在花被片上均匀分布,同时和玫红色叠加效应而导致的;紫红色可能是受单基因控制,且相对玫红色是显性,而玫红色可能是由多个基因共同控制的,而且基因越多,表达丰度越高,颜色会越深;杂交后代中母本花被片上玫红色遗传能力表现为:兰九>光芒四射>双龙。
从花瓣颜色赋值来看,4个组合杂交F1代的花色平均占中亲值的112.42%(表5),但不同组合间存在差异。其中“V 3”דPhal.B”后代均值低于中亲值,F1代均介于双亲之间,表现中亲优势。其他3个以玫红色系为母本的组合“兰九”דPhal.B”“双龙”דPhal.B”“光芒四射”דPhal.B”后代花色表现出明显中亲优势和超亲优势。
2.2.2杂交F1代唇部肉突颜色遗传表现
从图2 A和表4可以看出,4个杂交组合杂交F1代中,唇部肉突颜色分离表现一致,由亲本的黄底带紫红斑块和黄底分布均匀红点2种颜色分离出了3种颜色,出现了亲本没有的紫红色性状。其中“V 3”דPhal.B”组合杂交F1代两个群体肉突颜色表现差异明显,类群2白底紫红斑群体中肉突颜色表现为紫红色和黄底带紫红斑块,而类群4白花群体只表现为黄底分布均匀红点。以玫红色系花为母本的3个组合杂交F1代,3种肉突性状在不同群体中的分布有所不同(表4),紫红色和黄底带紫红斑块2种肉突性状只在花被片中有紫红色的群体类群1和群体类群2中出现,而在花被片中无紫红色的群体类群3和群体类群4中则没有表现;黄底分布均匀红点肉突只在F1代群体类群3和群体类群4出现。由表4可知,紫红色和黄底带紫红斑块肉突在同一组合不同群体和不同组合同一群体所占比例都有明显差异,对比同一组合的类群1和类群2发现,3个组合的类群1群体中紫红色肉突所占比例都比类群2群体高;对比3个组合发现,类群1和类群2两个群体中,紫红色肉突所占比例大小一致,均为“光芒四射”דPhal.B”>“兰九”דPhal.B”>“双龙”דPhal.B”。结合相关性分析发现(表7),紫红色肉突、黄底带紫红斑块肉突和花色均有正向相关性;与黄底分布均匀红点肉突则有负向相关性,个别组合甚至达到显著水平。

注:A为杂交F1代肉突颜色分离;B为杂交F1代中裂片颜色分离。图2 蝴蝶兰杂交F1代唇部肉突和中裂片颜色分离Fig.2 Separation of callus and mid-lobe color of lip in F1 generation of Phalaenopsis hybrid
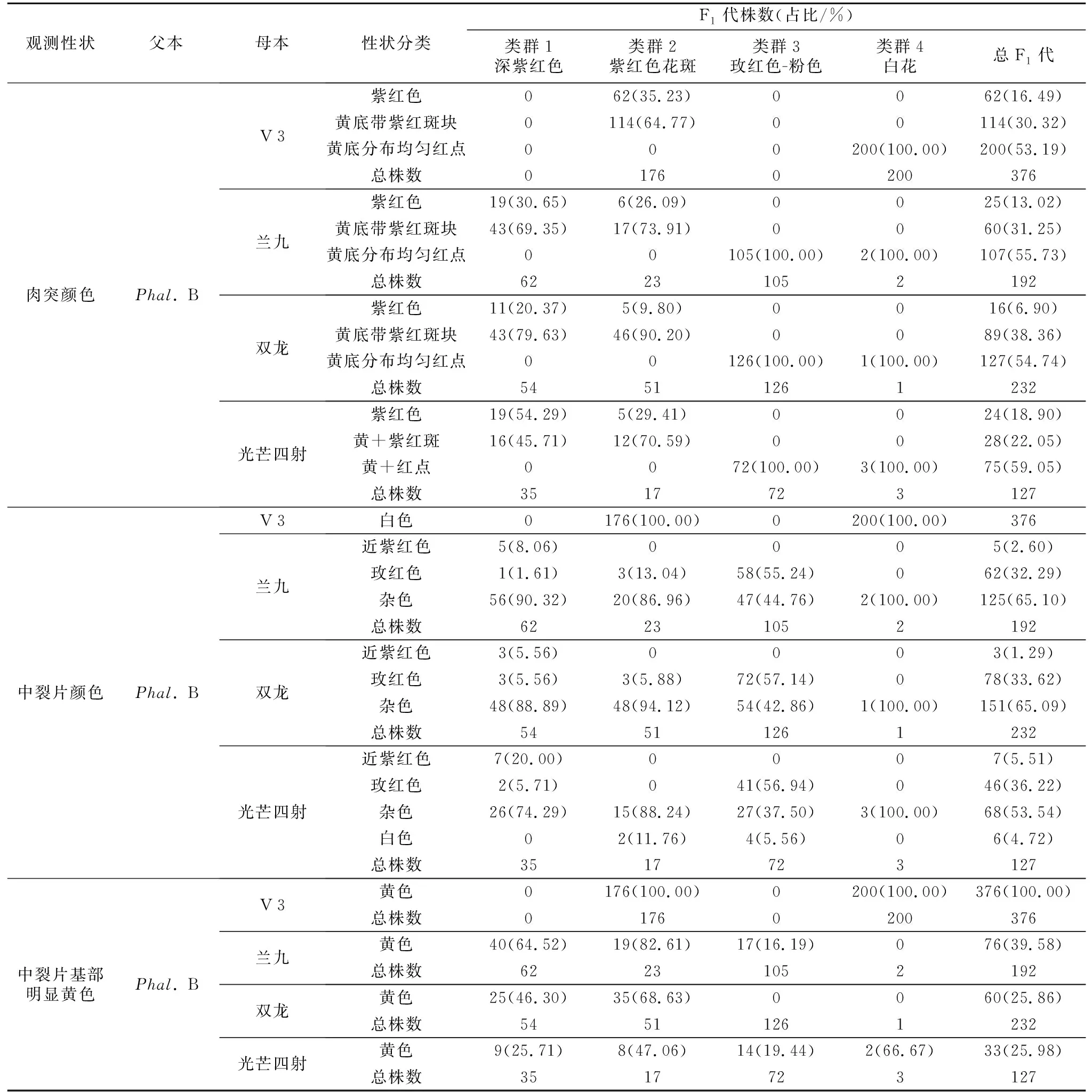
表4 蝴蝶兰杂交F1代唇部肉突和中裂片颜色分布Table 4 Distribution of color of callus and middle lobe of F1 generation of Phalaenopsis hybrid
从唇部肉突颜色赋值来看(表5),4个组合杂交F1代肉突颜色总平均值为中亲值的105.33%,变异系数总平均值为32.7%,双亲值间的平均值为86.17%,大于高亲值的平均值为13.83%。杂交F1代与亲本比较发现,4个组合都介于双亲值间和大于高亲值,没有出现小于低亲值的后代,而且大于高亲值所占比例“光芒四射”דPhal.B”>“兰九”דPhal.B”>“双龙”דPhal.B”。
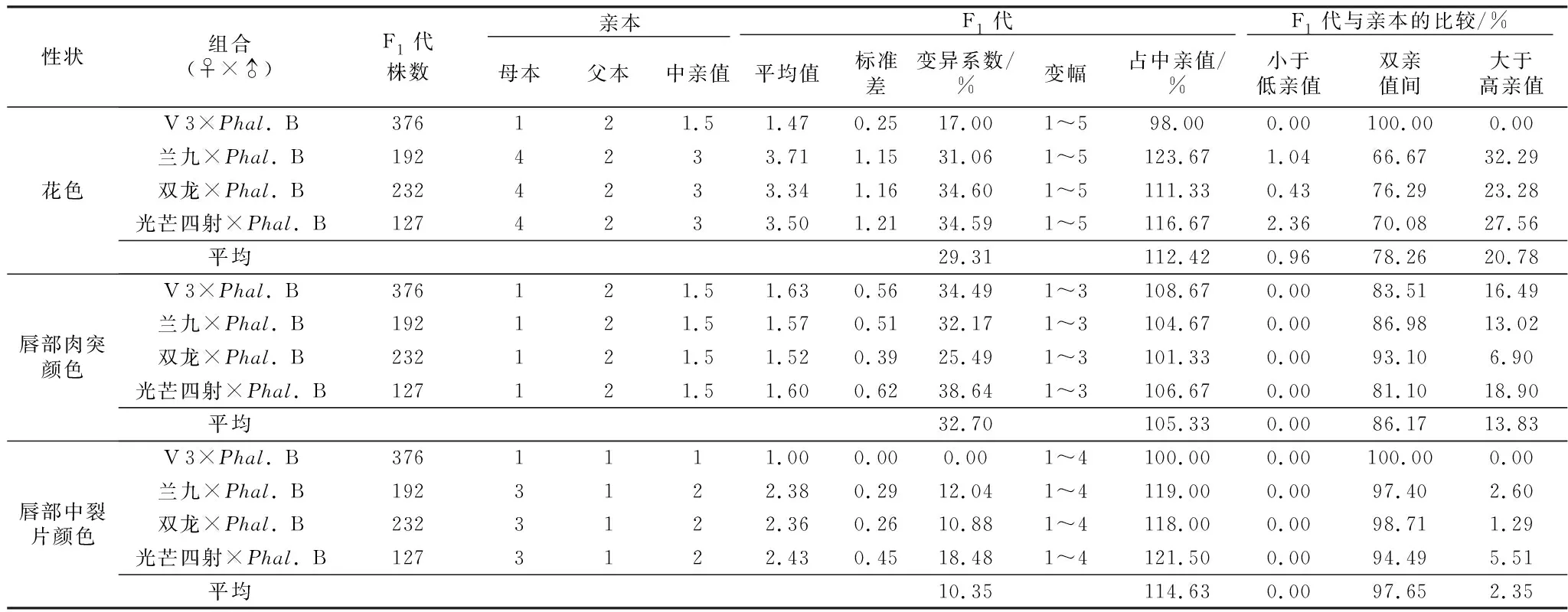
表5 蝴蝶兰杂交F1代花色、唇部肉突和中裂片颜色遗传特点Table 5 Genetic characteristics of flower color, lip flesh protrusion and mid-lobe color in F1 generation of Phalaenopsis hybrid
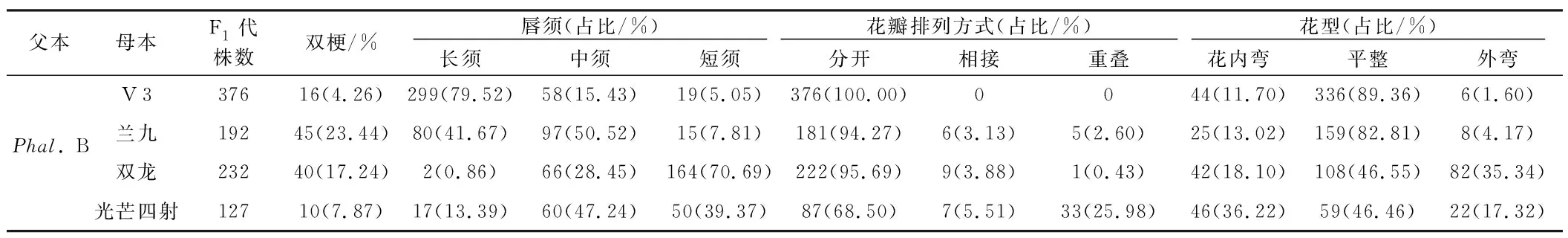
表6 蝴蝶兰杂交F1代唇须、花瓣排列方式、花型分布Table 6 Distribution of lip whiskers, petal arrangement and flower type of F1 generation of Phalaenopsis hybrids
以上结果说明,紫红色肉突是由父本“Phal.B”肉突上的紫红斑色均匀分布而成,占F1代的比例因所选母本品种不同而有所差异;同时紫红色肉突、黄底带紫红斑块肉突与花色存在一定的正向相关性,当花被片上呈现紫红色时,肉突颜色会表现出紫红色或者黄底带紫红斑块,且随着花被片上紫红色越深、分布面积越大,紫红色肉突所占比例会随之增大;而当花被片上没有紫红色时,肉突颜色会表现黄底分布均匀红点。
2.2.3杂交F1代唇部中裂片颜色遗传表现
从图2 B和表4可以看出,亲本中裂片颜色有差异,父本“Phal.B”和“V 3”为白色,其他3个母本都为玫红色,不同组合杂交F1代中裂片颜色分布和分离比例有所不同。其中母本为“V 3”时,子代中全部表现白色且基部有明显黄色;母本为“兰九”和“双龙”时,子代分离出了近紫红色、玫红色、杂色3种颜色;母本为“光芒四射”时,子代分离出了近紫红色、玫红色、杂色、白色4种颜色(图2 B)。以玫红色系为母本的3个组合杂交F1代中裂片基部显黄色的个体,其中裂片为白色或杂色。以玫红色系为母本的3对组合“兰九”דPhal.B”“双龙”דPhal.B”“光芒四射”דPhal.B”杂交F1代,唇部中裂片近紫红色仅在类群1群体中出现,从大到小依次为“光芒四射”דPhal.B”“兰九”דPhal.B”“双龙”דPhal.B”;在子代分离出的中裂片颜色中杂色所占总F1代比例最大,玫红色次之。由相关性(表7)分析可知,近紫红色中裂片与花色、紫红色肉突都有一定的正向相关性。
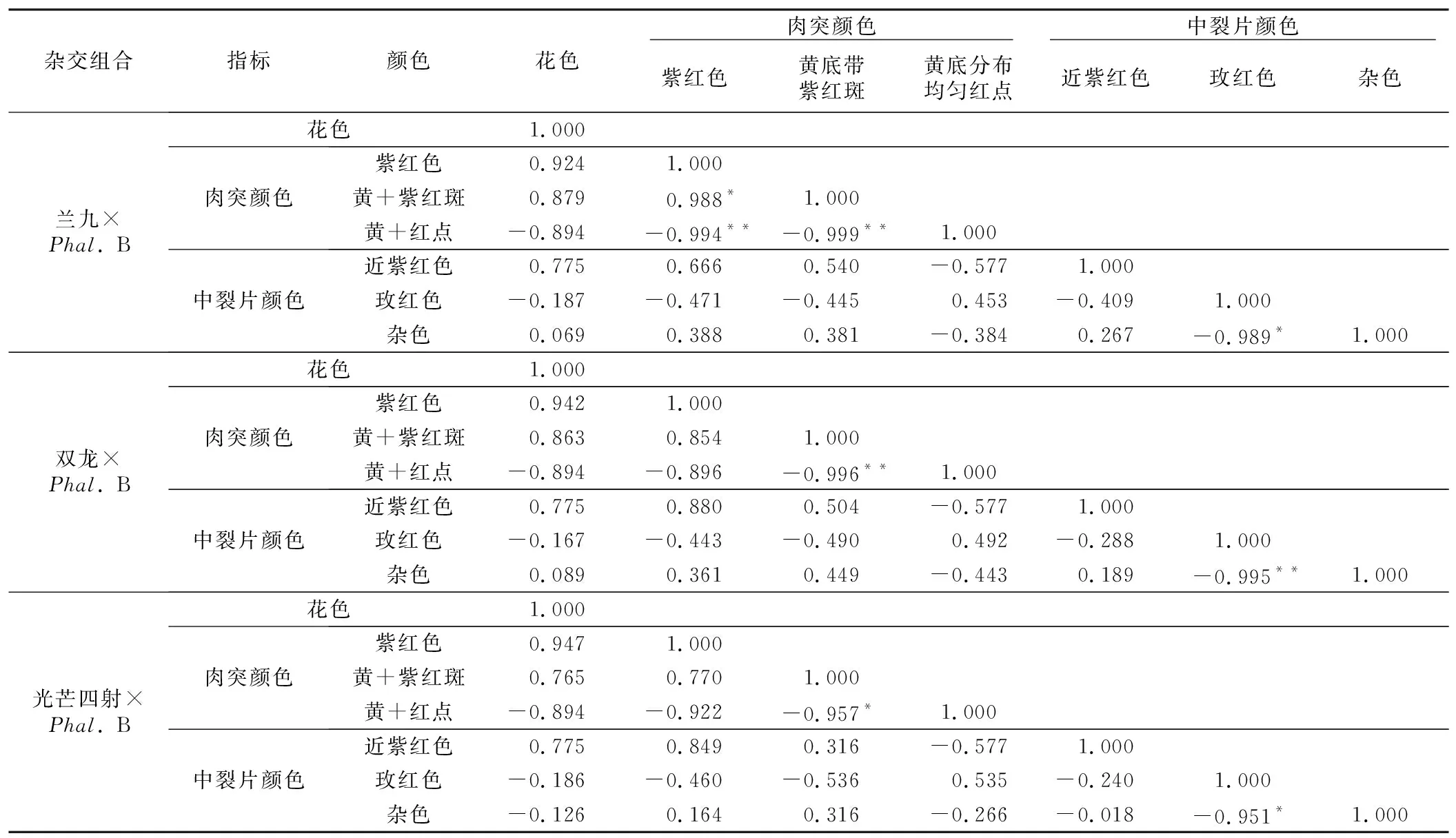
表7 蝴蝶兰杂交F1代花色、肉突颜色和中裂片颜色的皮尔逊相关系数Table 7 Pearson correlation coefficients of flower color, callus color and mid-lobe color of F1 generation of Phalaenopsis hybrid
从唇部中裂片颜色赋值来看(表5),4个组合杂交F1代中裂片颜色平均值占中亲值的114.63%,变异系数总平均值为10.35%,双亲值间的平均值为97.65%,大于高亲值的平均值2.35%。杂交F1代与亲本比较发现,“V 3”דPhal.B”子代中裂片颜色都介于双亲值间,表现中亲优势;以玫红色系为母本的3个组合子代中裂片颜色和肉突颜色遗传特点一样,都是介于双亲值间和大于高亲值,没有出现小于低亲值的后代,而且大于高亲值所占比例大小排列为“光芒四射”דPhal.B”“兰九”דPhal.B”“双龙”דPhal.B”。
2.2.4蝴蝶兰杂交F1代唇须、花瓣排列方式、花型遗传表现
从表6可以看出,杂交F1代唇须分离规律一致,都分离出了3种(长须、中须、短须)。以“V 3”作为母本,杂交F1代中长须最多,占79.52%,短须最少,占5.05%;以“兰九”作为母本,杂交F1代中长须、中须较多,分别占41.67%,50.52%;以“双龙”作为母本,杂交F1代短须最多,中须次之,长须最少,分别占70.69%,28.45%,0.86%;以“光芒四射”作为母本时,杂交F1代中中须和短须较多,分别占47.24%,39.37%。由此可见,长须和长须杂交更容易出现长须,短须和长须杂交更容易出现短须。
以“V 3”作为母本,杂交F1代中花瓣排列方式全部分开,而以玫红色系为母本的3个组合杂交F1代花瓣排列方式分离出了3种:分开、相接、重叠(表6)。其中以“兰九”和“双龙”作母本时,杂交F1代花瓣分开最多;以“光芒四射”作母本时,杂交F1代花瓣分开最多,重叠次之,相接最少。说明当父本花瓣是分开的,母本也是分开时,杂交F1代更容易出现花瓣分开的个体;而当父本的花瓣是分开的,而母本花瓣是重叠时,杂交F1代会出现一定比例的重叠的个体。
杂交F1代花型由亲本的平整分离出了3种:内弯、平整、外弯(表6)。各杂交F1代花型平整的最多,外弯和内弯所占比例有差异,其中以“双龙”作母本时,杂交F1代花型内弯最少,而以“光芒四射”作母本时,杂交F1代花型外弯最少。结果表明,杂交后代中出现了亲本没有的内弯和外弯,可能是环境因素影响,也可能是遗传的影响,有待进一步的研究论证。
3 讨 论
蝴蝶兰花部性状是其最主要的观赏部位,也是新品种选育的主要育种方向。对杂交组合后代的花部性状进行分析,探究杂交后代花色花斑、唇色等性状的分离特点和遗传规律,可为杂交亲本的选择、新品种选育提供参考依据,有效地提高育种效率[11]。
本研究以白底紫斑“Phal.B”为父本,以市场上主流品种白花系“V 3”、玫红系(“兰九”“双龙”“光芒四射”)为母本进行了杂交,杂交后代在花色花斑、唇部肉突、中裂片颜色、唇须、花瓣排列方式和花型6个花部性状上都有不同程度的分离,不同的母本杂交后代的性状分离规律有所差别。在花色遗传上,玫红色系作母本的3对杂交组合后代花色呈梯度变化,出现了比亲本颜色深的深紫红色和比亲本颜色浅的粉色、白色,这与李佐等[5]、宫子惠等[6]在蝴蝶兰花色遗传研究结论一致,表现出超亲优势;在花斑纹案遗传上,杂交后代个体花斑的大小和分布范围与亲本相比更为广泛,这与李佐等[4]、王欢等[9]研究结论一致;4个组合的后代中有紫红色与无紫红色的分离比都趋近1∶1,符合孟德尔一对等位基因的遗传规律,推测紫红色可能是由单基因控制的性状。在唇部肉突颜色和中裂片颜色遗传上,杂交后代的分离规律基本一致,结合相关性分析可知,紫红色肉突、黄底带紫红斑块肉突与花色之间,近紫红色中裂片与花色、紫红色肉突都具有一定的正向相关性。在唇须遗传上,长须和长须杂交更容易出现长须,短须和长须杂交更容易出现中须和短须,要获得长须后代,可选择长须亲本,若想获得短须后代,则可选择短须亲本。
目前对蝴蝶兰花色花斑的成因研究主要集中在花色素和相关花色基因上。研究表明,三色堇[12]、蝴蝶兰[13]紫斑是由花青素在表皮细胞某一特定部位积累形成的,而花青素的积累受基因的稳定遗传控制,即花斑形成是由某些花色素基因在花上的差异性表达所致;关于花斑的形成机理比较复杂,形成花部彩斑的原因主要有嵌合体和病毒病质体、位置效应、叶绿体的分离和缺失、易变基因的体细胞突变、各种类型的染色体畸变[14];推测蝴蝶兰花部纹案受多基因调控结果,可能与易变基因的体细胞突变或转座子的位置效应有关[6],目前研究较多的是花色素结构基因以及调节基因。
赵安瑾[13]通过观察“熊猫”蝴蝶兰色斑区和无斑区解剖结构,发现花斑形成由色斑区上表皮细胞大量花色素积累所致;肖文芳等[15]观察蝴蝶兰白底红斑和黄底红斑区鲜切片观察,发现其表皮细胞形状未发生明显变化,色素种类和含量发生了变化;李佐等[5]研究发现,蝴蝶兰杂交F1代存在颜色较深的花部纹案色会覆盖住颜色较浅花底色的表现;Hsu等[16]用HPLC方法检测了蝴蝶兰白花“V 3”、红花“OX 1408”、白花“紫红斑玉山小珍珠”3个品种的花青苷含量,用显微镜观察了红花“OX 1408”、白花“紫红斑玉山小珍珠”花瓣横切面,结果发现,花青苷总含量蝴蝶兰“玉山小珍珠”比蝴蝶兰红花“OX 1408”增加了10倍,且花青素在蝴蝶兰红花“OX 1408”花瓣中仅分布在正反面表皮细胞、在“玉山小珍珠”花瓣中则分布在大部分的叶肉细胞层。本研究中杂交后代花斑大小、分布面积比亲本范围更大,推测可能是色素的含量不同和不均匀分布造成的;以玫红色系为母本的3对组合杂交后代出现了亲本没有的深紫红色个体,可能是大部分细胞层中紫红色色素和玫红色色素大量积累导致的,而且存在紫红色覆盖玫红色的表现。
蝴蝶兰花色素合成的基因已有广泛报道,涉及到的结构基因有CHS、F3′5′H、F3′H、DFR、ANS、UFGT;调节基因有MYB、bHLH、WD40[17]。研究发现,向蝴蝶兰花瓣中导入F3′5′H基因,转基因植株花瓣颜色由粉红色变成了红紫色[18];杨玉霞等[19]发现,PhF3′H为蝴蝶兰ABP过程中的关键基因;许传俊等[20]发现,ANS在红色和粉红色品种中的表达量较高;研究发现,UFGT是形成红色花的重要基因[21],沉默PeUFGT3后,蝴蝶兰花色变浅,唇瓣出现白色斑点[22]。此外研究发现,MYB转录因子对花青素合成多个结构基因具有正向调控作用,其中PeMYB 2、PeMYB 11和PeMYB 12激活了花青素生物合成基因PeF3H5、PeDFR1和PeANS3的表达,导致蝴蝶兰的红色色素沉着,同时发现在萼片和花瓣中3个转录因子分别参与了红色色素沉着、红色斑点和条纹性状的形成,而在唇部中PeMYB 11参与调控肉突红斑和侧叶内部的红色条纹,PeMYB 12则调控中裂片色素沉着[23];进一步研究证实PeMYB 11对蝴蝶兰深紫色花斑形成起调控作用,同时发现在PeMYB 11的上游调控序列中插入了一个HORT逆转录转座子,它解释了深紫色花斑形成以及高突变率和可变的色素沉着模式[16];此外研究人员还发现,PeMYB 7 与 PeMYB 11的表达是花瓣中独特斑点形成的重要原因,且正向调控PeF3′H和PeANS的表达[24]。
本研究中,4个杂交组合后代中类群1(深紫红色)和类群2(紫红花斑)花被片中有紫红色,而类群3和类群4则没有,且花被片中有紫红色和无紫红色的分离比都趋近1∶1,符合孟德尔一对等位基因的遗传规律,推测父本斑块紫红色可能是由单基因控制的性状;以玫红色系为母本的3对杂交组合后代出现了深紫红色个体,推测可能是紫红花斑色和玫红色色素叠加效应,而玫红色很可能是由多个基因共同控制的,而且基因越多,表达丰度越高,颜色会越深,花色遗传表现中亲和超亲优势;杂交后代中花斑的大小和分布范围与亲本相比更为广泛,可能是由于转座子多变性,导致基因不稳定表达和分布形成的。有关蝴蝶兰花被片中紫红色斑点形成的分子机制还有待进一步的研究。
值得注意的是,蝴蝶兰唇部的着色模式与萼片和花瓣有所不同[22],关于唇部肉突和中裂片颜色是否受花被片颜色影响的研究还未见报道,本研究着重探究了紫红花斑分布对肉突和中裂片颜色的影响,发现在肉突颜色方面,类群1和类群2两个群体中表现出紫红色和黄底分布紫红斑块两种性状,而类群3和类群4两个群体则仅表现黄底分布均匀红点性状;在中裂片颜色方面,只有类群1群体有个体表现出近紫红色,其他3个群体都没有出现该性状。结合相关性分析可知,肉突的颜色与紫红花斑的分布有一定的相关性,当花被片上呈现出紫红色,肉突颜色会显现紫红色,花被片上不呈现紫红色,肉突颜色则不会显现紫红色;只有花被片整体呈现深紫红色时,中裂片才有可能会出现近紫红色性状。结合前人研究证实PeMYB 11是对蝴蝶兰深紫色花斑形成起调控作用,同时PeMYB 11和PeMYB 12不仅参与调控萼片和花青素合成,还参与调控唇部色素沉着,推测本研究结果具有合理性,有关花被片和唇部中紫红色沉着模式和调控机理还有待验证。
本研究仅从观赏性状的形态学对白花紫红斑和不同亲本的杂交后代进行观察分析,对于花色遗传规律研究还需要从花瓣的解剖结构、色素沉着模式和调控机制等多个方面进行进一步研究。
