湖北花楸种胚离体培养与快繁技术研究
2023-08-01刘良梦赵桃娟左燕平
刘良梦, 赵桃娟, 黄 振, 刘 欣, 丁 婷, 陈 炙, 左燕平
(四川省林业科学研究院/森林和湿地生态恢复与保育四川省重点实验室, 成都 610081)
湖北花楸(Sorbushupehensisc. K. Schneid.)别名雪压花,蔷薇科花楸属落叶乔木,耐寒冷,天然分布于中国中西部地区,常以单株形式混生于阔叶林中,尚未发现湖北花楸种群。湖北花楸是阿坝州著名的彩叶树种,秋季满树红叶,叶落后白果满枝头,极具观赏价值,是彩叶林带的骨干树种。
发展生态旅游,优化彩叶林带树种结构,是阿坝州乡村振兴的重要内容,而培育以湖北花楸为代表的彩叶树种种苗是彩叶林高质量发展的基础。目前,尚未有湖北花楸种苗批量化培育的报道,花楸属种子的休眠[1]现象是种子繁育的主要障碍。因此,开展湖北花楸组织培养研究,建立黑水花楸组培再生技术体系,是实现黑水花楸规模化育苗的有效途径。目前,花楸属的组织培养仅在少数种上获得成功,朱虹等[2]以当年生嫩梢为外植体、马盈等[3]以腋芽为外植体、卢芹[4]以带芽茎段和叶片为外植体,建立了欧洲乔木花楸组织培养再生体系;刘行等[5]、张成霞等[6]以种子为外植体,将无菌苗的嫩芽作为增殖材料获得了黑果腺肋花楸生根苗,而湖北花楸组织培养尚未见报道。本研究以湖北花楸种子为外植体,研究了激素类型和浓度对种胚萌发、丛生芽诱导、幼苗生根的影响,建立湖北花楸组培再生技术体系,为湖北花楸优树资源的开发和利用提供支撑。
1 材料与方法
1.1 实验材料与处理
采样母株位于阿坝州黑水县沙石多乡干斯坝村302省道边(32°5′21.10″N,102°46′58.61″E),挑选无病害、圆润饱满的果实,搓洗掉果肉,在超净工作台上把种子放入0.1%氯化汞消毒10 min,无菌水洗4次后,剥离种皮,取出完整种胚,转入MS+30.0 g/L蔗糖+7.0 g/L卡拉胶的初代培养基中暗培养,7 d后淘汰污染材料,无菌种胚转入诱导培养基。
1.2 诱导培养基筛选
无菌种胚平铺在添加不同浓度(0.25 mg/L和0.5 mg/L)6-苄基腺嘌呤(6-BA)、(0.05 mg/L和0.1 mg/L)吲哚丁酸(IBA)或(0.05 mg/L和0.1 mg/L)萘乙酸(NAA)组合的诱导培养基上培养30 d,每瓶接种1个种胚,每个处理接种10瓶,重复4次。30 d后统计平均萌发率并观察生长表现。
1.3 增殖培养基筛选
将1.2获得的萌芽切成1.5 cm长,带有2~3个腋芽的茎段,把茎段转入添加了不同浓度(0.25,0.5 mg/L和1.0 mg/L)6-BA和(0.02,0.04 mg/L和0.06 mg/L)IBA组合的诱导培养基上培养30 d,每瓶接种10个带芽茎段,每个处理接种5瓶,重复4次。30 d后统计每个处理平均增殖率和平均芽诱导数并观察生长表现。
1.4 生根培养基筛选
将有效芽苗(高≥1.5 cm、叶片数≥3)从茎段上切下转入添加了不同浓度(0,0.1,0.5,1.0 mg/L)NAA和(0,0.04,0.1 mg/L)IBA组合的生根培养基上培养30 d。每个处理接种5瓶,每瓶10株,重复4次。30 d后统计各处理的平均生根率、平均生根数,综合芽苗生长表现,筛选最佳生根培养基。
1.5 培养条件
除特殊说明外,培养条件均为培养温度(25±2)℃,光照强度为2 500 lx,光照周期12 h/d。培养基均添加30.0 g/L蔗糖和7.0 g/L卡拉胶,pH值为5.8。
1.6 数据处理与分析
平均萌发率/%=(每瓶芽正常萌发的苗总数/每瓶种胚数)×100%;
平均芽诱导数=每瓶上诱导出的芽总数/每瓶外植体数;
平均增殖率/%=(每代有效茎段数/初始接种茎段数)×100%;
平均生根率/%=(每瓶中能生根的芽苗数量/接种芽数)×100%;
平均生根数=每株苗基部萌发的长度≥1.5 cm、清洗不脱落的不定根数/生根芽苗数。
采用DPS 16.05软件对实验数据进行Tukey法单因素方差分析,百分数采用反正弦平方根转换后再进行方差分析。
2 实验结果
2.1 诱导培养基筛选
饱满的湖北花楸种子去种皮后种胚完整度高(图2 B),没有败育现象,说明自然状态下的种子难萌发不是由于种胚发育不完全所致,组培前处理去掉的外种皮可能是抑制种子萌发的主要障碍之一。而培养在不含激素的ck处理中的种胚平均萌发率仅5%,说明种胚存在休眠现象,需要外源激素的刺激打破休眠。
种胚接种到诱导培养基上2 d后开始萌动(图2 C),子叶伸展,随后子叶颜色逐渐由白变绿(图2 D),15 d时下胚轴生长出胚根,胚根往下弯曲生长至培养基内部,胚轴延长将子叶往上抬,使得子叶脱离培养基表面(图2 E黑三角处),同时胚芽发育出真叶(图2 E箭头处)。
萌发的种胚在不同诱导培养基上的生长表现差别较大,不同诱导培养基的种胚平均萌发率存在显著差异(表1)。IBA对种胚的萌发率影响较大,6-BA则对种胚萌发后芽的生长影响较大,NAA对种胚的萌发或有抑制作用,ck的种胚萌发率仅为5%。
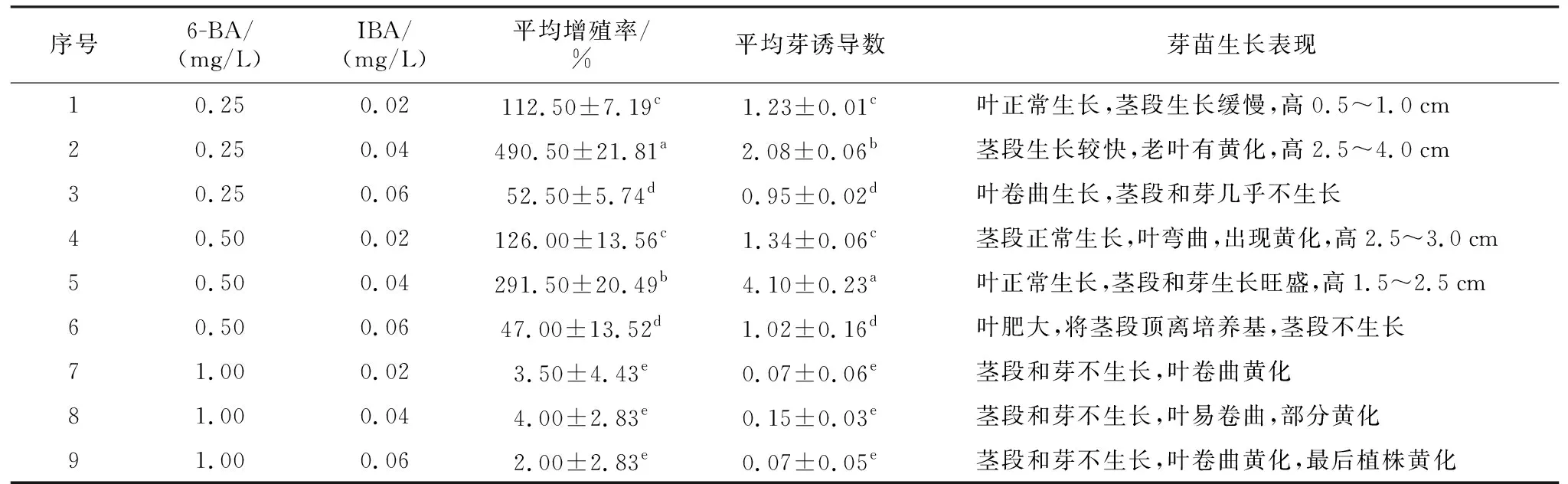
表2 湖北花楸茎段在不同增殖培养基中的生长表现Table 2 Growth performance of Sorbus hupehensisc. K. Schneid. stems in different proliferation media
1~4号诱导培养基中添加的6-BA浓度为0.25 mg/L。1号培养基添加0.05 mg/L IBA,芽生长正常(图1 A),平均萌发率达90%;随着IBA浓度升高为0.1 mg/L,2号培养基中芽正常生长,平均萌发率降低至85%,但与1号培养基的种胚平均萌发率差异不显著。3号培养基添加0.05 mg/L NAA,平均萌发率为12.5%,已萌发胚芽的顶芽在长出1~2片真叶后生长停滞(图1 C),胚根逐步变黑并死亡(图1 D),随着NAA浓度升高为0.1 mg/L,平均萌发率降至5%;4号培养基中,下胚轴稍微膨大后即褐化死亡(图1 E箭头处)。

注:A为诱导培养基1中胚芽明显伸长的外植体;B为诱导培养基2中的外植体,胚芽伸长不明显;C为诱导培养基3中的外植体,黑三角示未伸长的胚芽;D为诱导培养基3中的异常外植体,箭头示胚根黄化,黑三角示胚芽未伸长;E为诱导培养基4中的外植体,箭头示下胚轴褐化死亡;F为诱导培养基5中的外植体,胚芽伸长生长,黑色框为两个新芽特写;G为诱导培养基6中的外植体,下胚轴生长快,胚芽伸长生长,箭头示新生叶片易枯黄;H为诱导培养基7中的异常外植体,胚芽未发育(黑三角处),子叶和下胚轴发育;I为诱导培养基8中的死亡外植体,胚芽稍伸长,子叶褐化,箭头示顶芽。图1 湖北花楸种胚在不同诱导培养基中的典型表现Fig.1 Typical performance of Sorbus hupehensisc. K. Schneid. seed embryos in different induction media

注:A为带种皮的湖北花楸种子;B为去掉种皮的湖北花楸种胚,箭头示下胚轴;C为湖北花楸种胚接种2 d,箭头示子叶;D为湖北花楸接种7 d,箭头示子叶变绿;E为湖北花楸接种15 d,箭头示真叶。图2 湖北花楸种胚在5号诱导培养基上的萌发过程Fig.2 Germination process of Sorbus hupehensisc. K. Schneid. embryo on No.5 induction medium
5~8号诱导培养基中添加的6-BA浓度为0.5 mg/L。5号培养基添加0.05 mg/L IBA,平均萌发率可达95%,显著高于除1号诱导培养基以外的其他诱导培养基,部分胚苗顶芽的腋芽也会萌发,腋芽强健,稍小于顶芽(图1 F),胚苗长出4~8片深绿色真叶,胚根白色或淡黄色,根长2.0~4.0 cm;随着IBA浓度升高为0.1 mg/L,平均萌发率降为82.5%,腋芽发生数减少,大部分只是顶芽萌发,初始2片真叶翠绿,后续新芽发育异常,易枯黄,下胚轴下半部稍膨大,与培养基接触部位呈黑灰色(图1 G);7号培养基添加0.5 mg/L NAA,平均萌发率为10%,大部分胚芽不发育,子叶畸形,胚根不萌发(图1 H),随着NAA浓度升高为0.1 mg/L,平均萌发率为2.5%,种胚不萌发或种胚萌发中褐化死亡(图1 I)。
综上所述,5号诱导培养基为诱导湖北花楸种胚萌发的最佳培养基。
2.2 增殖培养基筛选
由于在种胚诱导培养阶段,NAA对胚芽的生长起抑制作用,而IBA促进胚芽的生长,故而在增殖阶段设计6-BA与IBA组合试验,在诱导培养基中添加0.25 mg/L 6-BA的基础上,增加了IBA浓度的培养基组合,以筛选适宜于腋芽分化和生长的激素组合。
结果表明,湖北花楸茎段转入不同增殖培养基后,平均增殖率和平均芽诱导数差异显著。
1~3号增殖培养基中均添加了0.25 mg/L 6-BA,其中以添加0.04 mg/L IBA的2号增殖培养基中的茎段长势最好,生长较快,茎长2.5~4.0 cm,芽竖直向上生长,适合作为生根材料,每个芽可切作2~3份增殖材料,平均诱导出2.08个芽,平均增殖率490.5%,老叶有黄化现象(图3 B箭头处),但不影响继续培养。1号增殖培养基添加IBA浓度0.02 mg/L的芽生长相对缓慢,茎段细小,高度较2号增殖培养基矮,芽丛基部易褐化(图3 A箭头处),仅叶柄伸长并向上生长,平均增殖率为112.5%,几乎没有新的增殖材料;IBA浓度为0.06 mg/时L,茎段和芽几乎不生长,叶弯曲生长(图3 C箭头处)。

注:A为增殖培养基1中的外植体,箭头示茎段细且短;B为增殖培养基2中的外植体,植株健壮呈绿色,箭头示植株基部叶变黄;C为增殖培养基3中的外植体,箭头示叶弯曲;D为增殖培养基4中的外植体,箭头示叶变黄;E为增殖培养基5中的外植体,黑三角示同一茎段出芽;F为增殖培养基6中的外植体,箭头示叶宽大影响植株生长;G为增殖培养基7中的外植体,箭头示叶弯曲变黄;H为增殖培养基8中的外植体,箭头示叶卷曲枯黄死亡;I为增殖培养基9中的外植体。图3 湖北花楸茎段在不同增殖培养基中的典型表现Fig.3 Typical performance of Sorbus hupehensisc. K. Schneid. stems in different proliferation media
4~6号增殖培养基中均添加了0.5 mg/L 6-BA。5号增殖培养基添加0.04 mg/L IBA,茎段平均诱导4.1个芽,显著高于其他处理,但茎段伸长并不明显,茎长1.5~2.5 cm,大部分新芽在下一次的增殖中不能切为2份增殖材料,芽向上或向培养基内生长(图3 E黑三角处);4号增殖培养基中的IBA浓度为0.02 mg/L,此时茎段伸长明显,茎长2.5~3.0 cm,但叶片弯曲出现黄化(图3 D箭头处),平均芽诱导数1.34个;6号增殖培养基中的IBA浓度为0.06 mg/L,叶片变得宽大影响植株生长,甚至部分叶片接触培养基后生长失控并将芽苗顶出培养基(图3 F箭头处),茎段几乎不伸长生长,平均诱导出1.02个芽。
7~9号增殖培养基添加的6-BA浓度为1.0 mg/L时,茎段和芽均不生长,且叶卷曲黄化(图3 G箭头处),随着IBA浓度升高,叶黄化加剧(图3 H箭头处),9号培养基中添加0.06 mg/L IBA,整个植株枯黄(图3 I),植株生长受到抑制。
综上所述,2号增殖培养基(MS+0.25 mg/L 6-BA+0.04 mg/L IBA)、5号增殖培养基(MS+0.5 mg/L 6-BA+0.04 mg/L IBA)为适宜的增殖培养基。
2.3 生根培养基筛选
由于增殖培养基中的芽丛诱导率高,为避免芽苗在生根中腋芽萌发增殖,因此在生根培养基中未添加6-BA,在增殖培养阶段,IBA浓度0.04 mg/L的基础上进行了调整(表3),并根据生根效果,增加了含NAA的组合。
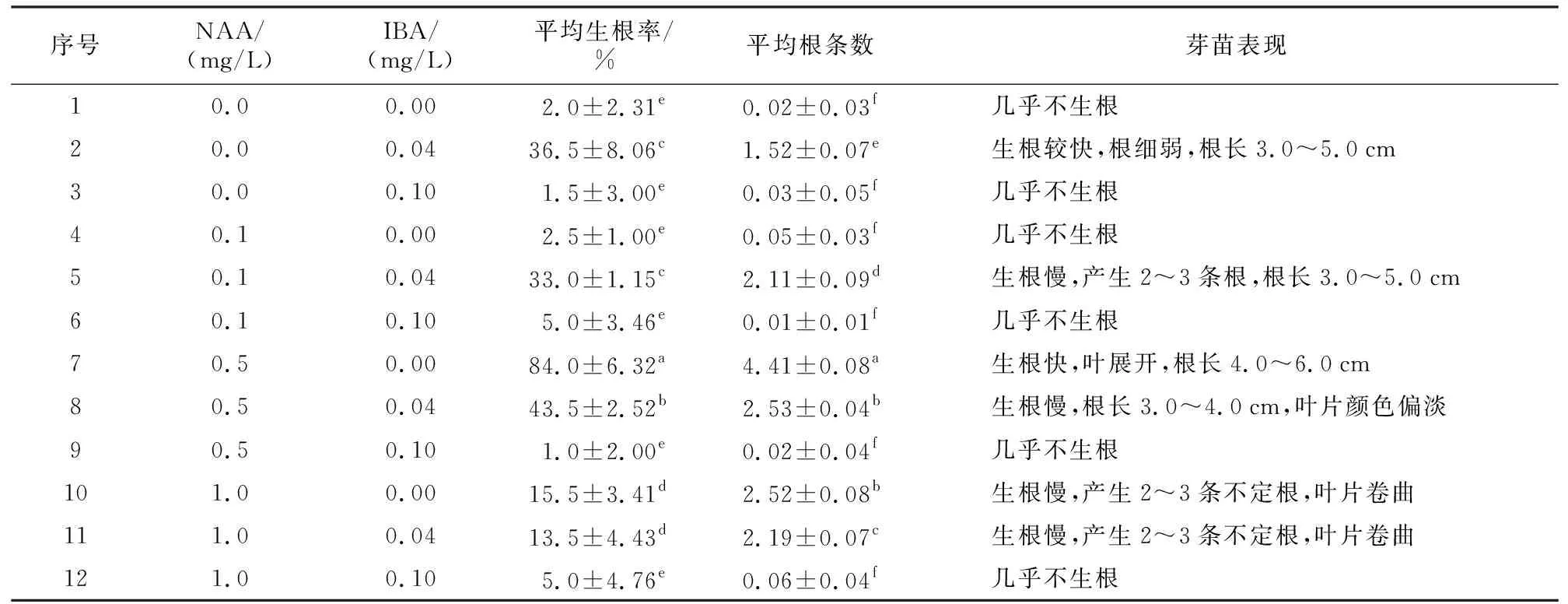
表3 湖北花楸生根培养基筛选Table 3 Screening of Sorbus hupehensisc. K. Schneid. rooting medium
1~3号生根培养基不添加NAA,1号生根培养基中未添加外源激素,结果表明,平均生根率仅为2%,芽苗几乎不生根。2号生根培养基中含有与增殖培养基相同浓度的0.04 mg/L IBA,平均生根率为36.5%,但根系不完整,根数少,平均为1.52条根,多数芽苗仅产生1条根(图4 A黑三角处)。IBA浓度为0.1 mg/L时,芽苗平均生根率降至1.5%;不添加IBA,芽苗平均生根率仅为2%。

注:A为生根培养基2中的芽苗,黑三角示一条根;B为生根培养基5中的芽苗,黑三角示不定根;C为生根培养基7中的芽苗,白色框为不定根和白色愈伤特写;D为生根培养基7中的芽苗,黑三角示不定根;E为生根培养基8中的芽苗,箭头示叶片透明;F为生根培养基10中的芽苗,箭头示叶卷曲,黑三角示不定根。图4 湖北花楸芽苗在不同生根培养基中的典型表现Fig.4 Typical performance of Sorbus hupehensisc. K. Schneid. bud in different rooting media
4~6号生根培养基在1~3号生根培养基的基础上,分别添加了0.1 mg/L NAA。结果发现,4号生根培养基与1号生根培养基相比差异不显著,芽苗基部亦无不定根分化。
5号生根培养基平均生根率为33%,与2号生根培养基相比差异不显著,但芽苗平均根数为2.11条,显著高于2号生根培养基中的芽苗平均根数,但出根慢,培养30 d茎段已伸长至3.0~5.0 cm,才开始产生不定根,少数芽苗产生3条不定根(图4 B黑三角处),而6号培养基中IBA浓度为0.1 mg/L,平均生根率反而下降至5%。继续提高生根培养基中NAA浓度至0.5 mg/L,发现平均生根率显著提高。7号生根培养基中未添加IBA,平均生根率达84%,芽苗基部先产生白色愈伤组织,然后愈伤组织分化出数条不定根(图4 C白色框部分),芽苗平均根数可达4.41条,随后不定根伸长生长,同时叶展开,芽苗向上生长,植株高3.5~5.0 cm,根长4.0~6.0 cm(图4 D黑三角处)。8号生根培养基在此基础上添加0.04 mg/L IBA后,平均生根率降低至43.5%,芽苗平均根数降至2.53条,说明芽苗生根受到抑制,同时叶片颜色变浅(图4 E箭头处);随IBA浓度升高为0.1 mg/L,平均生根率下降至1%。
当生根培养基中NAA浓度为1.0 mg/L时,10~12号生根培养基中的芽苗生长均不正常,10号生根培养基中的芽苗叶片容易卷曲,基部先产生白色愈伤组织,随后白色愈伤组织慢慢变黄,部分黄色愈伤分化出不定根(图4 F黑三角处),平均根数为2.52条,根长2.0~4.0 cm,但不定根生长慢,随IBA浓度升高,平均生根率和平均生根条数降低。
综上所述,7号生根培养基(MS+0.5 mg/L NAA)为湖北花楸最佳生根培养基。
3 讨 论
花楸属植物树型挺拔、叶色多变、果实宿存,是四季可赏的园林景观优良树种[7],黑水花楸是川西高原地区原生花楸属植物,是高原地区打造彩叶林的理想树种。培育成片湖北花楸林是建设高质量“万山红遍,层林尽染”的有效途径,因此,有必要通过组培快繁的方法,解决湖北花楸实生繁育困难的难题。
种子萌发是种胚培养获得成功的关键[8]。沈海龙等[9]研究发现,低温沙藏可以解除花楸种子休眠;梁立东等[10]研究表明,西伯利亚花楸种子萌发率仅38.25%。本研究发现,在合适的培养基中,离体胚可正常萌发成苗,而在不含激素的培养基中,种胚平均萌发率很低,需要外源激素打破休眠,诱导种胚萌发。
花楸属植物增殖培养阶段,激素类型和浓度不适应,幼苗叶片容易发生卷曲,或出现玻璃化等现象[11-12],导致有效芽数量低使得生根材料不足,既影响生根芽苗质量,也不利于继续增殖培养。本研究发现,IBA对芽生长的影响较大,且解决了湖北花楸增殖培养时出现的叶卷曲和玻璃化现象。
生根培养是组培快繁的最后环节,是决定组培苗出圃时根系数量和活力的关键,生长素是植物生根的主要影响因素[13]。本研究通过添加不同浓度的NAA与IBA,发现芽苗在含有0.5 mg/L NAA的生根培养基中可诱导出不定根,而IBA对芽苗不定根的诱导效果不明显,在后续的研究中需要进一步优化配方,减少愈伤组织的发生,直接诱导不定根从芽苗基部萌发。
本研究建立了湖北花楸种胚组培再生技术,与其他花楸属植物组织培养研究结果不同,祁爽[14]研究表明,欧亚花楸芽苗在1/2 MS+0.2 mg/L NAA+0.2 mg/L IBA培养基中生根最好;以一年生黑果腺肋花楸嫩枝为外植体诱导出腋芽,转入MS+1.0 mg/L 6-BA+0.08 mg/L NAA培养基中增殖,该研究认为NAA和IBA组合有利于黑果腺肋花楸生根,芽苗在1/2 MS+0.1 mg/L NAA+0.2 mg/L IBA培养基上平均生根率95%[15-16];陆爽等[17]认为,添加0.5 mg/L IBA的培养基中黑果腺肋花楸芽苗生根率最高100%;陈士刚等[18]发现,2.8 mg/L IBA适合艳丽花楸生根。说明不同花楸属植物组培快繁技术之间的借鉴作用不大。
在构建了湖北花楸种胚快繁技术的基础上,课题组将开展轻基质育苗试验,并在川西高原开展无性系造林试验,以构建完整的湖北花楸组培快繁和栽培技术体系。
