干扰NETO2通过调控JAK2/STAT3信号通路抑制肺腺癌细胞增殖和转移能力
2023-08-01李春姗赵宁生
文 礼,李春姗,李 娇,赵宁生,姚 菲
1广西中医药大学第一附属医院呼吸与危重症医学科,广西南宁 530022;2.广西中医药大学第一附属医院仙葫院区肿瘤二区,广西南宁 530022
肺癌具有高发病率和病死率,非小细胞肺癌(NSCLC)是肺癌常见的亚型,约占肺癌病例的85%,肺腺癌是NSCLC的主要组织学类型[1]。EGFR突变是肺腺癌中最常见的分子突变类型,随着表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)分子靶向药物的发展,患者的临床治疗和预后得到了极大的改善。但是大多数患者在治疗12~24个月后对EGFR-TKI产生一定的耐药性,因此肺腺癌患者的预后仍然较差[2]。同时其高病死率的主要原因是该疾病的高转移能力[3]。因此,研究促进肺腺癌进展和转移的关键蛋白质和信号通路有助于开发抗肿瘤活性的新疗法。神经纤毛及唾样蛋白2(NETO2)基因位于16号染色体上,编码单通道跨膜蛋白,主要分布于大脑,其在神经特异性过程中发挥重要生物学功能[4]。越来越多的研究显示NETO2在恶性肿瘤中发挥促癌作用,食管癌中NETO2高表达,并通过上调ERK和PI3K/AKT信号通路促进食管癌的恶性进展[5]。在胰腺癌中NETO2通过激活STAT3信号通路促进肿瘤细胞增殖和转移[6],以及在鼻咽癌和结直肠癌中NETO2均发挥促癌作用,可作为抗肿瘤治疗的潜在分子靶点[7-8]。ZHANG等[9]研究报道在肺腺癌组织中,SNHG17通过靶向miR-193a-5p/NETO2轴来发挥肿瘤促进作用,但是NETO2在肺腺癌中的表达及发挥的具体作用未知,因此本文对此进行了研究,以期获得NETO2作为抗肺腺癌治疗的分子靶点。
1 材料与方法
1.1试剂 甲醛、无水酒精及二甲苯购自山东华昱化工科技有限公司;肺腺癌组织芯片购自西安泰博斯生物科技有限公司;免疫组化检测试剂盒购自丹麦DAKO公司;枸橼酸钠抗原修复液和PARP蛋白裂解试剂购自北京索莱宝试剂公司;DMEM-F12培养基、胎牛血清和青霉素/链霉素双抗购自美国Gibco试剂公司;肺腺癌细胞系A549购自美国ATCC细胞库;NETO2 siRNA购自上海瑞博试剂有限公司;Lip2000购自美国Invitrogen公司;BCA蛋白水平检测试剂盒购自美国Thermo公司;PVDF膜购自美国millipore试剂公司;ECL化学发光试剂盒购自北京百奥莱博公司;MTS试剂购自美国sigma公司;Transwell小室购自美国coring公司;NETO2、JAK2、STAT3、pJAK2、pSTAT3和GAPDH一抗抗体购自英国Abcam公司。
1.2研究对象 组织芯片包括肺腺癌组织和其配对的癌旁组织标本(距离肿瘤3 cm内的非肿瘤)135例,每例组织最大径1.5 mm,每张组织均经病理证实诊断为肺腺癌,并由公司提供完整的病理资料,包括年龄、性别、T分期、淋巴结转移和TNM分期,以及术后5年的随访资料。
1.3方法
1.3.1免疫组化实验 组织芯片于30 min内放入4%甲醛中充分固定6 h,通过乙醇脱水、石蜡浸没,包埋成组织蜡块。并切成4 μm的石蜡切片,放入烤箱1 h熔蜡后,将切片放入二甲苯中30 min进行脱蜡,并依次放入无水乙醇、90%乙醇、80%、75%和70%的乙醇中各5 min,以及双蒸水中30 min进行水化,随后放置枸橼酸钠抗原修复液中高温煮沸30 min。将切片与过氧化氢孵育30 min以封闭非特异性抗原后,将切片与NETO2一抗稀释液(稀释比例1∶200)孵育,并4 ℃孵育过夜。二抗稀释液(稀释比例1∶8 000)孵育37 ℃ 30 min,采用试剂盒进行组织染色、苏木素复染,封片并晾干后在显微镜下观察染色强度及面积进行相应的评分。由两名独立的病理学家进行,染色强度评分标准:无着色为0分,淡黄色着色为1分,黄色着色为2分和深黄色着色为3分。染色面积:<5%为0分,5%~25%为1分,>25%~50%为2分,>50%~75%为3分和>75%为4分。染色强度得分乘以染色百分比评分计算最终得分,高表达或者阳性表达(得分>2分)和低表达或者阴性表达(得分≤2分)。
1.3.2细胞培养 复苏肺腺癌细胞系A549后,采用含有10% 胎牛血清及100 U/mL青霉素、链霉素的双抗生素的DMEM-F12完全培养基培养,并放置在含有5% CO2的37 ℃加湿培养箱中培养。细胞融合度为95%时,采用胰酶消化细胞,进行细胞传代,继续培养,用于后续的实验研究。
1.3.3NETO2 siRNA转染细胞 肺腺癌细胞A549处于对数生长期,细胞状态较好时,采用胰酶消化并计数,并以2.0×105个细胞铺至6孔板中,放置在含有5%CO2的37 ℃加湿培养箱中培养。培养8 h,细胞贴壁后更换无血清细胞培养基,并随机分为si-NC组和si-NETO2-1、si-NETO2-2组,依据Lip2000说明书进行NETO2 siRNA的转染。si-NC组细胞转染5 μg NC siRNA和2 μL Lip2000,si-NETO2-1组细胞转染NETO2 siRNA-1和2 μL Lip2000,si-NETO2-2组细胞转染5 μg NETO2 siRNA-2和2 μL Lip2000。各组细胞放置在含有5% CO2的37 ℃加湿培养箱中培养,12 h后更换含有10% 胎牛血清的DMEM-F12完全培养基继续培养。
1.3.4Western blot检测蛋白的表达 胰酶消化收集si-NC组和si-NETO2-1、si-NETO2-2组A549细胞,PBS重悬洗涤细胞2次,获得细胞斑块。加入适量的PARP蛋白裂解液裂解细胞,于4℃离心机中高速离心30 min,获得蛋白质上清液。采用BCA蛋白质检测试剂盒测得蛋白水平。通过10%SDS-PAGE凝胶分离蛋白质,并将蛋白湿转至PVDF膜上。将膜与5%的牛血清清蛋白常温孵育1 h,然后在4 ℃下与一抗稀释液(NETO2、JAK2、STAT3、pJAK2、pSTAT3稀释比例均为1∶500)孵育过夜,TBST洗3次后,与HRP偶联的山羊抗小鼠IgG(稀释1∶5 000)或山羊抗兔IgG(稀释1∶5 000)室温孵育1 h。TBST洗3次后,采用ECL试剂盒曝光蛋白条带。
1.3.5MTS实验 胰酶消化收集si-NC组和si-NETO2-1、si-NETO2-2组A549细胞,并计数后铺至96孔板中,每组6个重复孔,每孔2 000个细胞、150 μL DMEM-F12完全培养基,放置在含有5%CO2的37 ℃加湿培养箱中培养。分别在接种后的第1、2、3、4和5天时,每孔更换100 μL新鲜培养基,并加入10 μL MTS试剂,放置在含有5% CO2的37 ℃加湿培养箱中继续培养1 h。采用酶标仪测量各孔细胞490 nm处的吸光度值(A值)。取每组的6个重复孔的A值的平均值,误差线表示标准偏差。
1.3.6克隆形成实验 胰酶消化收集si-NC组和si-NETO2-1、si-NETO2-2组A549细胞,并计数后铺至6孔板中,每组3个重复孔,每孔500个细胞、2mL DMEM-F12完全培养基,放置在含有5% CO2的37℃加湿培养箱中培养。每隔一天更换一次新鲜培养基。待形成细胞克隆团,并且肉眼可以观察到时弃掉培养基。将细胞用PBS洗涤两次,无水乙醇室温固定30 min,0.5%结晶紫室温染色10 min。计数细胞克隆团数目,取每组细胞的3个重复孔的平均值,误差线表示标准偏差。
1.3.7Transwell实验 胰酶消化收集si-NC组和si-NETO2-1、si-NETO2-2组A549细胞,DMEM-F12无血清培养基洗涤细胞3次后,铺至Transwell小室的上室膜中,每组3个重复孔,每孔1.0×105个细胞、100 μL DMEM-F12无血清培养基,500 μL DMEM-F12完全培养基加入Transwell小室的下室中,放置在含有5% CO2的37 ℃加湿培养箱中培养。培养12 h后,棉签擦掉Transwell上室膜上面残留的细胞,膜的下室面穿过的细胞采用PBS洗3次后,无水乙醇室温固定30 min,0.5%结晶紫室温染色10 min。PBS洗3次后,取下膜后显微镜下计数穿膜细胞数目,取每组的3个重复孔的平均值,误差线表示标准偏差。

2 结 果
2.1NETO2在肺腺癌组织中的表达 免疫组化结果显示NETO2在肺腺癌组织中的阳性表达率为45.93%(62/135),在癌旁组织中的阳性表达率为33.33%(45/135),NETO2在肺腺癌组织中的表达高于在癌旁组织中的表达(χ2=4.474,P=0.034),图1为NETO2在肺腺癌组织中阳性和阴性表达的代表性图片。
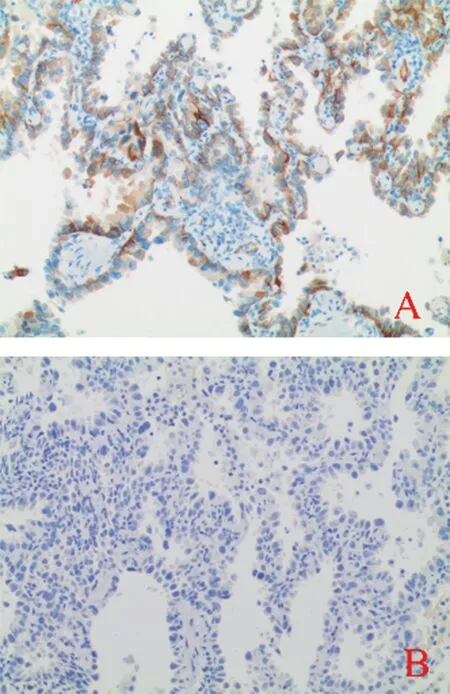
注:A为NETO2在肺腺癌组织中的阳性表达;B为NETO2在癌旁组织中的阴性表达(×200)。
2.2NETO2表达与肺腺癌患者临床病理参数之间的关系χ2检验分析显示NETO2在不同年龄和性别患者中的表达无统计学差异(P>0.05),NETO2在肿瘤T分期较高、有淋巴结转移和TNM分期较高的肺腺癌患者肿瘤组织中的表达分别高于在肿瘤T分期较低、无淋巴结转移和TNM分期较低肿瘤组织中的表达,差异有统计学意义(P<0.05),见表1。

表1 NETO2在肺腺癌组织中的表达水平与临床病理参数之间的关系[n(%)]
2.3NETO2表达与肺腺癌患者预后的关系 Log-rank检验分析显示与低表达NETO2的肺腺癌患者相比,高表达NETO2的肺腺癌患者预后较差(χ2=4.507,P=0.034),见图2。

图2 Log-rank检验分析NETO2表达对肺腺癌患者预后的影响
2.4NETO2 siRNA对肺腺癌细胞中NETO2表达的影响 NETO2 siRNA转染肺腺癌细胞系A549,Western blot检测结果显示NETO2在si-NC组和si-NETO2-1、si-NETO2-2组细胞中的表达分别为1.02±0.06和0.14±0.02、0.17±0.03。与si-NC组相比,si-NETO2-1、si-NETO2-2组细胞中NETO2蛋白的表达显著降低(F=449.30,P<0.001),见图3。

注:*P<0.05。
2.5NETO2 siRNA对肺腺癌细胞增殖活性的影响 MTS实验检测结果显示与si-NC组相比,si-NETO2-1、si-NETO2-2组细胞增殖活性显著降低(P<0.05),见图4、表2。
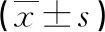
表2 si-NC组和si-NETO2-1、si-NETO2-2组肺腺癌细胞A490值
注:与si-NC组比较,*P<0.05。
2.6NETO2 siRNA对肺腺癌细胞克隆形成能力的影响 平板克隆形成实验检测结果显示si-NC组和si-NETO2-1、si-NETO2-2组细胞的克隆形成数目分别为(125.33±9.54)个和(56.33±3.61)个、(69.67±3.51)个。与si-NC组相比,si-NETO2-1、si-NETO2-2组细胞克隆形成能力显著降低(F=103.30,P<0.001),见图5。
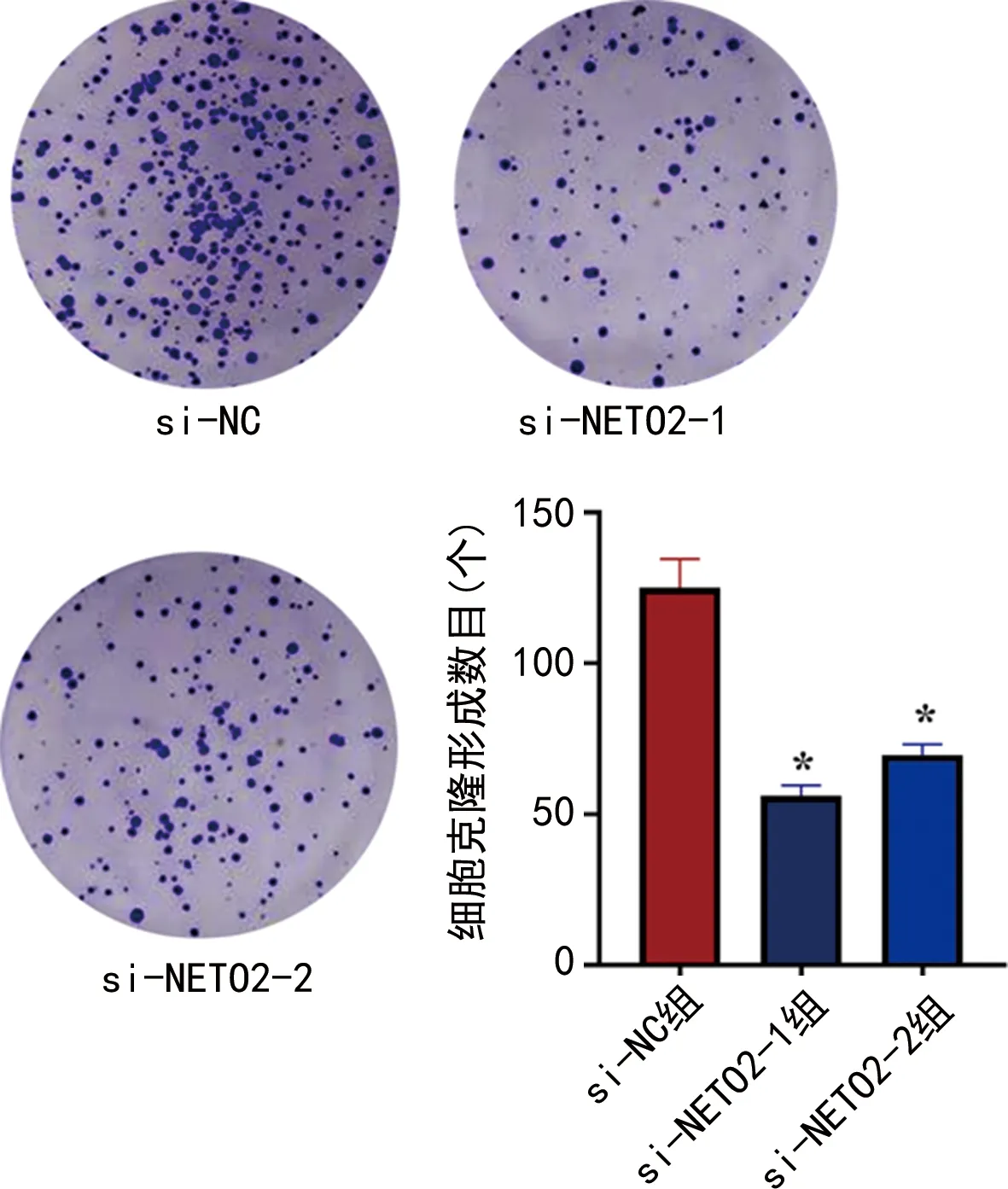
注:与si-NC组比较,*P<0.05。
2.7NETO2 siRNA对肺腺癌细胞转移能力的影响 Transwell实验检测结果显示si-NC组和si-NETO2-1、si-NETO2-2组细胞穿膜数目分别为(76.33±3.61)个和(26.33±2.07)个、(27.67±3.79)个。与si-NC组相比,si-NETO2-1、si-NETO2-2组细胞转移能力显著降低(F=231.60,P<0.001),见图6。
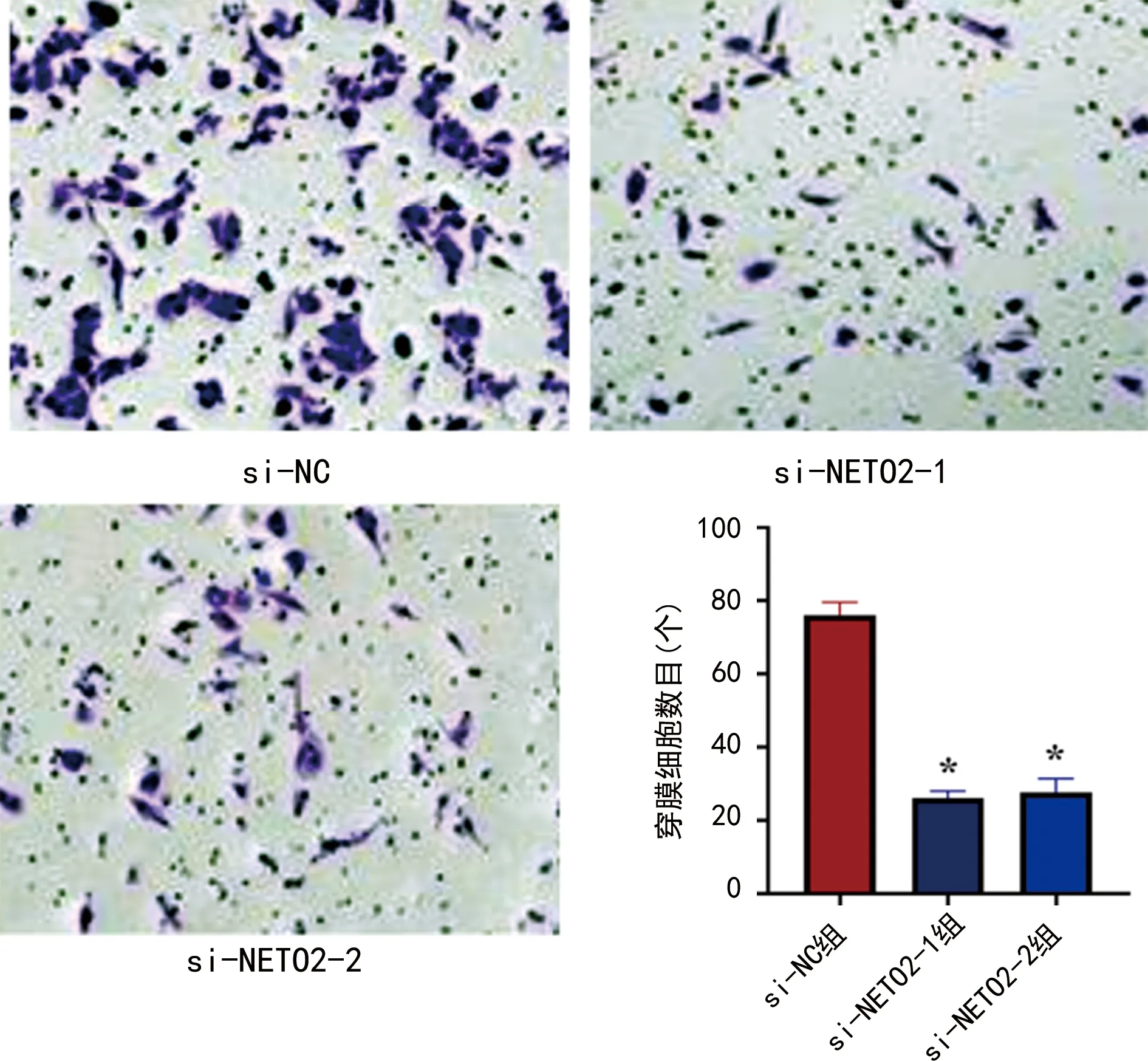
注:与si-NC组比较,*P<0.05。
2.8NETO2对肺腺癌细胞中JAK2/STAT3信号通路的影响 Western blot检测结果显示与si-NC组相比,si-NETO2-1、si-NETO2-2组细胞JAK2/STAT3信号通路关键蛋白pJAK2和pSTAT3表达降低(P<0.05),JAK2和STAT3蛋白表达无明显变化(P>0.05),见图7。
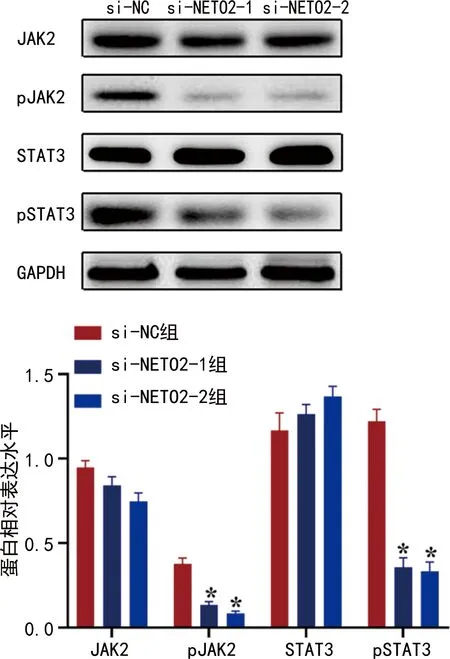
注:*P<0.05。
3 讨 论
2020年癌症统计数据表明肺癌是全球癌症相关死亡的最常见原因,严重威胁患者生命健康[1]。目前肺腺癌的治疗包括手术、放疗、化疗和分子靶向治疗,随着医疗技术的发展,尤其是分子靶向药物的应用,肺腺癌患者的预后有所改善,但是患者生存率仍然不理想[2]。因此,需要发现并探索肺腺癌发生发展的特定分子机制,以发现新型的生物标志物,并可用于干预、预防和治疗至关重要的新分子靶标。NETO2是幼体结构域和含LDLA蛋白的亚家族的成员,被鉴定为神经元海藻受体(KARS)的辅助蛋白,并在调节KARS功能中发挥关键作用,及NETO2与K+-Cl-共转运蛋白(KCC2)以低聚形式结合,以增强其在海马神经元中的回收利用[10]。近年来研究显示NETO2不仅在神经系统中发挥功能,其在多种肿瘤组织中表达异常,并参与肿瘤的恶性进展,可作为抗肿瘤活性的药物分子靶点[5-9]。
NETO2在食管癌、胰腺癌和肾透明细胞癌等肿瘤中报道为促癌基因,促进肿瘤的恶性进展[5-6,11],但是FEDOROVA等[12]报道NETO2在乳腺癌和前列腺癌中表达下降,并下调Wnt、TGF-β、JAK/STAT、MAPK和PI3K/AKT等一些细胞信号途径。提示NETO2具有促癌和抑癌双重作用,在不同的肿瘤中可能发挥不同的作用。在肺腺癌中NETO2作为miR-193a-5p的靶基因,参与SNHG17促进肺腺癌细胞增殖、侵袭、转移和EMT过程[9]。那么NETO2在肺腺癌中是否具有重要的生物功能,并发挥关键作用。在本研究首先采用免疫组化检测,发现与癌旁组织相比,肺腺癌组织中NETO2的蛋白表达水平上调,并且统计分析显示NETO2与肺腺癌患者T分期、淋巴结转移和TNM分期均相关。且高表达NETO2的肺腺癌患者预后较差,表明 NETO2促进肺腺癌的发生发展,是肺腺癌患者预后不良的分子标志物。与NETO2在食管癌[5]中表达升高,并与患者临床病理分期、淋巴结转移相关及在胰腺癌[6]中NETO2表达增加,并与患者肿瘤分期、预后较差的临床意义一致。恶性增殖和转移是肿瘤进展的重要表型,且在ZHANG等[9]的研究中提示NETO2 与肺腺癌的增殖和转移相关,本研究干扰NETO2的表达后功能实验显示肺腺癌细胞的增殖和转移能力降低。表明NETO2在肺腺癌中高表达,并促进肿瘤细胞的增殖和转移恶性生物学行为。
NETO2促进肺腺癌恶性进展的作用机制仍需进一步探讨。研究显示NETO2通过调控肿瘤相关信号途径在各个肿瘤中发挥作用,在食管癌中NETO2通过上调PI3K/AKT和 ERK信号通路促进肿瘤细胞增殖和转移能力[5]。NETO2通过调控PI3K/AKT/NF-κB/Snail信号通路促进胃癌侵袭和转移能力[13]。但是研究报道NETO2在乳腺癌和前列腺癌中可以下调PI3K/ AKT信号通路,这表明在不同的肿瘤中NETO2发挥的作用机制可以完全相反[10]。JAK2/STAT3信号通路是调控肿瘤恶性生物学行为的重要途径之一,在肺腺癌中处于激活状态,促进肺腺癌的增殖和转移能力,并抑制细胞凋亡,抑制其活性,可以抑制肿瘤的恶性进展[14]。JAK2/STAT3信号通路激活的关键是JAK2及STAT3蛋白的磷酸化水平增加,并促进下游靶蛋白的激活,发挥相应的生物学功能[15]。本文发现干扰NETO2的表达后,肺腺癌细胞中pJAK2和pSTAT3蛋白的表达降低,表明NETO2通过上调JAK2/STAT3信号通路促进肺腺癌增殖和转移能力。与NETO2在胰腺癌中增加pSTAT3蛋白的表达促进肿瘤细胞增殖、侵袭和转移能力的研究具有一致性。但是本文的局限在于未对NETO2直接作用的分子机制进行深入研究,在后续的研究中后续仍需进一步探索。
综上所述,NETO2在肺腺癌组织中高表达,与肺腺癌患者不良病理参数和预后相关。并且NETO2 促进肺腺癌细胞增殖和转移能力,其作用机制可能是通过激活JAK2/STAT3信号通路。NETO2是抗肺腺癌治疗的潜在分子靶点。
