甲状腺乳头状癌合并桥本甲状腺炎的临床特点
2023-07-31孙康汪晓明王建国
孙康 汪晓明 王建国
1安徽中医药大学第一附属医院普外科(合肥 230031);2中国科学技术大学第一附属医院肿瘤科(合肥 230001)
甲状腺癌是内分泌系统最常见的恶性疾病,总生存率较高,预后良好,尤其是甲状腺乳头状癌(papillary thyroid carcinoma,PTC)。随着诊断工具的不断改进(例如细针抽吸、高分辨率超声、甲状腺特异性抗体检测以及基因检测等),近些年来甲状腺癌的发病率呈现急剧增加的趋势[1-2]。桥本氏甲状腺炎(Hashimotos' thyroiditis,HT),又称为慢性淋巴细胞性甲状腺炎或自身免疫性甲状腺炎,是最常见的自身免疫性甲状腺疾病,是世界上碘充足地区甲状腺功能减退的主要原因。有报道显示,大约三分之一的甲状腺乳头状癌患者同时患有桥本甲状腺炎,甲状腺乳头状癌合并桥本甲状腺炎的患者正在不断增加[3-4]。
自1893 年鲁道夫·维肖(Rudolf Virchow)首次提出慢性炎症与癌症发展之间的联系,越来越多的研究为证实他的假设在许多器官发病过程中提供了依据,例如:肠道慢性炎症疾病(克罗恩病和溃疡性直肠结肠炎)与结肠癌之间的关系,慢性病毒性肝炎与肝癌之间的关系,以及幽门螺杆菌感染引起的慢性胃炎与胃癌之间的关系[5-6]。直到1955 年,DAILEY 等[7]首次描述了HT 和PTC之间的关联。此后,学术界对于这一问题的研究报道越来越多,但目前仍没有统一的共识。那么,患有桥本甲状腺炎是否也会增加甲状腺癌的发病风险呢?本文回顾性分析347 例甲状腺乳头状癌手术患者的临床及病理学资料,探讨甲状腺乳头状癌合并桥本甲状腺炎的临床特点。
1 资料与方法
1.1 研究对象本研究回顾2016 年1 月至2022 年11 月期间于安徽中医药大学第一附属医院普外二科行甲状腺癌手术的所有患者。纳入标准:(1)首次行甲状腺癌根治术;(2)术后病理确诊为甲状腺乳头状癌;(3)既往无甲状腺及颈部淋巴结疾病史;(4)未合并其他恶性肿瘤病史;(5)具有完整临床及病理资料。排除标准:(1)甲状腺转移癌;(2)术后病理合并滤泡状癌、髓样癌等其他类型的甲状腺癌;(3)既往曾有甲状腺及颈部淋巴结疾病史;(4)既往曾有其他恶性肿瘤病史或目前合并其他恶性肿瘤病史;(5)临床及病理资料不完整。经筛选后共347 例病例纳入此次研究。根据术后病理检查结果是否合并桥本甲状腺炎,将患者分为甲状腺乳头状癌合并桥本甲状腺炎组(PTC+HT 组)和甲状腺乳头状癌未合并桥本甲状腺炎组(PTC 组)。本研究项目伦理审查经安徽中医药大学第一附属医院医学伦理委员会审查通过并备案登记。
1.2 术前检查所有患者血液样本均由安徽中医药大学第一附属医院检验中心统一检测。检测指标包括:血清促甲状腺激素(Thyroid-stimulating hormone,TSH)、血清游离三碘甲状腺原氨酸(Free triiodothyronine,FT3)、血清游离甲状腺素(Free thyroxine,FT4)、抗甲状腺球蛋白抗体(Thyroglobulin antibodies,TgAb)和抗甲状腺过氧化物酶抗体(Thyroid peroxidase antibody,TPOAb)。术前甲状腺彩超检查均由安徽中医药大学第一附属医院超声中心医生统一完成。
1.3 手术方式所有患者手术方式为单侧(或双侧)甲状腺腺叶及峡部切除+同侧中央区淋巴结清扫。若颈部淋巴结穿刺细胞学诊断或术中冰冻证实侧颈部淋巴结转移,需同期行功能性颈侧区淋巴结清扫术。手术均由较高资质的本科室外科医师完成。根据美国甲状腺协会(American Thyroid Association,ATA)指南,中央区淋巴结清扫范围上界至舌骨下缘、下界至无名静脉、外界至颈动脉鞘内侧、后方达椎前筋膜,包括气管旁、气管前、喉前及甲状腺周围淋巴结。
1.4 病理学诊断所有患者术后病理学检查结果由本院病理科医师统一出具报告。病理学报告详细描述肿瘤最大直径、甲状腺被膜侵犯情况、病灶数目、淋巴结位置和数目、淋巴结转移情况。肿瘤病理学分期采用2017 年第8 版美国癌症联合会(American Joint Committee on Cancer,AJCC)分化型甲状腺癌分期指南。所有患者病理报告均明确诊断甲状腺乳头状癌。若同时报告桥本甲状腺炎或弥漫性淋巴细胞浸润者,则归入甲状腺乳头状癌合并桥本甲状腺炎组(PTC+HT 组)。若仅确诊甲状腺乳头状癌,无桥本甲状腺炎或弥漫性淋巴细胞浸润等描述,则归入甲状腺乳头状癌未合并桥本甲状腺炎组(PTC 组)。
1.5 观察指标采用回顾性资料分析,比较两组之间临床病理特点存在的差异。临床病理特点主要包括年龄、性别、方位、肿瘤最大径、是否微小癌、是否钙化、纵横比、侵袭性、病灶数目、中央区淋巴结数目、中央区淋巴结转移数目、病理分期、术前甲状腺功能指标(包括FT3、FT4、TT3、TT4、TSH、TPOAb、TgAb)等。
1.6 统计学方法用SPSS 19.0 统计学软件对数据进行处理,计量资料以均数±标准差表示,如服从正态分布,采用t检验及方差分析比较分析;计数资料以百分比(%)表示,采用χ2检验及秩和检验比较分析;等级资料及非正态分布资料采用非参数检验比较分析。因变量为连续型变量的多因素分析采用多元线性回归分析。所有检验以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较本研究共纳入PTC患者347 例,其中男78 例,女269 例,男女比例约为1∶3.5。患者年龄跨度为15~78 岁,平均年龄(44.92 ± 12.198)岁,中位年龄为46 岁,<55 岁270例,≥55 岁77 例。见表1。
表1 两组患者一般资料比较Tab.1 Comparison of general data between the two groups ±s

表1 两组患者一般资料比较Tab.1 Comparison of general data between the two groups ±s
组别年龄(岁)性别[ 例(%)]PTC 组(n=249)45.35±12.762 PTC+HT 组(n=98)43.84±10.617 t/χ2值1.123 P 值0.156男女64(25.7%)185(74.3%)14(14.3%)84(85.7%)5.260 0.022
按照是否合并桥本甲状腺炎分成两组,PTC组共249 例患者,其中男64 例(25.7%),女185 例(74.3%),平均年龄(45.35±12.762)岁;PTC+ HT 组共98 例患者,其中男14 例(14.3%),女84 例(85.7%),平均年龄(43.84 ± 10.617)岁。PTC 组患者平均年龄较PTC+HT 组偏高,差异无统计学意义(P>0.05);PTC+HT 组比PTC 组女性患者比例更高,差异有统计学意义(P<0.05),表1。
2.2 两组患者临床病理资料比较就病理检查结果分析,两组数据在方位、肿瘤最大直径、是否微小癌、是否钙化、病灶数目、中央区淋巴结阳性数目及病理分期八个方面差异无统计学意义(P>0.05)。而PTC+HT 组纵横比>1 比例为(57.1%),较PTC 组(41.8%)更高,二者差异有统计学意义(P<0.05)。PTC+HT 组清扫中央区淋巴结总数(7.31 ± 6.132)高于PTC 组(3.98 ± 3.592),但PTC+HT 组侵袭性比例及中央区淋巴结阳性率均低于PTC 组,差异均具有统计学意义(P=0.002 6,P=0.011)。见表2。

表2 两组患者临床病理资料比较Tab.2 Comparison of clinicopathologic data between the two groups 例(%)
2.3 两组患者术前甲状腺功能指标比较就实验室检查结果分析,PTC+HT 组术前FT3、FT4 均值较PTC 组稍低,差异均有统计学意义(P<0.05)。PTC+HT 组术前TSH、TPOAb、TgAb 均值较PTC 组均升高,后两者更显著,差异均有统计学意义(P<0.05)。而两组术前TT3、TT4 均值差异无统计学意义(P>0.05)。见表3。
表3 两组患者术前甲状腺功能指标比较Tab.3 Comparison of preoperative thyroid function indexes ±s
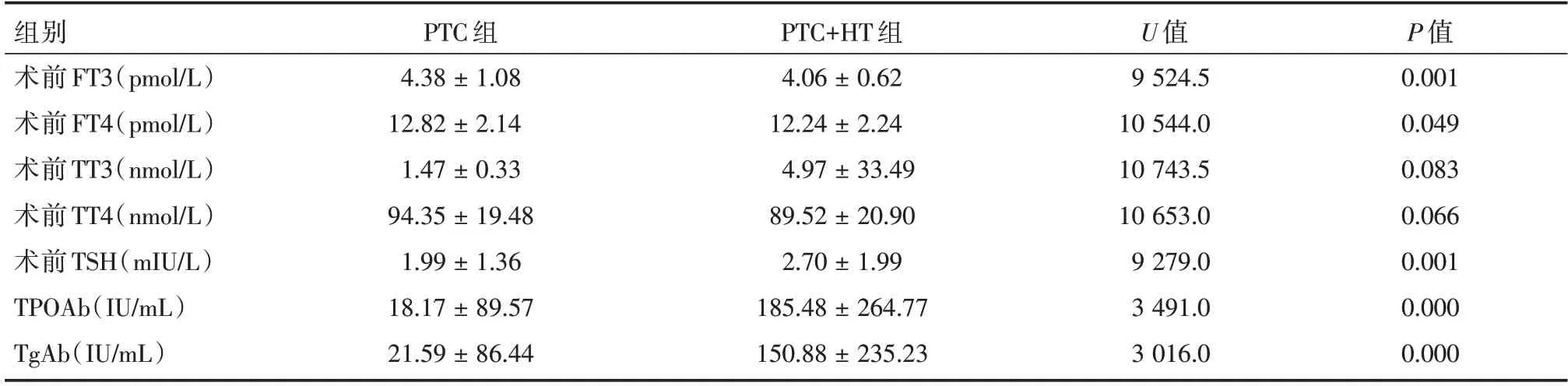
表3 两组患者术前甲状腺功能指标比较Tab.3 Comparison of preoperative thyroid function indexes ±s
组别术前FT3(pmol/L)术前FT4(pmol/L)术前TT3(nmol/L)术前TT4(nmol/L)术前TSH(mIU/L)TPOAb(IU/mL)TgAb(IU/mL)PTC 组4.38±1.08 12.82±2.14 1.47±0.33 94.35±19.48 1.99±1.36 18.17±89.57 21.59±86.44 PTC+HT 组4.06±0.62 12.24±2.24 4.97±33.49 89.52±20.90 2.70±1.99 185.48±264.77 150.88±235.23 U 值9 524.5 10 544.0 10 743.5 10 653.0 9 279.0 3 491.0 3 016.0 P 值0.001 0.049 0.083 0.066 0.001 0.000 0.000
2.4 多元线性回归分析影响PTC 中央区淋巴结阳性率的因素采用多元线性回归分析影响PTC中央区淋巴结阳性率的因素,其中,是否微小癌、年龄、性别及是否合并桥本甲状腺炎均会对PTC中央区淋巴结阳性率有显著影响(β=0.289,P<0.05;β=-0.199,P<0.05;β=-0.149,P=0.003;β=-0.113,P=0.025),其中以是否微小癌对PTC中央区淋巴结阳性率影响最为显著。而方位、肿瘤最大直径、钙化、纵横比>1、侵袭性、病灶数目、术前FT3、术前FT4、术前TT3、术前TT4、术前TSH、TPOAb 以及TgAb 对PTC 中央区淋巴结阳性率差异均无统计学意义(P>0.05)。见表4。
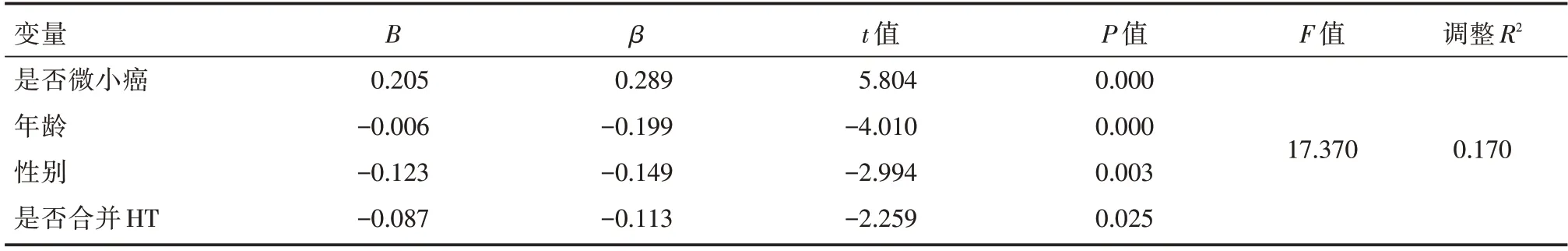
表4 多元线性回归分析影响PTC 中央区淋巴结转移的因素Tab.4 Multiple linear regression analysis of the factors affecting central lymph node metastasis of PTC
3 讨论
甲状腺癌是世界范围内发病率不断升高的最常见内分泌系统恶性肿瘤。截至2018 年,甲状腺癌在全球所有癌症中排名第九[8]。它有四种常见病理类型,其中以乳头状癌最为常见,约占80%,总体生存率良好。然而,LIM 等[9]发现甲状腺乳头状癌的发病率死亡率近些年逐步增加。导致这样结果的具体原因尚不清楚,目前学术界正在积极探讨潜在的风险因素,希望有助于降低甲状腺乳头状癌的发病率,进而降低死亡率。HT 作为一种复杂的自身免疫性甲状腺疾病,其特征是弥漫性淋巴细胞浸润(尤其是T 细胞)和滤泡破坏导致甲状腺组织的逐渐萎缩和纤维化,出现进行性损伤,临床上主要表现为明显的甲状腺功能减退[10]。有研究[11]认为其发病机制可能是遗传易感性和环境因素的结合,导致免疫耐受性丧失,从而导致甲状腺组织的自身免疫攻击,最终疾病出现。PTC 和HT 之间的关系一直是广泛研究的焦点,旨在找出这两种疾病之间的联系,并且研究二者共存时,HT是否影响PTC 形成特殊的临床病理特征和预后。自1955年以来,DAILEY等[12]首次描述了HT 和PTC之间的关联后,越来越多的研究证实,HT 会增加PTC的发病风险。正如GRACEFFA 等[13]研究发现,病理确诊PTC 的患者中有28.6%合并HT,而病理诊断为多结节性甲状腺肿的患者中则仅有7.7%合并HT 相关(P<0.001)。
本文通过回顾性分析研究得到以下结果:首先,本研究发现PTC+HT 组比PTC 组女性患者比例更高,差异具有统计学意义(P<0.05)。表明女性PTC 患者更易伴发HT。LIU 等[14]通过回顾病例资料同样得出相似结果。AHN 等[15]研究也认为,与未患有HT 的患者相比,合并HT 的PTC患者发病年龄更小,女性优势更大(P=0.008,P=0.009)。
其次,本研究发现PTC+HT 组清扫中央区淋巴结总数(7.31±6.132)高于PTC组(3.98±3.592),但PTC+HT 组侵袭性比例及中央区淋巴结阳性率均低于PTC 组,差异均有统计学意义(P=0.002 6,P=0.011)。同时,采用多元线性回归分析显示是否微小癌、年龄、性别及是否合并HT 均会对PTC中央区淋巴结阳性率有显著影响(β=0.259,P<0.05;β=-0.199,P<0.05;β=-0.149,P=0.003;β=-0.113,P=0.025)。该结果说明合并HT 会降低PTC 的侵袭性及中央区淋巴结转移风险,并且微小癌、年龄、性别也都是PTC 中央区淋巴结转移的风险因素。因此,笔者认为HT 对PTC 患者的影响是一把“双刃剑”,它既会增加PTC 的发病风险,但同时又能防止PTC 疾病进一步恶化。正如一项纳入65篇文章的Meta分析显示合并HT的PTC患者淋巴结转移风险较低(OR=0.787,95%CI:0.686~0.903,P=0.001)[16]。另一项来自我国某大型医疗中心的回顾性队列研究也证实,共存HT 的PTC 患者具有较少的侵袭性特征,预后更好[17]。WANG等[18]通过444 例PTC 患者研究得出HT 的自身免疫反应似乎可以减少PTC 患者的中央区淋巴结转移。并且年龄<55岁和肿瘤大小≥10 mm是中央区淋巴结转移的独立危险因素。BATTISTELLA 等[19]在此基础上还得出结果,PTC-HT 组的肿瘤体积较小,侵袭性较低,淋巴结受累也较少,并且肿瘤早期诊断率较高。然而,也有一些研究却得出有争议性的结论。如ZENG等[20]研究认为在甲状腺乳头状癌患者中,合并HT 患者中央区淋巴结转移检出率较非HT 患者偏高(39.2%vs.31.4%,P=0.043)。单立群等[21]通过回顾性研究分析认为HT 合并PTC易出现中央区淋巴结转移,肿瘤最大径>5 mm、包膜侵犯是中央区淋巴结转移的危险因素。
第三,本研究还发现PTC+HT 组术前TSH、TPOAb、TgAb均值较PTC组均升高,后两者更显著,差异均有统计学意义(P<0.05)。该结果说明合并HT 会升高PTC 患者血液中TSH、TPOAb、TgAb。现阶段,甲状腺癌的发生与血中TSH 升高有关已是不争的事实,TSH 作为生长因子在正常情况下可调节甲状腺细胞的增生与功能。当TSH 高于正常值上限时,其与结节性甲状腺肿的恶变率呈正相关。很多研究都证实了这一观点。然而,当PTC患者合并HT 时,HT 能够触发机体自身免疫反应机制,免疫细胞产生靶向甲状腺抗原的自身抗体,主要作用于甲状腺过氧化物酶(TPO)和甲状腺球蛋白(Tg),导致甲状腺细胞萎缩和破坏,甲状腺功能减退。此时,甲状腺激素分泌减少,机体通过内分泌系统的反馈调节机制促进垂体加速分泌TSH,进而血清TSH 浓度升高[22-23]。因此,合并HT 能够促进PTC 患者机体增加TSH、TPOAb、TgAb 分泌,从而导致血清中各自成分升高。邢宝迪等[24]通过研究得出与我们相似的研究结果,与单纯PTC 组患者相比,合并HT 组TSH、TPOAb、TgAb 水平升高,FT4、FT3 水平降低(均P<0.05)。LUN 等[25]研究也观察到,合并HT的PTC患者TSH浓度显著高于未患有HT的患者[(2.54±2.06)vs.(1.90±1.66)mIU/L,P=0.001]。此外,我们的研究还发现PTC+HT 组纵横比>1 比例为(57.1%),较PTC 组(41.8%)更高,二者差异有统计学意义(P<0.05)。说明合并HT 组患者更容易出现结节纵向生长,增加PTC 的发病风险。
综上所述,笔者分析认为女性PTC 患者更易伴发HT,合并HT 会升高PTC 患者血液中TSH、TPOAb、TgAb,更易出现结节纵向生长,增加PTC的发病风险,但同时也能降低PTC 的侵袭性及中央区淋巴结转移风险;因此,我们认为HT 对PTC患者的影响是一把“双刃剑”。微小癌、年龄、性别以及HT 均为PTC 中央区淋巴结转移的独立危险因素。那么根据结论,我们建议临床上确诊HT 患者要积极随访控制TSH、TPOAb、TgAb 水平,避免转化为PTC;同时,当HT 合并PTC 时若中央区未出现淋巴结转移时,手术中可不必做预防性清扫。希望该文章研究结论能够给广大临床工作者提供一个启发和参考。
未来,将继续努力,希望能够开展大样本、多中心的研究以及分子基因水平方面的研究,借助前人的经验及成果,深入探讨HT 如何影响PTC 患者的病理转化机制。正如刘美莲等[26]通过免疫组织化学染色实验证实血管内皮生长因子和促血管生成素2 对于辅助PTC 的诊断有一定的临床意义,但对于预测PTC 是否伴有颈部淋巴结转移可能无诊断价值。同时,LI 等[27]研究进一步发现IL-17 和血管内皮生长因子水平在HT 恶性转化过程中呈逐渐升高的趋势,两种细胞因子之间存在显著的正相关,二者可有助于区分HT 是否伴发PTC。因此,血管内皮生长因子升高或许就是触发HT 转化为PTC 机制的一个靶点,以上研究提供了进一步深入探讨的方向。
