地夫可特改善杜氏肌营养不良症小鼠运动能力及减轻肌肉炎症损伤
2023-07-31杨晓张欢张朝晖杨细飞
杨晓 张欢 张朝晖 杨细飞
1南华大学衡阳医学院公共卫生学院(湖南衡阳 421001);2深圳市疾病预防控制中心深圳市现代毒理学重点实验室,深圳市卫生毒理学医学重点学科(广东深圳 518055)
杜氏肌营养不良症是一种常见的肌营养不良症,影响全球多达1/3 500~1/5 000的男性[1]。其特征表现为肌肉无力,运动能力下降,骨骼肌退行性变化。杜氏肌营养不良症多由于肌营养不良蛋白缺失导致细胞骨架稳定性破坏所致,患者多在2~3 岁发病,7 岁左右症状显著,10 岁左右需要依靠轮椅活动,最终多在20~30 岁阶段死于心力衰竭或者膈肌呼吸无力[2-4]。杜氏肌营养不良症骨骼肌病理损伤导致肌肉出现明显的炎症纤维化病变,尽管肌营养不良蛋白缺失是该病的主要原因,但是肌营养不良蛋白缺失导致细胞膜损伤、慢性炎症坏死和骨骼肌退行性变化会加重疾病进展[5-6]。
目前关于杜氏肌营养不良症的治疗方法包括两大类,即恢复肌营养不良蛋白表达和补偿肌营养不良蛋白缺乏的疗法,前者包括外显子跳跃疗法、载体介导的基因疗法、载体介导的细胞疗法等,后者包括抗炎、抗氧化、抗纤维化治疗[7-9]。糖皮质激素治疗一直是杜氏肌营养不良症患者的标准治疗方法,泼尼松和地夫可特是最值得推荐的类固醇治疗方案[10]。地夫可特于2017 年获得FDA 批准,被广泛用于杜氏肌营养不良症患者的临床治疗[11]。
然而目前关于地夫可特对杜氏肌营养不良症患者运动能力和骨骼肌病理改变的治疗研究甚少。此研究旨在了解杜氏肌营养不良症小鼠运动能力变化和肌肉病理改变,探索地夫可特治疗期间对杜氏肌营养不良症小鼠运动能力及骨骼肌病理损伤的干预情况,进一步为肌肉退行性疾病的科学防治提供参考价值。
1 材料与方法
1.1 实验动物模型选取肌营养不良蛋白缺乏的C57BL/10ScSnJGpt-Dmdem3Cd4/Gpt(mdx,DMD)动物模型小鼠和品系对照小鼠C57BL/10JGpt(WT)。小鼠购自江苏省集萃药康生物科技有限公司,并饲养在温度稳定在(20 ± 2)℃和湿度(55 ± 5)%的12 h 明暗循环的饲养室中。
依据体质量随机将10 周龄雄性小鼠分为正常对照组(正常组)、模型组、地夫可特治疗组[地夫可特组,1 mg/(kg·d)],每组7只实验小鼠,实验8周后实施安乐死。实验期间,每周称量1 次体质量,每4 周进行1 次行为学测试评估小鼠运动能力。
深圳市疾病预防控制中心动物福利伦理委员会批准了此项研究方案(No.2022011)。动物实验操作和程序均遵循深圳市疾病预防控制中心动物管理条例执行。我们尽一切努力,尽量减少动物的痛苦及减少小鼠的数量。
1.2 药物地夫可特:即Deflazacort(MCE,美国),糖皮质激素的一种。
1.3 实验方法
1.3.1 悬挂测试采用悬挂网格测试评估小鼠四肢的握力,通过记录小鼠倒置悬挂支撑的时间进行评估小鼠的肌肉力量。首先将小鼠放置在21 cm × 21 cm 的金属丝网格(线宽约0.1 cm,相距0.5 cm)的中心,等待小鼠抓住网格时轻轻翻转网格并记录小鼠悬挂在网格上的时间,可以翻转网格后将其放置在桌子上方35 cm 处。每4 周测试1 次,并以90 s 作为测试结果的临界值。每个实验重复3 次,计算每只小鼠的平均悬挂时间作为评估值。
1.3.2 爬杆测试爬杆试验用于评估小鼠四肢的运动和协调性。自制长约50 cm 直径约1 cm 的木杆,用纱布包裹增加摩擦力。将木杆垂直放在水平桌子上,将小鼠轻轻放在杆子顶部,头部朝下。小鼠在没有外力驱动的情况下沿着攀爬杆自主向下爬行,记录从杆顶爬到底部所需的时间,即为爬杆时间。正式测试前每天训练3次,持续3 d[12]。实验正式开始后,每4 周测试1 次,测试结果以15 s 为临界值,超过15 s 的记录为15 s。每个实验重复3 次,计算每只小鼠的3次爬杆平均时间作为评估值。
1.3.3 抓力测试通过测量小鼠前肢最大的抓力大小来评估小鼠四肢的肌肉力量。将小鼠放在测试板中央,轻轻拉动鼠尾巴以鼓励小鼠前肢抓住握板,当它强行抓住抓握板时,及时以恒定速度施加力,拉动小鼠尾巴以使小鼠松开爪子。此时握力值即为小鼠的最大握力值。小鼠经过训练后,每月测试1 次,每次重复3 次,取3 个结果中的最大值作为评估值。
1.3.4 步态测试在骨骼肌损伤的小鼠中,小鼠步行平衡能力和和速度会受到影响,步态会出现异常改变。我们采用小鼠行走跟踪分析系统,获得小鼠的自然步态,并对步态进行鉴定和分析。该系统使用具有高速千兆以太网端口(150 帧/s)的德国相机和索尼CCD 的感光原理来实时跟踪小鼠。它可以智能识别小鼠的身体、头部、尾巴、四肢等部位的大小,并自动对轨迹进行分类,实现面积、步数、行走周期、运动速度、摆动持续时间等的精确测量。
在使用该仪器之前,调整步行平台到适当的宽度,使宽度与小鼠的大小相匹配,并设置标尺和安装相机,正确调整增益值和白平衡值,以获得最佳录制和拍摄效果。整个测试都应该在安静、黑暗的环境中进行的。在正式测试之前,训练小鼠行走,并允许沿着50 cm 长的玻璃路径反复行走以熟悉环境。在正式测试期间,老鼠被放置在过道的入口处,老鼠会沿着玻璃通道行走。高速千兆以太网端口摄像头收集步行数据,步行分析器系统软件用于筛查。如果小鼠由于恐惧或嗅闻而在行走时暂停或转身,则必须重复测量。如果自动迹线分析不正确,可以手动分析校准迹线。
1.3.5 生化指标检测小鼠实施安乐死后,立即眼球取血收集新鲜血液。将血液样品在4 ℃下以1 500×g离心10 min,冻存放在-80 ℃冰箱。在上机测试前,从冰箱取出血样放在冰上等待其解冻。随后使用HITACHI7080 自动临床分析仪(日本东京)测量血清肌酸激酶、血浆乳酸脱氢酶和血糖水平。
1.3.6 苏木素伊红染色(1)烘箱55 ℃烘片;(2)二甲苯脱蜡30 min;(3)随后乙醇梯度脱蜡,5 min/次,后经自来水洗。(4)苏木精染色5~10 min;(5)盐酸乙醇分化数秒;(6)自来水洗,返蓝;(7)伊红染色3 min 左右;(8)自来水洗后乙醇梯度脱水,5 min/次;(9)二甲苯透明30 min;(10)中性树脂封片。苏木精-伊红染色试剂购自北京索莱宝科技有限公司。在光学显微镜下观察所有染色切片,并使用Image J 软件进行统计分析。
1.3.7 天狼猩红染色(1)烘箱55 ℃烘片,二甲苯脱蜡30 min;(2)乙醇梯度脱蜡,5 min/次;(3)天狼猩红染色8~10 min 后流水冲洗;(4)苏木素染色1 min 流水冲洗;(5)乙醇梯度脱水,5 min/次;(6)二甲苯中透明30 min;(7)中性树脂封片。天狼猩红染色试剂盒购买于飞净科研试剂有限公司,在光学显微镜下观察所有染色切片,并使用Image J 软件进行统计分析。
1.4 统计学方法使用GraphPad Prism 8.0.2 软件,所有数据均表示均数±标准差,分析方法采用单因素方差分析或者双因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠每周体质量称量结果小鼠称重结果发现杜氏肌营养不良症小鼠体质量明显高于正常小鼠(P<0.01),地夫可特组与模型组体质量相比,小鼠在13 周龄和15 周龄出现差异(P<0.05),其他时间段称重与模型组小鼠体质量相比差异无统计学意义。
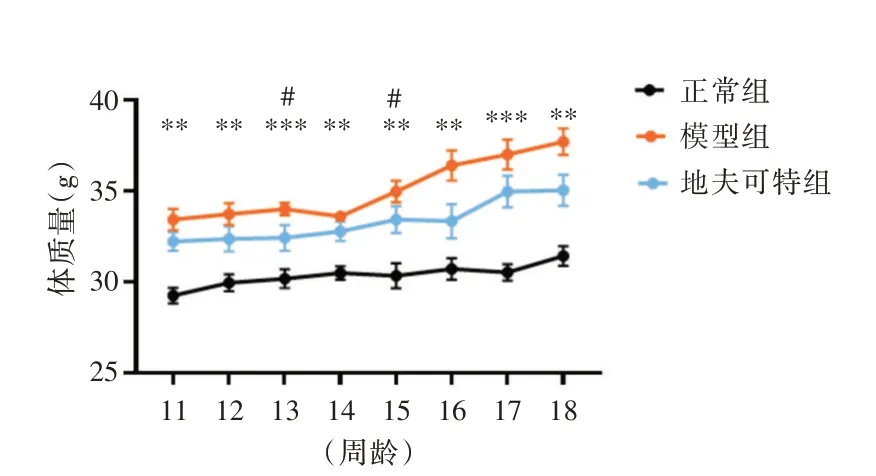
图1 小鼠体质量结果(n=7)Fig.1 Mouse weight Results
2.2 地夫可特提高小鼠运动能力在小鼠10 周龄、14 周龄、18 周龄时各进行一次行为学测试,评估小鼠运动能力变化。悬挂测试评估小鼠肌肉力量和耐力(图2A),发现与正常组小鼠相比,模型组小鼠悬挂支撑时间缩短(P<0.01)。地夫可特组小鼠与模型组小鼠相比,悬挂支撑时间在14 周龄时出现延长趋势,在18 周龄时出现统计学差异(P<0.05)。爬杆耗时分析如图2B 所示,10 周龄时正常组小鼠与模型组小鼠间存在差异(P<0.05),随着疾病进展,两组小鼠爬杆耗时差异逐渐明显(14 周龄时P<0.01,18 周龄时P<0.001)。与模型组相比,地夫可特组小鼠爬杆耗时在18 周龄时出现显著差异。采取前肢抓力测试评估小鼠肌肉力量如图2C,可见10 周龄时正常组和模型组小鼠抓力测试即出现明显差异(P<0.0001),14 周龄和18 周龄测试发现其差异降低(P<0.01)。相较于模型组小鼠,地夫可特组小鼠抓力值在14 周龄和18 周龄时均出现差异(P<0.05)。
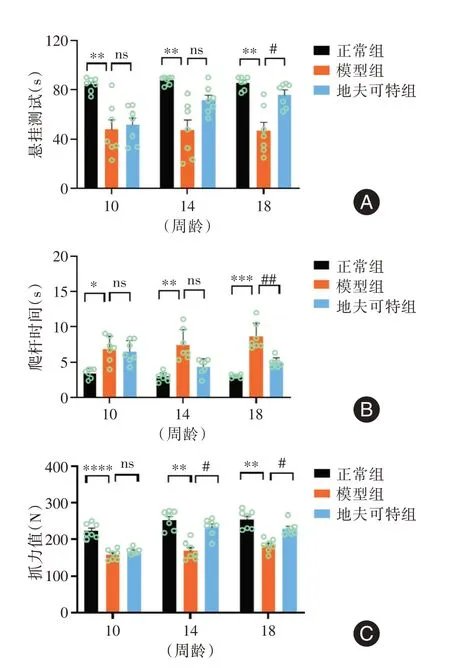
图2 地夫可特提高小鼠运动能力(n=7)Fig.2 Deflazacort improved locomotor activity in mice
2.3 地夫可特减轻小鼠步态损伤小鼠18 周龄时,采取小鼠步态分析仪测试小鼠的四肢步态变化,分析小鼠四肢步幅距离和步行速度两项指标。发现模型组小鼠前肢(P<0.001)和后肢(P<0.01)步幅距离缩短,地夫可特增加了小鼠前肢步幅距离(P<0.01),然而对改善后肢步幅距离无统计学差异(图3A、B)。此外,发现模型组小鼠步行速度远低于正常组小鼠(P<0.0001),地夫可特组小鼠前肢(P<0.01)和后肢(P<0.05)步行速度提高(图3C、D)。
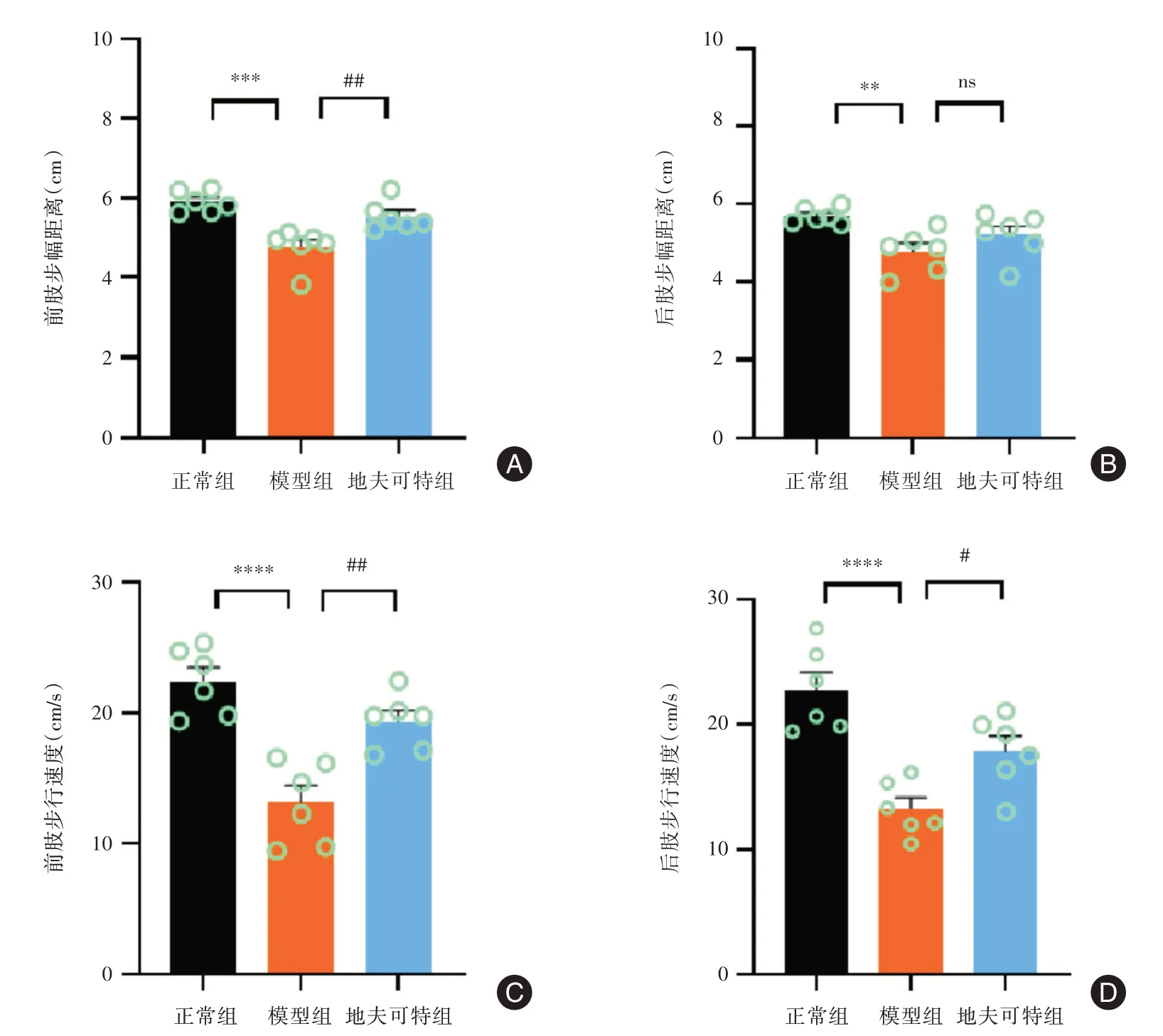
图3 地夫可特减轻小鼠步态损伤(n=6)Fig.3 Deflazacort reduced gait impairment in mice
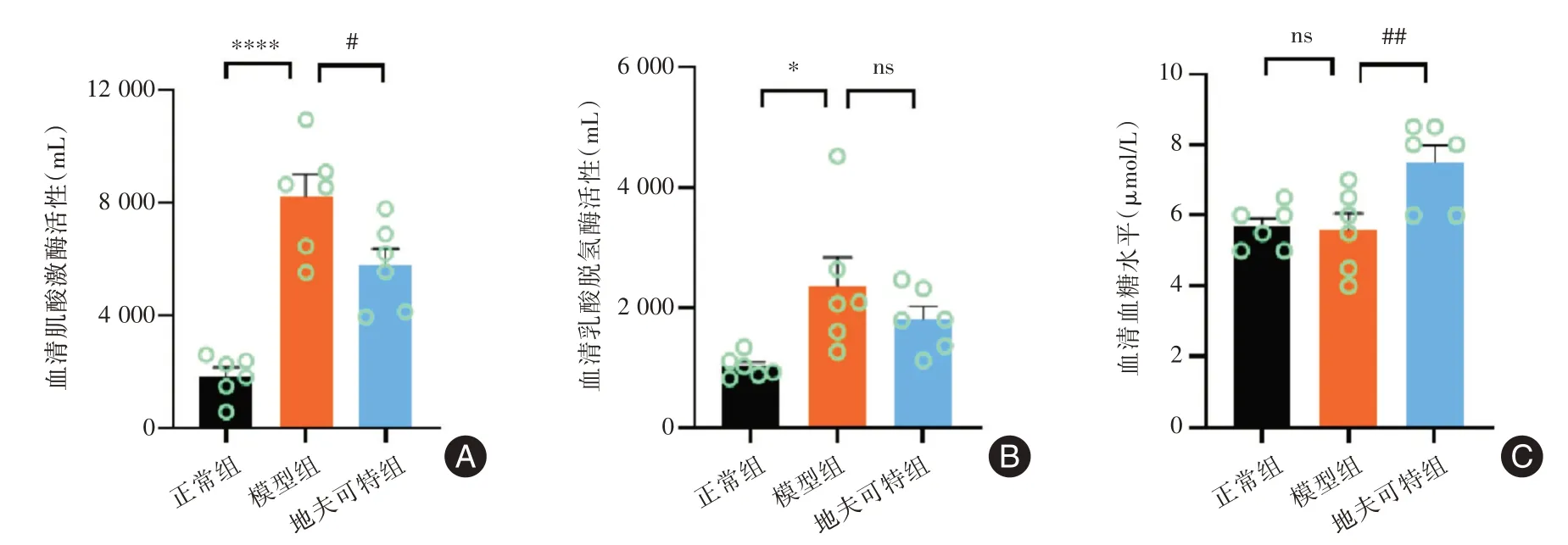
图4 小鼠血清生化指标检测(n=6)Fig.4 Serum biochemical markers for mice
2.4 地夫可特治疗对小鼠生化指标的影响杜氏肌营养不良症的标志是骨骼肌损伤,肌酸激酶和乳酸脱氢酶作为衡量骨骼肌损伤的重要指标[13],在杜氏肌营养不良症中会发生明显变化。发现模型组小鼠血清中肌酸激酶和乳酸脱氢酶水平异常高于正常小鼠,尤其是肌酸激酶水平显著升高(P<0.000 1)。与模型组比较,地夫可特干预的小鼠血清肌酸激酶水平受到抑制(P<0.05),以及乳酸脱氢酶水平具有降低趋势。由于地夫可特作为糖皮质激素的一种,可能会对血糖产生影响。我们检测了小鼠血清中血糖含量,可见模型组小鼠与正常组小鼠相比差异有统计学意义,而地夫可特组小鼠血糖水平升高(P<0.01),提示我们地夫可特治疗会对患者的血糖产生一定影响。
2.5 地夫可特减轻小鼠骨骼肌病理损伤小鼠腓肠肌和膈肌石蜡包埋后,进行病理组织学检查,观察肌肉病变状况。苏木素伊红染色结果显示如图5A,发现与正常组小鼠相比,模型组小鼠腓肠肌出现大量的炎性细胞浸润(P<0.001),同时伴随肌肉萎缩表现。与模型组小鼠相比,地夫可特组腓肠肌炎性细胞浸润的面积占比下降(P<0.01)。小鼠膈肌天狼猩红染色(图5B-C),发现模型组小鼠肌肉切片中出现大量Ⅰ型胶原纤维沉积(P<0.01)和炎性细胞聚集(P<0.001)。地夫可特组膈肌炎性细胞浸润面积减少(P<0.01),并且具有降低Ⅰ型胶原纤维沉积面积的趋势。
3 讨论
杜氏肌营养不良症作为一种伴X 隐性遗传的肌肉退行性疾病,肌营养不良蛋白突变导致肌肉的再生能力失调,导致肌肉修复障碍,继而出现纤维化损伤,阻碍了肌肉的再生[14-16]。杜氏肌营养不良症被视作多系统疾病[17-18],患者多年幼发病,青少年时期因骨骼肌运动能力严重损伤失去行走能力,最终于青年时期呼吸肌无力或者心肌衰竭致死[19]。研究发现随着疾病进展,杜氏肌营养不良症小鼠呈现体质量增加、活跃度降低、悬挂支撑时间缩短、爬杆缓慢、抓力逐渐减小等变化。地夫可特治疗对小鼠骨骼肌重量无明显影响,治疗4 周时提升小鼠抓力,治疗8 周后明显增加了悬挂支撑时间和前肢抓力,并减少了爬杆耗费时间。以上结果说明随着地夫可特干预时间延长,其对杜氏肌营养不良症小鼠肌肉力量和运动耐力的改善作用逐渐加强。步态分析发现地夫可特增加杜氏肌营养不良症小鼠前后肢步行速度和前肢步行距离,尤其是在改善前肢步态方面效果尤其明显。
肌酸激酶作为衡量骨骼肌损伤的重要指标,在杜氏肌营养不良症中会发生明显变化[20-21]。生化检测发现地夫可特治疗降低了小鼠肌酸激酶水平,同时具有减轻乳酸脱氢酶的趋势,然而它对小鼠血糖产生一定影响,提醒我们高血糖患者使用该药时应监控血糖变化。此外,杜氏肌营养不良症肌肉伴随炎症病变[22],病理组织学分析提示杜氏肌营养不良症小鼠骨骼肌大量炎性细胞浸润和胶原纤维积聚,暗示此疾病可能是通过激活炎症反应促进纤维化过程加重骨骼肌损伤。地夫可特治疗具有重要的抗炎作用,并且具有减轻肌肉纤维化的潜力。
以上分析表明地夫可特治疗增强杜氏肌营养不良症小鼠肌肉力量和耐力,改善步态缓滞失衡表现,同时具有减轻肌肉炎症损伤,削弱肌肉纤维化损伤的趋势。提示地夫可特可能是通过减轻炎性细胞浸润和胶原纤维聚集,从而缓解骨骼肌病变,提高运动耐力和力量。后续还需从分子机制层面探讨地夫可特对杜氏肌营养不良症小鼠骨骼肌炎症和纤维化损伤的治疗机制,寻找药物作用的分子靶标,进一步为肌肉退行性疾病的治疗提供一定的科学依据。
