米尔伊丽莎白菌拮抗菌X2的筛选鉴定及其特性分析
2023-07-31魏开金
张 虹,徐 进,魏开金,徐 滨,王 丹
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院长江水产研究所,农业农村部淡水生物多样性保护重点实验室,武汉 430223)
米尔伊丽莎白菌(Elizabethkingiamiricola)是牛蛙(Lithobatescatebianus)、虎纹蛙(Hoplobatrachuschinensis)、黑斑蛙(Pelophylaxnigromaculatus)、棘胸蛙(Quasipaaspinosa)和棘腹蛙(Quasipaaboulengeri)等[1]蛙类脑膜炎病(俗称“歪头病”)的病原,该病发病广泛、致死率高,已成为蛙类养殖过程最难防治、危害最大的疾病。由于蛙血脑屏障的存在,常用抗生素无法进入病灶发挥抗菌作用[1,2]。同时又存在病原菌抗药性问题,导致该病的药物治疗效果很差[3,4]。
拮抗菌是目前抑制病原体和控制疾病的新手段[5],具有维持肠道微生态平衡,增强宿主免疫力、抵御病原体入侵的作用[6-8]。拮抗菌能通过分泌抗菌物质、竞争附着部位、竞争营养、改变病原体的酶活性、免疫刺激功能等方式抑制病原体,同时还能增强宿主肠道消化功能,促进营养吸收利用,提高饲料消化率和饲料利用率[9-11]。目前,水产养殖中常用的拮抗菌有芽孢杆菌、海洋放线菌、乳酸菌等[12,13],其中,芽孢杆菌作为拮抗菌的一种,能产生多种抗菌物质,对革兰氏阳性菌和革兰氏阴性菌都具有很强的抑制能力[14],部分菌株可产生抗菌肽和抗生素,能直接抑制和杀灭病原菌[15]。芽孢杆菌同时也能有效降低水体硝酸盐氮、亚硝酸盐、氨氮含量,净化水质,改善水产养殖动物生存环境[16]。芽孢杆菌在水环境调控和疾病控制方面发挥越来越重要的作用[17-19]。
本实验从“稻蛙”养殖的稻田土壤中分离、筛选到一株米尔伊丽莎白菌的拮抗菌X2,对其进行了形态学和分子生物学鉴定,并对该菌的生长特性及其降氨氮和亚硝酸盐的作用进行了分析,以期为该拮抗菌的应用提供科学依据。
1 材料与方法
1.1 材料
病原菌:米尔伊丽莎白菌(E.miricola)为实验室从患“歪头病”的黑斑蛙中分离出来,并在-80 ℃冰箱保存。
脑心浸出液肉汤(BHI)为海博生物技术有限公司产品。
氨氮培养基[20]配方为葡萄糖3.75 g、(NH4)2SO40.5 g、K2HPO41.0 g、KH2PO40.3 g、MgSO4·7H2O 0.05 g、FeSO4·7H2O 0.01 g、MnSO4·4H2O 0.01 g、NaCl 5.0 g、1 000 mL蒸馏水,pH7.0。
亚硝酸盐培养基[20]配方为葡萄糖3.75 g、NaNO20.49 g、K2HPO41.0 g、KH2PO40.3 g、MgSO4·7H2O 0.05 g、FeSO4·7H2O 0.01 g、MnSO4·4H2O 0.01 g、NaCl 5.0 g、1 000 mL蒸馏水,pH7.0。
1.2 实验方法
1.2.1 拮抗菌的筛选
(1)初筛:采集青蛙养殖稻田土壤样品,加入10倍体积的BHI液体培养基,300 r/min离心,上层液体28℃下180 r/min摇床上振荡培养过夜。随后采用平板对峙法筛选拮抗菌。取浓度为1.0×1010CFU/mL的米尔伊丽莎白菌300 μL涂布于BHI琼脂培养基上并铺贴6 mm无菌滤纸片,分别滴加30 μL样品菌液至滤纸片上,1 h待干后置于28 ℃培养箱中恒温培养24 h,观察是否有抑菌圈出现,选取出现抑菌圈的样本进行下一步的分离纯化。
(2)复筛:将出现抑菌圈的混合菌在BHI固体平板上进行划线分离、培养,挑取形态大小不一的菌落接种至BHI液体培养基中培养,将拮抗菌液的浓度调整为OD600 nm=0.6~0.8用于拮抗菌的复筛。重复上述平板对峙法,观察抑菌圈大小,找到具有较强拮抗作用的菌株。用游标卡尺测量抑菌圈的直径,这个实验独立地重复三次,选择拮抗效果明显的菌株进行后续研究。
1.2.2 拮抗菌的鉴定
选取出现抑菌圈最大的菌株活化培养24 h,分别对其进行革兰氏染色和磷钨酸负染,分别在油镜和电子显微镜下观察其形态特征,再通过16S rDNA序列进行扩增、测序、比对,结合其形态学特征及16S rDNA 序列系统发育分析,最终确定拮抗菌种类。系统发育分析采用MEGA 7软件,以邻位法构建系统发育树。
1.2.3 X2菌株在不同培养条件下的生长特性
(1)pH:用0.1 mol/L NaOH溶液或0.1 mol/L HCl溶液将BHI液体培养基pH分别调至3、5、7、9、11,取1 mL浓度为1.0×1010CFU / mL的X2菌液接种到100 mL BHI液体培养基中用180 r/min摇床(28 ℃)培养20 h,每2 h用紫外分光光度计于600 nm波长下测量菌液的吸光值(OD600 nm),每次重复测定3 次[21]。
(2)盐度:用NaCl 配制5‰、10‰、20‰、30‰、40‰和50‰不同盐度梯度的100 mL BHI液体培养基[21],分别接种1 mL浓度为1.0×1010CFU/mL的X2培养液,每个盐度梯度设3个平行,180 r/min(28 ℃)培养20 h,每2 h测一次OD600 nm值。
(3)温度:将1 mL浓度为1.0×1010CFU/mL的X2接种于100 mL BHI液体培养基中,分别于20 ℃、25 ℃、30 ℃、35 ℃和40 ℃[11]恒温摇床中180 r/min培养20 h,每个温度设置3个平行,每2 h测量OD600 nm值。
1.2.4 X2对氨氮和亚硝酸盐的降解作用
将1 mL浓度梯度为5.0×109、5.0×107、5.0×105、5.0×103和5.0×101CFU/mL的X2菌液,分别加入到20 mL氨氮浓度稀释至1 mg/L的氨氮培养基和亚硝酸盐浓度稀释至0.4 mg/L的亚硝酸盐培养基中,180 r/min摇床培养,每24 h分别测定培养基中氨氮或亚硝酸盐浓度。氨氮浓度测定采用纳氏试剂比色法[22],亚硝酸盐浓度测定采用分光光度法[23]。计算氨氮和亚硝酸盐的去除率,实验重复三次,计算公式如下:
氨氮去除率=[(初始氨氮浓度-接种后氨氮浓度)/初始氨氮浓度]×100%
亚硝酸盐去除率=[(初始亚硝酸盐浓度-接种后亚硝酸盐浓度)/初始亚硝酸盐浓度]×100%
2 结果
2.1 拮抗菌的筛选
经过多轮的初筛和复筛,获得1株抑菌效果较好的菌株X2。X2的3个平行都出现抑菌圈,其抑菌圈直径为(16.6±0.2)mm。表明菌株X2对病原菌米尔伊丽莎白菌具有稳定的拮抗能力。
2.2 菌株形态特征
对 X2的革兰氏染色结果显示,菌体绝大多数是革兰氏阴性呈红色,少数菌体是革兰氏阳性呈现紫色。透射电子显微镜下观察显示,X2为棒状杆菌,周生多根鞭毛,长约2 μm,宽(直径)约0.8 μm(图1)。这符合芽孢杆菌的形态学特征。

图1 拮抗菌X2的形态特征Fig.1 Morphological characteristics of antagonistic bacteria X2A:革兰氏染色后显微镜观察;B:负染后电镜观察
2.3 16S rRNA 基因序列分析
将菌株X2的16S rDNA序列在GenBank数据库进行核苷酸序列BLAST比对分析,结果显示,X2的 16S rDNA 序列与数据库中的4株侧孢短芽孢杆菌(Brevibacilluslaterosporus)的同源性相似性达到99%。在基于 16S rDNA 基因序列构建的系统发育树中,菌株X2与侧孢短芽孢杆菌(GenBank登录号NR112212.1、NR037005.1、NR118957.1、NR112727.1)位于同一分支(图2),关系最近。根据菌株X2的形态特征以及16S rDNA序列的系统发育分析,鉴定菌株X2为芽孢杆菌属的侧孢短芽孢杆菌(B.laterosporus)。
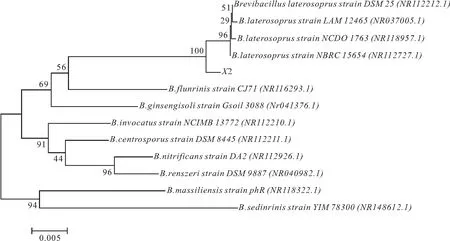
图2 基于 X2 菌株16S rDNA序列构建的系统发育树Fig.2 Phylogenetic tree based on 16S rDNA sequences of strain X2 and other bacteria括号内为菌株的16S rDNA 基因序列在GenBank 中的登录号;分支结点处数字为Bootstrap 值;标尺的数据为进化距离。
2.4 X2在不同培养条件下的生长特性
菌株X2在pH 5~9均能生长,在pH为7时,X2生长状态达到最佳(图3-A),这表明X2能耐受较大范围的酸碱环境。在pH为3或pH为11时,X2几乎不能生长,说明X2在过酸过碱的环境中无法生存。
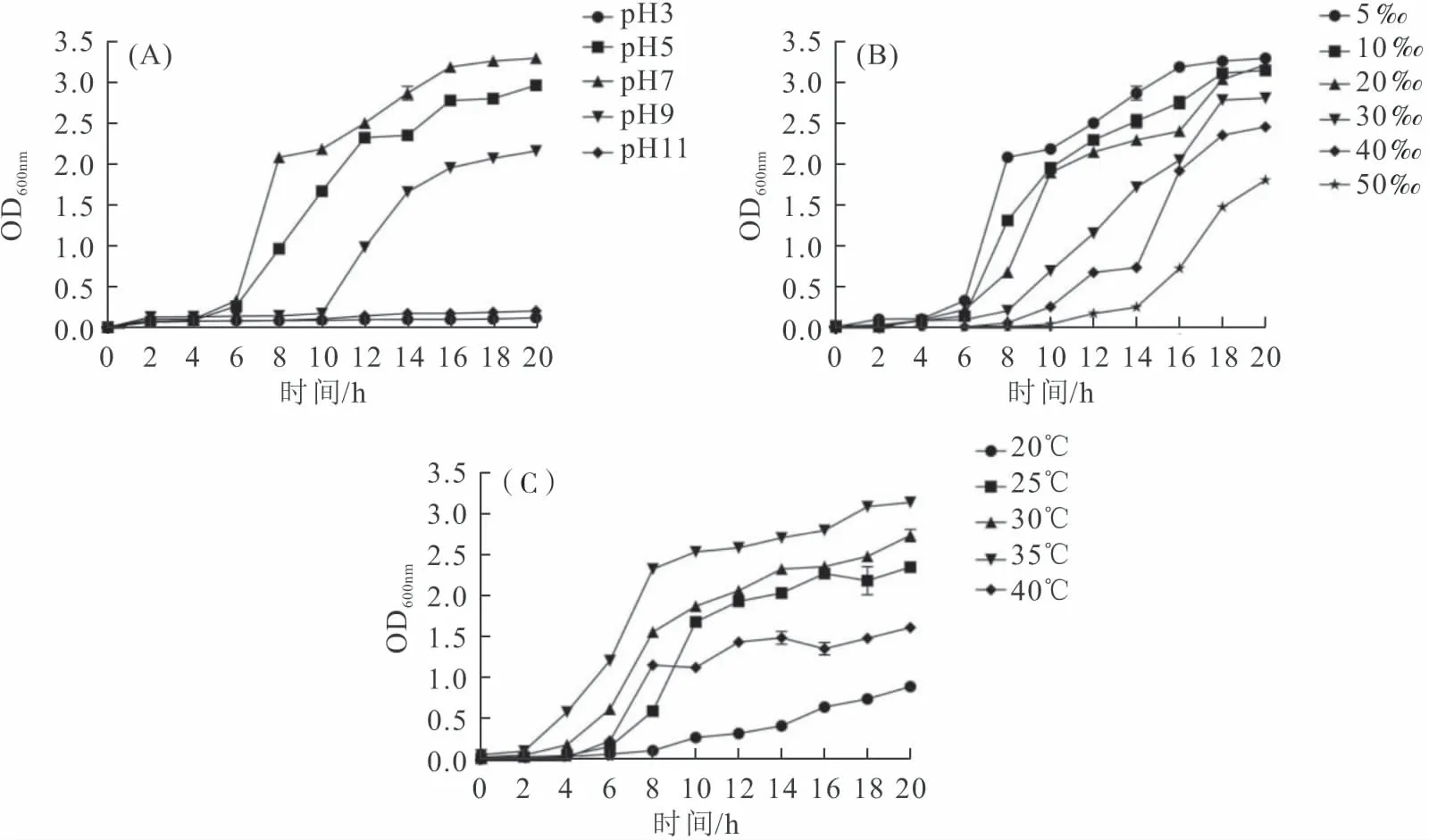
图3 菌株X2在不同pH(A)、不同盐度(B)和不同温度(C)下的生长曲线Fig.3 The growth curves of strain X2 under different pH(A),salinity(B)and temperatures(C)conditions
如图3-B所示,X2在盐度5‰ ~ 50‰内均能生长,最适生长盐度为5‰。在盐度为50‰时,X2生长缓慢,明显受到了抑制,但在低于(含)40‰的盐度范围内,X2都能获得较好的生长。结果表明X2对盐度的耐受性比较强,能适应包括海水在内的绝大多数水体。
不同温度下的生长结果显示(图3-C),X2在20~40 ℃温度内均能生长,20~35 ℃范围内X2的生长活力随着温度的上升而增长。在温度为35 ℃时,菌株X2表现出了明显的生长优势,温度达40 ℃时,X2生长活力降低;20 ℃时菌株的生长活力相对最差。说明X2对高温的适应性较强,对低温的适应性较弱。
2.5 X2降氨氮和亚硝酸盐的能力
不同浓度的X2对培养基中氨氮和亚硝酸盐的去除效果如图4所示,除了最高浓度组外,X2对氨氮的去除率与X2的接种浓度呈正相关,并随时间先上升后保持稳定趋势,在第3天时氨氮去除率达到最高值。在X2接种浓度为5.0×107CFU/mL时对氨氮的降解效果最好,去除率最高达到74.95%。最高浓度组的不佳表现,可能跟菌株自身的代谢排氨有关。
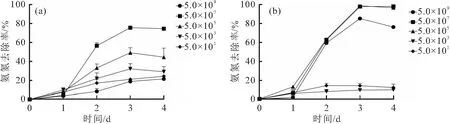
图4 不同浓度(CFU/mL)的X2对氨氮(a)和亚硝酸盐(b)的降解作用Fig.4 Degradation of ammonia nitrogen and nitrite by different concentrations of X2
去除亚硝酸盐方面,X2接种在浓度为5.0×105~5.0×109CFU/mL时均能获得很好的去除效果,其中X2接种浓度为5.0×105CFU/mL在第3天时对亚硝酸盐的去除率最高,达到99.89%。接种浓度为5.0×103CFU/mL和5.0×101CFU/mL的X2对亚硝酸盐的去除效果相对较差。
3 讨论
目前,我国已报道的有良好拮抗效果的芽孢杆菌有短小芽孢杆菌(Bacilluspumilus)、枯草芽孢杆菌(B.subtilis)、地衣芽孢杆菌(B.licheniformis)、巨大芽孢杆菌(B.megaterium)等[24]。本实验获得的菌株X2对米尔伊丽莎白菌具有良好的体外拮抗作用,并通过对菌体形态学特征以及 16S rDNA 序列分析鉴定其为侧孢短芽孢杆菌。侧孢短芽孢杆菌因其能产生抗虫、抗细菌和抗真菌物质,已被作为拮抗菌应用[25,26],SAIKIA 等[27]在2011年报道了侧孢短芽孢杆菌对重要植物病原菌和革兰氏阳性菌具有抑菌作用。本实验结果显示侧孢短芽孢杆菌X2株对米尔伊丽莎白菌具有较强的拮抗能力,能在蛙类疾病防控中发挥作用,将具有较大的应用价值。
对拮抗菌生长特性的研究是其规模化生产应用的基础,研究菌株的最适培养温度、盐度和pH,有利于指导其规模化生产和应用。从拮抗菌X2的生长特性来看,菌株X2在pH 5、pH 9的条件下都能生长,pH 5的生长优于pH 9,这表明该菌株耐酸碱能力强,且对偏酸性环境的适应性要强于偏碱性环境。盐度方面,X2在5‰ ~ 40‰的范围内都能较好生长,这表明X2强大的盐度耐受性能使其广泛应用于淡水和海水的水产养殖中。X2对温度的适应性表明,其对高温的适应性较强,对低温的适应性较弱,其繁殖活力随温度的升高而增强。在病害频发的高温季节,X2能更有效发挥作用。
综上所述,拮抗菌侧孢短芽孢杆菌X2具有较强的耐酸碱性、耐盐性,适温性广等特性,同时具有较强的去除氨氮和亚硝酸盐的能力,可作为益生菌应用于蛙类养殖中防控米尔伊丽莎白菌感染和水质调控,为蛙类绿色健康养殖提供新的技术手段。
