2020年春夏季青海湖浮游植物群落结构及其影响因子
2023-07-31高海鹏窦筱艳
高海鹏,孙 兴,张 昆,郑 鹏,艾 雪,窦筱艳
(1.青海省生态环境监测中心,国家环境保护青藏高原生态环境监测与评估重点实验室,青海省生态环境监测与评估重点实验室,西宁 810007;2.西安理工大学西北旱区生态水利国家重点实验室,西安 710048)
高海拔的湖泊生态系统是监测环境变化、人为干扰以及全球气候变化的理想对象,由于其生物群落结构较为简单,栖息其中的物种多为喜低温物种,高海拔湖泊生态系统对环境变化极为敏感,被认为是监测人为干扰导致的早期变化的“哨兵”,也是监测全球气候变化引起的长期变化的理想对象[1-3]。相比其他类型的水系而言,高原湖泊生态系统受到的关注较少[4]。对高海拔湖泊中浮游生物的研究,为我们深入了解高原湖泊的生态提供了一个视角,可为后续生态系统环境的保护和管理提供科学依据。
浮游植物是水域生态系统食物链中最基础最重要的一环,其群落数量和结构直接影响水体生态系统的结构和食物链的能量传递效率[5]。浮游植物个体微小,繁殖速度快、生长周期短,故群落结构及生物量在水体生态环境变化后能在较短周期内反映出来,也容易在影响因素消除后快速恢复。因而除了初级生产者的作用外,浮游植物也是水体营养状态和环境压力的良好指标,可直接用来作为环境监测的指示生物[6-8]。
青海湖位于青藏高原东北部,是我国面积最大的湖泊,由于所处区域独特的地理位置和生态环境特征,青海湖是我国乃至世界上鸟类及其他野生动物保护的重要区域[9]。目前关于青海湖的研究多集中于气候变化、草地退化和土地沙漠化等生态环境问题[10,11]。而有关该区域的水生生物尤其是浮游植物研究却相对薄弱,仅有中科院兰州地质研究所[12]、青海省生物研究所[13]、杨建新等[14]和姚维志等[15]四次调查记录,且集中于种类记录或单季度调查。本研究通过对青海湖浮游植物春夏两季群落结构及其环境因子系统分析,以期为青海湖水生生物资源的可持续发展提供重要的参考。
1 材料和方法
1.1 样点设置
2020年5月(春季)和8月(夏季)在青海湖(N36°32′-37°15′,E99°36′- 100°47′)布设20个采样点位(B1~ B5、L1~L4、N1~N11),生物采样与水化学采样同步进行(图1)。

图1 青海湖采样点分布图Fig.1 Distribution of sampling sites in Qinghai Lake
1.2 样品采集与测定
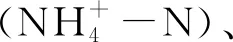
浮游植物定性样品使用25#浮游生物网采集,定量样品使用5 L玻璃采水器取表层水至样品瓶,样品均用鲁哥试剂(用量为水样体积的1.0%~1.5%)固定。样品沉淀48 h后进行浓缩保存到50 mL样品瓶中以待镜检,吸取0.1 mL于计数框,在光学显微镜下放大400倍计数,对硅藻样品进行酸化烧片预处理后鉴定,藻类鉴定方法参考文献[17,18],采用细胞体积法计算浮游植物生物量。
1.3 数据处理
采用Shannon-Wiener 多样性指数(H′)[19]、Simpson多样性指数(D)[20]、Margalef 丰富度指数(d)[21]和Pielou均匀度指 数(J)[22]表示浮游植物群落多样性,计算公式如下:
(1)
(2)
(3)
J=H′/lnS
(4)
式中,Pi为第i种藻类个体数(Ni)占总个体数(N)的比例,S为样点物种数。
优势种根据各个物种优势度(Y)值确定,公式为:
Y=ni/N×fi
(5)
式中,ni为第i种浮游藻类的丰度,N为总丰度,fi为第i种浮游藻类的出现频率。将Y≥0.02的种类定为优势种[23]。
在SPSS26.0中利用配对样本t检验分析两次调查环境因子及浮游植物物种数、密度、生物量和多样性指数之间是否存在显著差异(P<0.05)。对浮游植物物种数、密度、生物量和多样性指数与环境因子进行Pearson相关性分析,进一步利用多元线性回归模型(MLR)筛选出对浮游植物群落结构有显著影响的环境因子,在分析之前,对非正态的环境变量进行log(x+1)转化,剔除相关性较高的环境变量(r>0.80),用前选法(forward selection,基于最高的adjustedR2)确定对浮游植物群落结构具有重要且独立作用的关键环境因子。利用 Excel汇总整理数据,Origin2021完成作图。
2 结果与分析
2.1 环境参数
两次青海湖环境因子调查结果见表1。总体而言,青海湖水温较低,水体总体呈弱碱性,除COD外,各个指标均满足地表水环境质量Ⅱ类水质标准。配对样本t检验结果显示,夏季水温和CODMn显著高于春季,其余环境因子差异不明显。
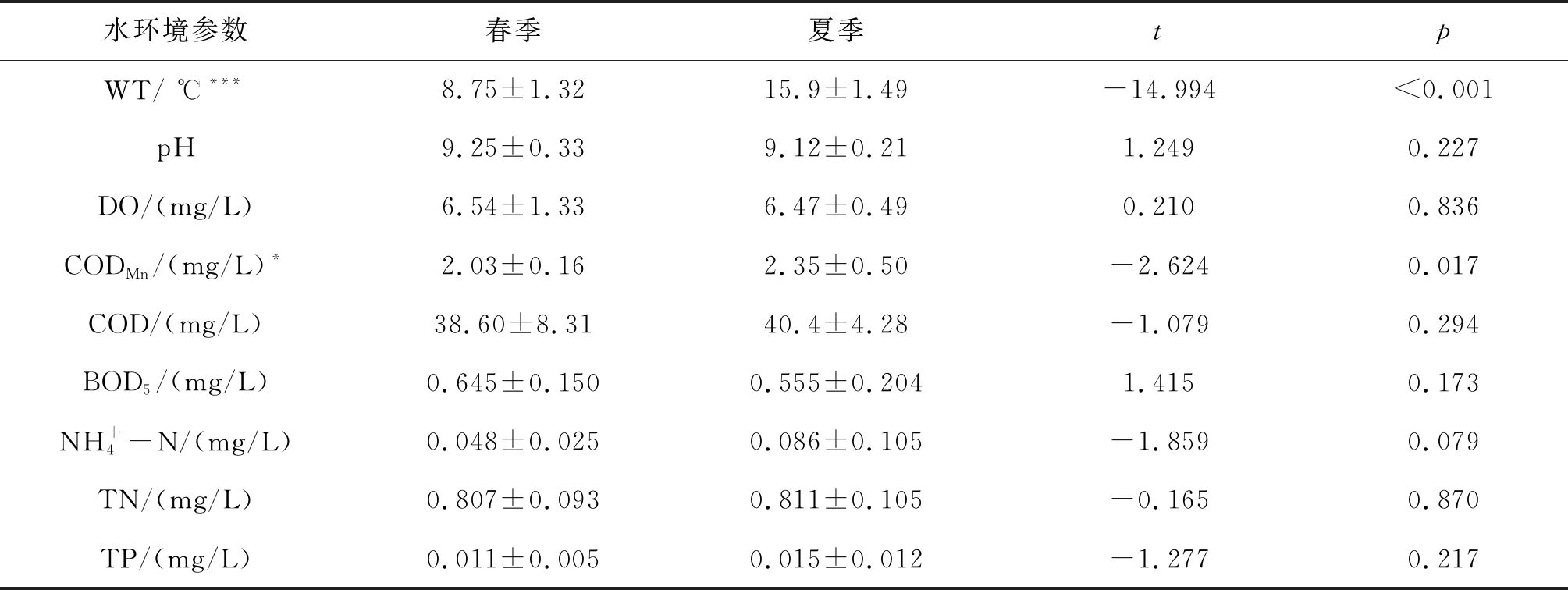
表1 青海湖的水环境参数在两个季度的比较Tab.1 Comparisons of environmental factors between two seasons in Qinghai Lake
2.2 浮游植物群落特征
2.2.1 物种组成与优势种
两次调查共检出浮游植物5门29属50种,其中硅藻门15属29种(占总物种数的58.00%),绿藻门10属15种(占比30.00%),蓝藻门4属4种(占比8.00%)、甲藻门和裸藻门只有一属一种。其中,春季共检出21属34种,夏季共检出20属29种。从春季到夏季,硅藻门的物种数增加了4种,蓝藻门增加了1种,绿藻门减少了10种(表2)。

表2 青海湖浮游植物种类名录Tab.2 List of phytoplankton in Qinghai Lake
在密度方面,春季优势类群依次为硅藻门、蓝藻门和绿藻门,占总浮游植物密度比分别为47.01%、27.12%、25.35%,而夏季最具优势的类群为蓝藻门(63.27%),绿藻门(23.49%)和硅藻门(9.28%)分别成为第二和第三优势类群,可以看出,尽管硅藻门、蓝藻门和绿藻门在春夏两季中均为青海湖的优势类群,但其占比已经发生了较大的变化。
优势种方面,夏季优势种数目多于春季。小环藻、环离鞘丝藻(Lyngbyacircumcreta)和湖生卵囊藻在两次调查中均为优势种。在春季,小环藻和环离鞘丝藻是最具优势的物种(0.384,0.271),夏季最具优势的物种为环离鞘丝藻(0.489)和湖生卵囊藻(0.234),小环藻的优势度已经明显下降(0.068)。可以看出,蓝藻门和绿藻门的物种在夏季已经超越硅藻门的物种从而占据了绝对的优势。此外,春季优势种卵囊藻在夏季并未出现,夏季优势种微小平裂藻、腔球藻和细小隐球藻也在春季没有出现(图2,表3)。

表3 青海湖浮游植物优势种及优势度Tab.3 Dominant species and dominance index of phytoplankton in Qinghai Lake

图2 两个季度青海湖浮游植物优势类群密度及其相对丰度(Mean±SD)Fig.2 Mean value and standard deviation (SD)of the density and relative abundance of dominant groups of phytoplankton in the Qinghai Lake between two seasons***表示P<0.001;**表示P<0.01
2.2.2 浮游植物密度、生物量及多样性指数
对两次调查浮游植物群落结构进行配对样本t检验,分析结果显示,密度、生物量和多样性指数出现了显著的季节差异。具体而言,夏季浮游植物密度、生物量显著高于春季,其值大约增加了9倍。其中,春季青海湖浮游植物各样点密度变化为1.66×105~7.26×105ind/L,平均密度为3.55×105ind/L,夏季密度变化为9.93×105~5.72×106ind/L,平均密度为3.35×106ind/L;春季各样点的生物量为4.25~18.97 μg/L,平均生物量为9.67 μg/L,和密度变化趋势一致,浮游植物生物量也显著增加,夏季生物量为32.33~355.91 μg/L,平均生物量为98.56 μg/L;多样性指数也有显著季节变化,但变化趋势与密度和生物量相反。从春季到夏季,Shannon-Wiener多样性指数、Pielou均匀度、Margalef指数和Simpson指数均显著减少。此外,虽然从春季到夏季物种数量略有增加,但变化不显著(表4)。
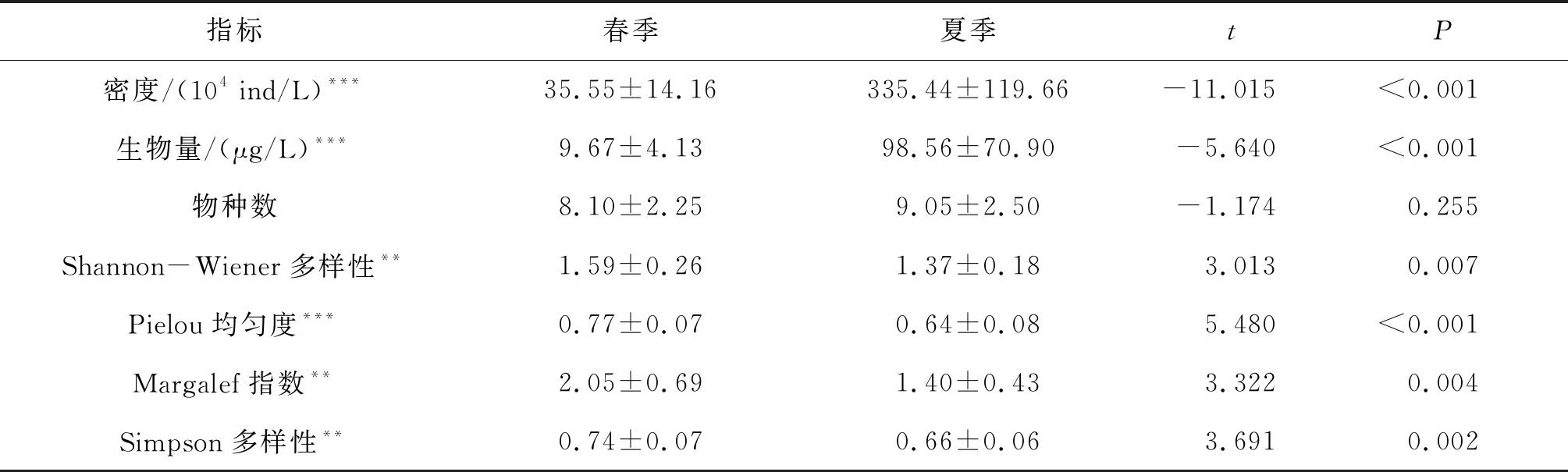
表4 青海湖的浮游植物密度、生物量及多样性指数在两个季度的比较Tab.4 Comparisons of phytoplankton of abundance,biomass,taxa richness,and diversity indexes between two seasons in Qinghai Lake
2.2.3 浮游植物与环境因子关系
Pearson分析结果表明,密度和多样性指数与水温、CODMn有显著的相关性,不同的是,密度与水温和CODMn之间呈显著正相关,而各多样性指数与水温和CODMn之间呈显著负相关。此外,生物量与水温也存在显著正相关,物种数与BOD5呈现显著负相关,Simpson多样性指数与COD之间呈显著负相关(表5)。
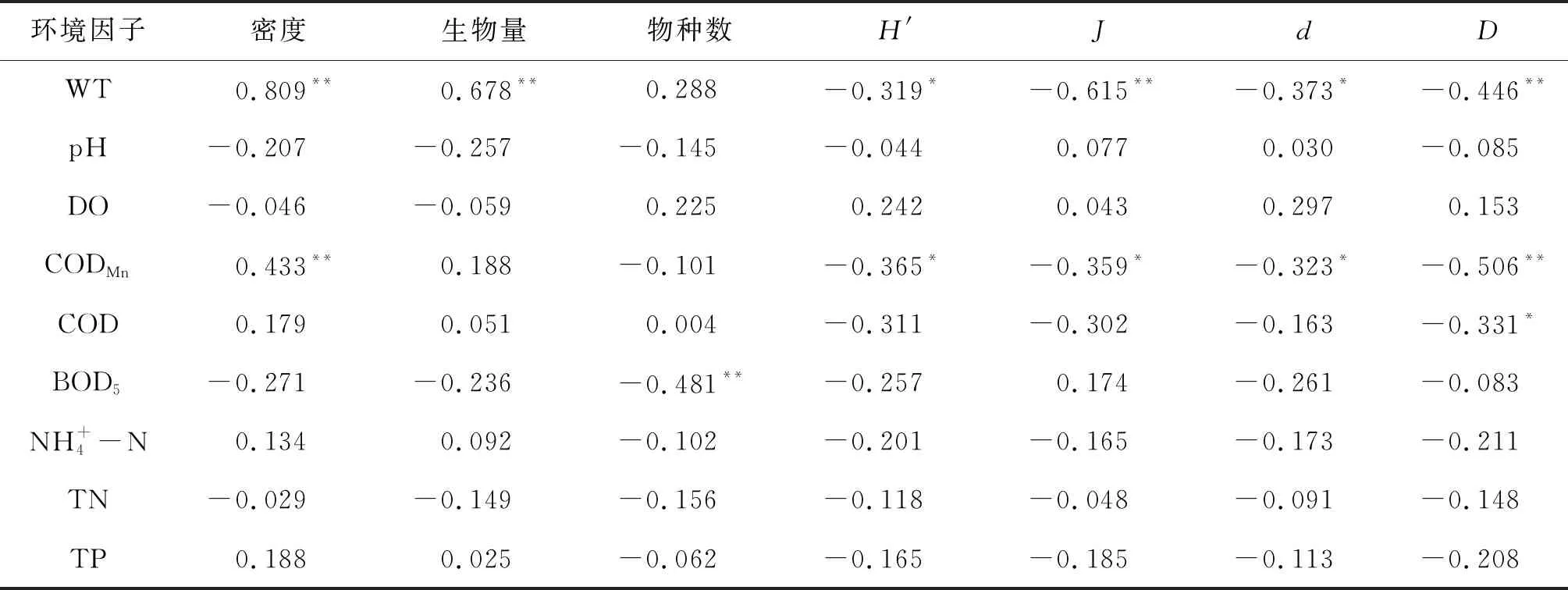
表5 青海湖浮游植物群落参数与环境因子Pearson相关性分析Tab.5 Pearson correlation analysis between metrics of phytoplankton communities and environmental factors in Qinghai Lake.
各种水环境因子对浮游植物密度、生物量和多样性指数的影响作用各不相同。多元回归分析(MLR)结果进一步表明,水温和CODMn是浮游植物密度、生物量和所有多样性指数的关键环境因子。此外,不同的环境因子对浮游植物密度、生物量和多样性指数的影响程度也有所差异。具体来说,环境因子对浮游植物密度、生物量和多样性指数的解释率从高到低依次是密度、生物量、Pielou均匀度、Margalef指数、Simpson多样性指数、物种数和Shannon-Wiener多样性指数(表6)。

表6 青海湖浮游植物群落结构与环境因子的回归分析Tab.6 Results of regression analyses for phytoplankton community structure and environmental factors in Qinghai Lake.
3 讨论
3.1 青海湖浮游植物群落变化
本研究发现,青海湖浮游植物密度、生物量、优势类群和多样性指数在春夏两次调查中出现了显著的季节变化。首先,从春季到夏季,浮游植物密度和生物量增加了大约9倍。其次,优势类群在两次调查中所占总密度比例上也发生了明显的变化,夏季蓝藻门超越春季的硅藻门成为最具优势类群,具体到物种来看,夏季的环离鞘丝藻(Lyngbyacircumcreta)已经取代春季的小环藻(Cyclotellasp.)成为最具优势的物种。与密度和生物量在夏季的显著增加不同,夏季浮游植物的各多样性指数(Shannon多样性指数、Pielou均匀度、Margalef指数和Simpson多样性指数)相比春季出现了一定程度的降低。青海湖春、夏两季浮游植物的现存量和群落组成变化较大,主要是因为两次调查中,水温变化较大。Pearson相关性分析表明,水温增加与浮游植物密度生物量呈现显著正相关,与多样性指数呈现显著负相关。
历史上四季调查显示硅藻门均为最优势类群[12-15],而本研究中夏季调查显示蓝藻门已超过硅藻门成为最优势类群,这一结果与2019年青海湖调查报告结果类似[25]。本次调查的浮游植物密度出现了较大幅度增加,优势类群和优势种类也发生了较大的变化,这一变化可能与近年来青海湖水温和水体营养盐增加密切相关。相比上世纪六七十年代,在全球气候变暖的大趋势下,青海湖非冰期表层湖水平均温度上升了2 ℃左右[11,24],水温上升促进了藻类的生长繁殖。由于不同种类的浮游植物对温度的适应性不同,根据研究,硅藻喜低温生长而蓝藻喜高温生长[26,27]。近些年来,青海湖营养盐浓度明显增加,尤其是总磷和磷酸盐增加显著[28-30]。不同浮游植物对营养盐的吸收和耐受能力也不一致,因此营养盐浓度变化能够影响浮游植物群落结构组成[31]。有研究表明,蓝藻门在营养盐较高的水体中易成为优势种群,营养盐对蓝藻的生长促进作用大于水温变化对蓝藻的促进作用[32]。
3.2 青海湖浮游植物与水环境之间的关系
影响浮游植物群落在水生态系统中生长和繁殖的主要环境因子包括水温、光照、营养盐浓度、水体动力等非生物因素,以及浮游动物和鱼类捕食等生物因素[33,34]。Pearson相关性分析及回归分析表明,水温是影响青海湖浮游植植物密度、生物量和多样性指数的显著因素,与众多湖库研究结果一致[35,36]。两次调查显示,浮游植物密度、生物量有显著差异,夏季密度、生物量远高于春季,这一变化与水温上升密切相关,水温可以通过影响浮游植物的生理和代谢过程直接影响浮游植物,也可以通过影响浮游植物的生长水环境间接影响浮游植物[37]。水温的变化影响着水体物理、化学和生物活动,从而影响水体上下水层的交换、营养物的生化循环和分布[38,39]。青海湖夏季水温高,营养物输入增加,物质循环加快,营养盐含量增大,浮游植物密度和生物量也随之增加,春季水温低,营养物再生减缓,浮游植物密度和生物量也因此较低。两次调查浮游植物种类组成均以硅藻为主,但优势类群有显著差异,研究表明,冷水中常见的藻类多个体偏小,温度升高多出现个体偏大的藻类,硅藻更适宜在低温中生长,蓝藻更适合在高温中生长[26,40]。本研究中季节群落变化与近几十年来青海湖群落演替结果均符合这一规律。此外,两次调查的浮游植物多样性也有明显差异,一般情况下,多样性指数减少,意味着浮游植物群落结构趋于简单,稳定性变差,水质下降[41]。Pearson相关性分析及回归分析结果显示CODMn与浮游植物多样性呈显著负相关,夏季由于气温升高,青海湖旅游热度上升,人类活动对水环境造成影响不容忽视,进而导致水体CODMn增加,这可能是造成夏季浮游植物多样性降低的主要原因。
4 结论
青海湖两次调查共检出浮游植物5门29属50种,硅藻门、蓝藻门和绿藻门为主要优势类群。不同季节的浮游植物群落结构差异较大,从春季到夏季,浮游植物密度和生物量均显著上升,多样性指数显著下降。Pearson相关性分析和回归分析表明,水温和CODMn对青海湖浮游植物群落结构影响显著。
