氨水对溶胶-凝胶法制备硅溶胶粒径及稳定性的影响
2023-07-31熊江敏陆成龙张银凤李崇瑞
熊江敏,段 宁,陆成龙,张银凤,李崇瑞
(1.武汉科技大学资源与环境工程学院,武汉 430081;2.湖北理工学院矿区环境污染控制与修复湖北省重点实验室,黄石 435003;3.湖北理工学院先进材料制造与固废资源化协同技术湖北省工程研究中心,黄石 435003)
0 引 言
溶胶-凝胶(sol-gel)法是近年来制备无机功能纳米材料最为常见的方法[1],因具有工艺流程简单、成本低廉、产品纯度高等优点,在制备陶瓷、纤维、薄膜中具有重要应用,被广泛用于制备纳米粉体[2-3]。二氧化硅溶胶具有耐高温、耐酸碱、比表面积大、化学稳定性好等优点,被广泛运用在催化剂、陶瓷、气体分离、废水分离、膜催化反应器等方面,拥有广阔的市场前景[4-8]。因此,方便、快捷、经济地制备出高性能的二氧化硅纳米粉体就显得尤为重要。
通常情况下,溶胶-凝胶法制备二氧化硅溶胶所发生的水解、缩聚反应速率很小,需添加合适的催化剂来提高反应速率[9-10]。其中,加入催化剂主要分为两类[11],一类是HCl、HNO3等酸性催化剂,另一类是以NH3·H2O、NaOH为主的碱性催化剂,在两类催化剂的作用下都能快速制备出二氧化硅溶胶。但是在酸性条件下,制备的二氧化硅溶胶粒子稳定性差,分散不均匀,易于团聚凝胶;而碱性条件下制备的二氧化硅溶胶分散性好,稳定性强,利于长期保持。张家豪等[12]认为以酸为催化剂时,正硅酸乙酯(TEOS)水解速率较小,一般只能水解出1~2个Si—OH。以碱为催化剂时,TEOS的水解为亲核反应,羟基(—OH)会直接攻击硅原子核,致使TEOS水解出3~4个Si—OH。因此,在碱性条件下,水解速率比酸性条件下更大。Zhou等[13]探究了不同种类的碱性催化剂对溶胶-凝胶法制备的二氧化硅粒径分布的影响,结果表明,弱碱性的体系有利于获得具有均匀形貌的二氧化硅纳米颗粒,而强碱性的体系中有利于获得较大的粒径但形貌不规则的纳米颗粒。综上所述,为获得尺寸均匀、稳定性好的二氧化硅溶胶粒子,应采用弱碱性的NH3·H2O为催化剂。
Gao等[14]采用溶胶-凝胶法,仅通过控制溶剂的添加量制备出了粒径70~400 nm的二氧化硅实心微球。Kim等[15]在低温的条件下,采用溶胶-凝胶法制备出了粒径60~120 nm的二氧化硅颗粒,并研究了其亲水性能。目前,虽然有较多的文献探究单因素变量对二氧化硅粒径的影响,但这些研究只讨论了变量对粒径大小、形貌变化的影响,而少有探究粒径变化所导致溶胶稳定性变化的原因。然而,二氧化硅溶胶的稳定性在制备多用途二氧化硅溶胶以及二氧化硅膜时又是一个十分重要的制备参数,有必要进行进一步研究。因此,本文在以氨水为催化剂变量下,研究了其对二氧化硅粒径变化的同时,进一步分析了粒径变化对溶胶稳定性的影响及原因,为更好地制备粒径均匀、稳定性好的硅溶胶提供重要参考。
1 实 验
1.1 试剂与仪器
溶胶-凝胶法制备二氧化硅溶胶所采用的化学试剂包括:正硅酸乙酯(TEOS,C8H20O4Si,天津市科密欧化学试剂有限公司,分析纯)、无水乙醇(上海国药,分析纯)、浓氨水(上海国药,分析纯);超纯水(实验室制备)。
实验制备所用到的仪器设备包括:电子天平(上海越平科技有限公司,FA-2204C)、集热式恒温磁力搅拌器(上海历辰邦西仪器科技有限公司,DF-101S)。
1.2 二氧化硅溶胶的制备
以TEOS为原料制备硅溶胶的流程如图1所示。准确量取50 mL无水乙醇于三口烧瓶中,向其中加入一定体积的浓氨水,室温下搅拌数分钟使其混合均匀,得到A液;将3 mL B液TEOS缓慢地滴加到A液中,并加入适量的去超纯水,确保TEOS的浓度为0.25 mol/L,得到C液,C液在70 ℃下剧烈搅拌2 h,静置后得到二氧化硅溶胶。其中氨水与TEOS的摩尔比值记作R(R=n(NH3·H2O)∶n(TEOS)),且R值的取值范围为1~10。

图1 二氧化硅溶胶制备流程Fig.1 Preparation process of silica sol
1.3 测试表征
采用X射线衍射仪(布鲁克科技有限公司,D8A),在5°~90°的扫描范围下对干燥研磨后不同R值的粉末进行物象分析;用Zetasizer Nano粒度/电位分析仪(马克文仪器有限公司(中国),ZEN3690)分析不同R值二氧化硅溶胶的粒径分布情况以及各组分溶胶样品的Zeta电位;用场发射扫描电子显微镜(日本电子株式会社,JSM-6710Fp)分析不同R值的二氧化硅溶胶粒子的形态以及EDS能谱仪分析元素分布;用热分析仪(梅特勒-托利多国际有限公司,TGA2(SF)),在氮气氛围条件下,以10 ℃/min升温速率测试得到二氧化硅溶胶的差热分析曲线。
2 结果与讨论
2.1 二氧化硅溶胶外观及物相分析
使用TEOS制备二氧化硅溶胶,通过控制不同氨水和TEOS的比例R值制得的硅溶胶样品如图2所示。

图2 不同R值下的二氧化硅溶胶样品图Fig.2 Image of silica sol samples at different R values
当加入的氨水量过少时,水解反应缓慢,只有少部分TEOS参与反应,并无法在反应持续时间内水解完全,因此,呈现出无色透明状态;当R≥4时,由于氨水加入量的增加,水解反应加快,更多的TEOS参与水解反应,同时伴随着缩聚反应的进行,所得到的溶液也从淡蓝色转变为深蓝色,最终呈乳白色,在红外光线的照射下出现明显的丁达尔效应,形成二氧化硅溶胶。
将R值分别为2、4、6、8的二氧化硅溶胶烘干后测得的XRD谱如图3所示。图中并没有出现明显的尖峰,但在2θ≈22°处出现一个较宽的非晶衍射峰,是无定形二氧化硅的特征峰,虽然随着氨水加入量的增加,衍射峰强度稍微增加,表明样品中纳米二氧化硅含量增加,但总体上没有影响二氧化硅的晶体结构,所制备二氧化硅溶胶以非晶相形式存在。
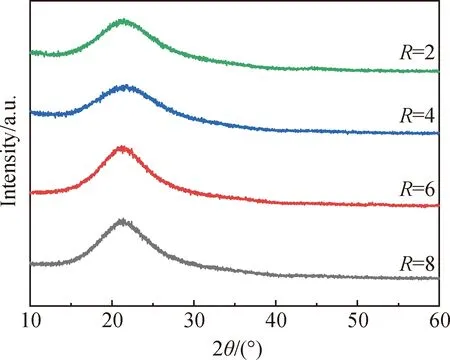
图3 不同R值下二氧化硅溶胶粉末XRD谱Fig.3 XRD patterns of silica sol powder at different R values
图4展示了二氧化硅干燥凝胶的TG-DTA曲线。TG-DTA曲线显示,烘干后凝胶的主要失重阶段发生在150 ℃以内,在100 ℃附近有一个强烈的吸热峰,这是凝胶中吸附水、乙醇等物质的脱附释放引起的[16],样品的失重率约为7.93%。在150 ℃以后,样品基本不再失重,TG曲线保持水平。

图4 二氧化硅溶胶热重分析曲线Fig.4 Thermogravimetric analysis curves of silica sol
2.2 氨水的加入量对二氧化硅溶胶粒度及分布的影响
由图2可知,不同R值下制备的二氧化硅溶胶颜色有差别,为了探究产生这一差异的原因,对不同R值下制备的二氧化硅溶胶进行粒度分析,结果如图5所示。

图5 不同R值下的二氧化硅溶胶粒径分布图Fig.5 Frequency distribution curves of silica solparticles under different R values
图6为不同R值对二氧化硅溶胶平均粒径的影响,由图5以及图6可以看出,随着R值的增加,二氧化硅粒径分布峰向右移动,粒径随之变大,从10.17 nm(R=1)逐渐增加到142.48 nm(R=10)。当R<4时,水解反应速率较慢,单位时间内产生的正硅酸等中间体较少,相应的聚合反应也较慢,因此,粒径增长较为缓慢,粒径较小。当R≥4时,水解反应随着氨水的加入进一步加快,单位时间内产生的中间体增加,使得参与聚合反应的反应物增加,促进了聚合反应的正向进行,平均粒径大幅增长。总体上平均粒径与氨水的加入量(即氨水与TEOS的比例)表现为指数相关关系,为了更好地探究其变化规律,建立氨水加入量x与二氧化硅平均粒径y的函数,其拟合函数为y=2.22x1.79,相关性为0.96,可为后期的制备粒径在10~140 nm的二氧化硅溶胶的研究提供参考。
从图5还可以看出,氨水加入量的变化不但会影响二氧化硅溶胶的平均粒径,还会影响胶粒的分布宽度。溶胶粒径分布宽度越窄,说明溶胶粒子的均匀性越好。以二氧化硅溶胶粒径分布的半高宽(full width at half maximum, FWHM)表示粒径的分布均匀情况,不同R值下制备的硅溶胶粒径分布半高宽如图7所示。从图7中可以看出随着R值的增大,硅溶胶粒径分布的半高宽也在不断变化,从最初的9.89 nm (R=1)逐步增加到171.61 nm(R=10)。可以说明氨水的加入量增加会使得溶胶粒径分布半高宽变宽,这是由于硅溶胶胶粒长大以及缩聚速率不同会导致半高宽的增加。当R值较小时,TEOS的水解速率较小,水解产生的中间产物较少,导致粒径较小且半高宽也较小;当R较大时,水解反应速率较大,产生的中间体较多,在已产生的中间体发生聚合反应的同时,新水解产生的中间体才刚开始发生聚合反应,所以导致中间体聚合程度大不相同,在粒径变大的同时,半高宽也在不断地增大。
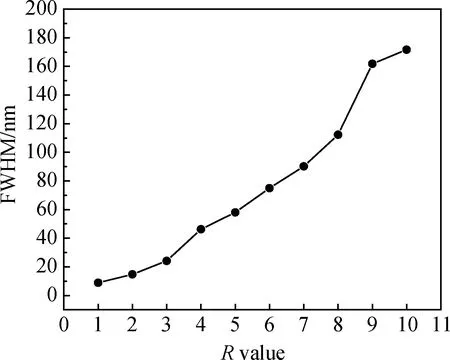
图7 不同R值对硅溶胶粒径分布半高宽的影响Fig.7 Influences of difference R values on FWHM of frequency distribution of silica sol
为了验证上述粒径分析的结果,对不同的R值样品进行场发射扫描电子显微镜测试,所得到的SEM-EDS照片如图8所示。图中可以看出二氧化硅溶胶粒径依次增大,干燥后二氧化硅粉末粒径分布较为均匀,没有出现团聚现象,多数粒径小于100 nm。图8(k)和(l)为Si和O的元素分布图,从氧、硅元素分布情况可以进一步得出制备的二氧化硅溶胶分散均匀且无团聚现象。

图8 二氧化硅溶胶粉末SEM-EDS照片。(a)~(j)分别为R=1~10时的SEM照片;(k)~(l)为R=1时硅溶胶的EDS谱Fig.8 SEM-EDS images of silica sol powder. (a)~(j) SEM images of silica sol powder with R = 1~10, respectively;(k)~(l) EDS patterns of nano SiO2 (R=1)
结合上述粒径分布图以及SEM照片可知,二氧化硅溶胶粒径的大小随着氨水的加入量的增加而变大。在以碱性为催化剂的体系中,溶液中存在半径较小的阴离子(OH-),这些阴离子能够直接攻击硅原子核,使得硅原子核带负电并向另一侧的—OR基团偏移,这种效应使得Si—O键能被削弱最终发生断裂,完成水解反应。在碱性体系中,TEOS的水解速率大于聚合速率,并且水解反应较为完全[17]。因此,可以认为缩聚反应是在水解反应完成的基础上进行的,二氧化硅胶粒的大小受到水解速率的控制,水解速率越大,形成的二氧化硅胶粒也就越大。由此可见,氨水加入量的增加,间接性地增加了当体系中的阴离子,导致阴离子攻击硅原子核的能力增大,故水解反应的速率也逐渐加大,形成的二氧化硅溶胶粒径也就越大。因此,氨水的加入量是影响二氧化硅颗粒大小的重要因素。
2.3 氨水的加入量对二氧化硅溶胶稳定性的影响
溶胶-凝胶法制备多用途二氧化硅溶胶和二氧化硅膜时,溶胶的稳定性是一个很重要的影响因素[18-19],本文采用溶胶的团聚度和凝胶时间来评价其稳定性能。在制备多用途二氧化硅溶胶时,需要保障溶胶长时间稳定性,凝胶过程较快则导致产品不易于长期保存并失去相应的功能;而制备二氧化硅膜时,则需要调整合适凝胶时间,凝胶时间太长,则制备过程中老化时间消耗长,制备效率低;凝胶时间太短,黏度不易控制,则会影响涂膜的均匀性。
溶胶的团聚程度可以从图5和图8得出,图5中没有出现其他粒径分布的杂峰,图8中元素分布均匀,都得出所制备的二氧化硅溶胶分布均匀,且无团聚。凝胶时间是评价溶胶稳定性的另一手段,凝胶时间的评价标准是指在试管倾斜45°时,液面不发生流动的时间点。
纳米二氧化硅溶胶的凝胶化过程,主要包括四个阶段:1)纳米二氧化硅颗粒表面形成硅氧化学链(Si—O链);2)Si—O链向溶液中缓慢生长;3)Si—O链缠绕在纳米二氧化硅颗粒表面;4)以Si—O链为骨架,形成三维网络凝胶结构[20]。因此,纳米二氧化硅溶胶的凝胶化过程既包括硅酸之间的缩合反应,也包括纳米二氧化硅大颗粒的缩合反应。硅酸之间的缩合反应遵循双分子亲核取代反应SN2反应机制[21],溶液中的水分子诱导硅酸上硅醇基团质子化,降低缩合反应能垒,硅醇基团的电离又能够促进缩合反应,如Si(OH)3O-之间的二聚反应比Si(OH)4更容易发生,从而促进缩合反应。Zhang等[22]研究了pH值对硅酸盐溶液中低聚物结构形成的影响,表面在中性pH值条件下,低聚物呈线性生长,而在较高pH值条件下,低聚物偏向形成环状。正是由于在较高的pH值下,低聚物偏向于形成环状颗粒物,所形成的纳米二氧化硅颗粒之间的碰撞和聚集,导致了溶胶的凝胶化。从图9中R值对凝胶时间的影响可以看出,随着氨水的用量增加,二氧化硅溶胶的凝胶时间呈先下降再上升的下抛物线趋势,凝胶时间先从684 h(R=1)下降到28 h(R=5),再上升到780 h(R=10)。这是因为当氨水加入量过少时,体系中的羟基(—OH)含量少,导致水解反应速率慢,水解产物少,产生的硅酸难以接触并发生缩聚反应,从而导致较大的凝胶时间;随着氨水的增加,水解产物Si(OH)3O-逐渐增加,纳米二氧化硅颗粒接触概率上升,凝胶过程加快。当体系中羟基含量进一步增加时,此时水解速度很快,但是完全水解形成的Si(OH)4属于一种弱酸,在碱性的体系中少量脱氢后则形成一种强碱,会对其他硅原子核发动攻击,并脱醇聚合或脱水聚合,但是进行这种方式的聚合反应时的位阻效应很大[23],所以聚合速率较慢,阻碍了Si(OH)4的缩聚反应,凝胶时间延长。在制备二氧化硅膜时,选择合适的凝胶时间十分重要。凝胶时间越短,越不稳定,因为凝胶过程会导致黏度大幅度增加[24],使得在制备二氧化硅膜的涂膜均匀性受到影响;时间越长,则凝胶过程太长,不利于涂膜时机的把握。因此,采用氨水作为TEOS水解催化剂制二氧化硅膜的最佳比例为R=5~7;为了制备高稳定性多用途二氧化硅溶胶时,则需避免使用R=5~7的比例。
二氧化硅溶胶的稳定性也可以通过DLVO理论来解释[25],DLVO理论认为胶粒在溶胶体系中同时受到双电层斥力以及分子间的范德华引力的作用。溶胶的胶核部分由二氧化硅组成,在胶核和溶剂的接触面上水解形成硅羟基键(Si—OH)。羟基属于极性分子键,因此,胶核表面呈现负电位,水中游离的一些极性水分子和水合氢离子H3O+被吸附在胶核表面,形成吸附层[26-27]。同时,溶液中的水合氢离子H3O+做布朗运动的过程中受到胶粒的静电吸附作用形成扩散层,与吸附层共同组成微粒的双电层,当双电层电荷的绝对值越低,斥力小,胶粒间相互接触而团聚;当绝对值越大,颗粒之间的静电排斥防止二氧化硅颗粒碰撞和聚集,则溶胶的稳定性增强。不同R值对二氧化硅溶胶Zeta电位的影响如图10所示,在以氨水为催化剂的溶胶体系中,随着氨水量的加入,Zeta电位先缓慢上升后降低,其中当R<5时,Zeta电位均在-10~-25,由双电层理论可知,Zeta电位的绝对值小于30时,溶胶稳定性较差、易于团聚。但是,这与溶胶的实际凝胶时间较长不相符,可能的原因是氨水加入量较少,TEOS水解速率慢,反应产物过少,导致体系中的中间产物难以接触发生聚合反应,所以凝胶时间相对较长。当R>5时,Zeta电位从-28.7(R=5)下降到-84.6(R=10),电荷的绝对值逐渐增大,根据双电层理论可知,溶胶越来越稳定,相应溶胶的凝胶时间也逐渐增加,电位的变化与凝胶时间长短相符。因此Zeta电位可以用来解释溶胶的稳定性以及溶胶的凝胶时间的变化。

图10 不同R 值对二氧化硅溶胶Zeta电位的影响Fig.10 Influences of different R values on Zeta potential of silica sol
3 结 论
1)二氧化硅溶胶平均粒径随R的增大呈正相关趋势,从10.17 nm(R=1)增加到142.48 nm (R=10); 胶粒的粒径分布半高宽从9.89 nm (R=1)增加171.61 nm (R=10),总体呈上升趋势。
2)建立了氨水的加入量x与二氧化硅溶胶粒径y的函数关系,其拟合函数为y=2.22x1.79,相关性为0.96,具有较好的相关性。
3)氨水的加入量使二氧化硅溶胶的稳定性先降低然后增加。R<5时,随着氨水加入量的增加,二氧化硅溶胶的稳定性逐渐变差;R值>5时,随着氨水加入量的增加,二氧化硅溶胶的稳定性逐渐增强。
