产时抗菌药物预防对6月龄内婴儿肠道菌群组成的影响
2023-07-31朱中海祝瑛泽曾令霞
齐 琪,朱中海,王 良,祝瑛泽,韩 蓓,程 悦,曾令霞
(1.西安交通大学医学部公共卫生学院流行病与卫生统计学系,陕西 西安 710061;2.陕西省营养与食品安全工程研究中心,陕西 西安 710061)
围产期是塑造婴儿肠道菌群定植的关键时期[1],也是各种感染高发的阶段,产时抗菌药物预防(intrapartum antimicrobial prophylaxis,IAP)[2]作为该时期控制感染的主要手段,不仅使新生儿B族链球菌(GBS)感染的发生率降低50%~80%[3],还可降低母亲剖宫产伤口感染的几率[4]。然而,产时抗菌药物预防干扰了新生儿肠道菌群的自然定植过程,对婴儿短期和长期健康产生潜在的负面影响[5]。研究表明,抗菌药物可通过脐带转移到婴儿体内并存在长达10个小时[6],可延迟双歧杆菌的早期定植、使得机会致病菌在婴儿肠道内持续存在[7-8],这一影响可持续长达6个月[9]。本研究将基于一项母婴出生队列,探究产时抗菌药物预防对婴儿肠道菌群多样性、丰度及组成的影响,以期降低产时抗菌药物预防可能产生的健康风险。
1资料与方法
1.1资料来源及研究对象
本研究数据来源于2018年开展的陕西母婴出生队列研究项目,选取了农村地区2018至2019年间出生的65名足月产婴儿,纳入标准:①单胎活产婴儿;②计划在项目合作医院产检及分娩,且产前检查结果完整准确;③自愿配合完成2年随访调查研究,并签署知情同意书。排除标准:母亲孕期确诊慢性疾病并有服药史(糖尿病、高血压等),或患有智力、精神障碍。
1.2样本采集
本研究纳入的65名婴儿均来自同一家医院,分别于出生3日龄内、2月龄、6月龄采集粪便样本,并尽快转移至-20℃冰箱中暂存。随后,定期通过冷链运输,将样本转移至-80℃冰箱中保存,等待进一步分析。
1.3研究方法及内容
1.3.1问卷调查
采用项目组设计并修订且信效度达到要求的孕产妇管理手册、婴儿随访问卷进行相关信息收集。孕妇家庭人口特征、产前检查结果、分娩记录、孕期不良暴露、抗生素暴露等信息记录在《孕产妇管理手册》中;婴儿随访由调查员与家长进行面对面询问,内容包括:婴儿喂养方式、患病情况、抗生素及益生菌使用情况、生长发育评价等,同时收集婴儿粪便样本。
1.3.2 DNA提取及高通量测序
采用粪便基因组提取试剂盒QIAamp Fast DNA stool Mini Kit(天根生化科技有限公司,中国)从样本中(含量均>500mg/个)中提取DNA进行分析。取DNA模板对16S rRNA的V3+V4区域进行扩增,PCR扩增的引物分别为:341F: 5′-CCTAYGGGRBGCASCAG-3′和806R:5′-GGACTACNNGGGTATCTAAT-3′[10]。然后采用Hiseq 2500平台进行测序,原始数据(包含reads数及相应序列质量)通过数据拼接、质控过滤等得到最终的扩增子序列变异(amplicon sequence variants,ASV)表格数据。
1.4相关定义
产时抗菌药物预防是指在母亲分娩过程中的任何时候使用抗菌药物[10]。Alpha多样性指群落内部的多样性,是反映物种丰富度和均匀度的综合指标,分别采用Chao1、Shannon和Simpson指数评估样本的Alpha多样性。Beta多样性是不同样品或不同组间样品的微生物群落间物种组成的差异,采用Bray-Curtis距离来评估物种群落的Beta多样性。
1.5统计学及生物信息学分析
所有统计学和生物信息学分析均采用Stata 15.0(Stata Corp.,College Station,TX)和R 4.1.0软件进行。根据文献报道,分娩方式影响婴儿生命早期菌群发育[11-12],故所有结果均按照分娩方式分层展示,即样本分为4组,分别为顺产且产时抗菌药物预防暴露(VDIAP)组(n=7)、顺产且产时抗菌药物预防非暴露(VDno-IAP)组(n=39)、剖宫产且产时抗菌药物预防暴露(CSIAP)组(n=8)、剖宫产且产时抗菌药物预防非暴露(CSno-IAP)组(n=11)。计量资料采用均数±标准差(±s)表示,两组间比较采用t检验、多组间采用方差分析或Kruskal-Wallis秩和检验完成。计数资料采用例数(n)和百分比(%)来表示,两组间比较采用卡方(Chi-square)检验或Fisher精确性检验完成,在R Studio软件中构建“Phyloseq”对象进行生物信息学分析。由于胎便及婴儿粪便样本具有低生物量的特点,我们使用“filter_taxa”函数对ASV表中小于样本10%数量且读数小于2的ASV进行过滤,以排除由于污染、测序错误可能产生的影响。考虑到尽可能保留样本的多样性特征,我们对数据过滤后未进行抽平操作[13],然后分别采用“microbiome”包,“vegan”包计算样本Alpha、Beta多样性。采用广义线性模型分析产时抗菌药物预防与否对婴儿3日龄内、2月龄、6月龄肠道菌群Alpha多样性的影响,并调整混杂因素。采用多元置换方差分析(PERMANOVA)比较微生物群落间Beta多样性。接下来,对主要细菌分类群在门、科水平上进行描述,并比较其相对丰度。此外,我们还采用带有偏向校正的微生物群落组成分析(analysis of compositions of microbiomes with bias correction,ANCOM-BC)(v1.2.2)[14]比较两组间的差异菌群,并采用Holm-Bonferroni方法对结果进行校正。分析中的检验水准为α=0.05,P<0.05即为差异有统计学意义。
2结果
2.1调查人群的基线特征、产时抗菌药物预防及高通量测序情况
本研究共纳入65名足月新生儿,其中男35名,女30名,46人(70.8%)为顺产,15人(23.1%)接受了产时抗菌药物预防。在出生后3日龄内、2月龄、6月龄分别采集到样本65、34、43个,共有142个粪便样本完成检测。产妇接受产时抗菌药物预防的原因包括剖宫产术前预防感染、预防新生儿GBS感染、预防胎膜早破后可能的炎症。抗菌药物包括头孢菌素类、青霉素、硝基咪唑类抗生素,给药方式主要为静脉注射,每日1~5次不等。测序结果显示,142个样本共获得7 673 595对Reads、807个ASV,过滤掉无效Reads及可能的污染后,共有6 887 463对Reads、239个ASV纳入分析。
2.2产时抗菌药物预防暴露与非暴露婴儿在3日龄内的菌群差异
2.2.1物种多样性差异
在婴儿3日龄内,按顺产、剖宫产分层后发现:产时抗菌药物预防暴露组与非暴露组,肠道菌群Alpha多样性差异均无统计学意义(P>0.05)。但非暴露组中,剖宫产婴儿的Simpson多样性明显高于顺产婴儿(P=0.04)。两组间的Beta多样性在调整孕前BMI和婴儿喂养情况后,差异无统计学意义(P>0.05),见图1。

图1 产时抗菌药物预防暴露组与非暴露组婴儿3日龄内肠道菌群Alpha、Beta多样性比较(按分娩方式分层)
2.2.2肠道菌群丰度及组成差异
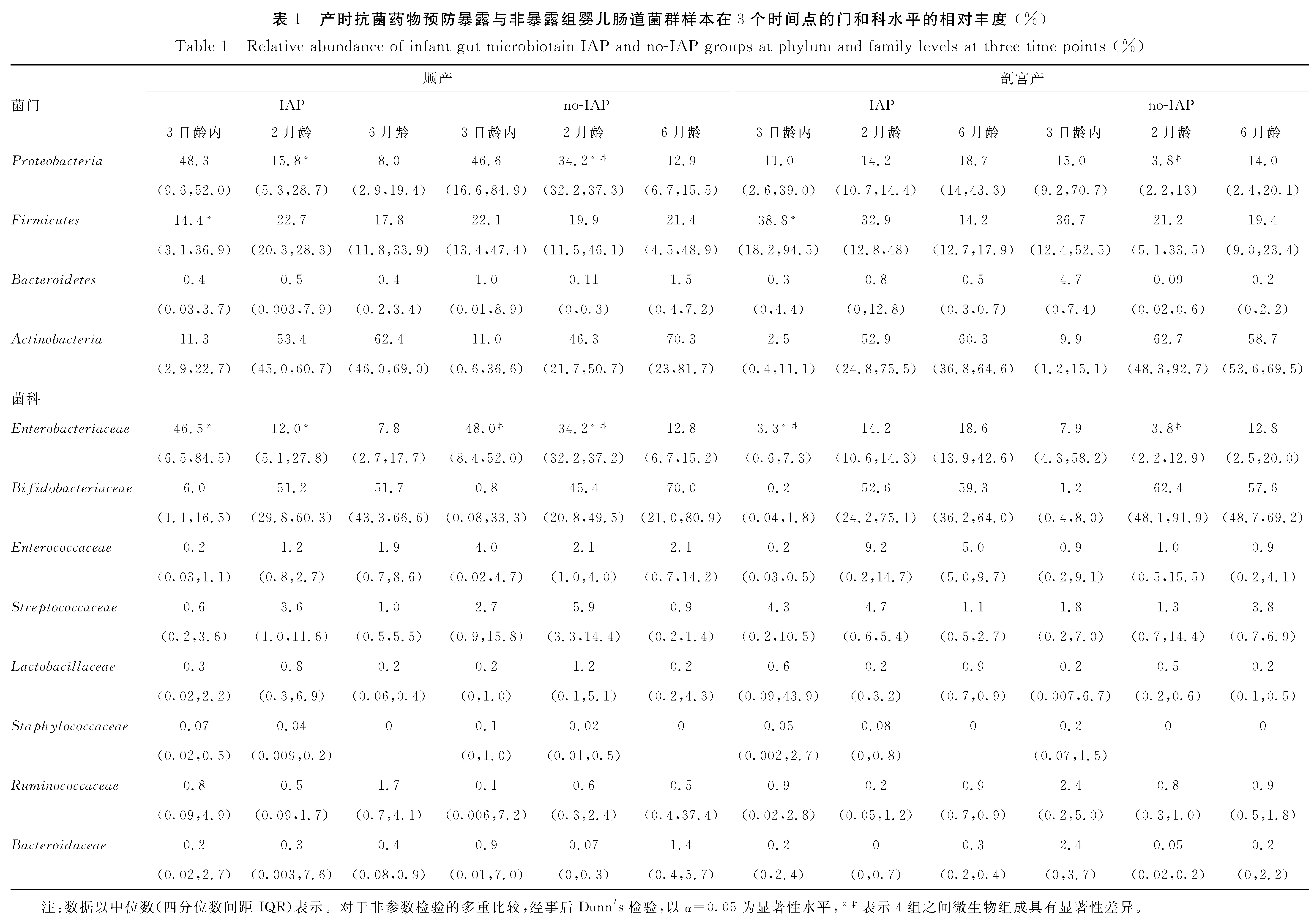
婴儿3日龄内,肠道内主要的4种菌门平均占比92.6%,分别为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria);产时抗菌药物预防暴露组与非暴露组婴儿3日龄内主要细菌门水平差异无统计学意义(P>0.05),见图2A、表1。

图2 产时抗菌药物预防暴露组与非暴露组婴儿3日龄内的肠道菌群在门(A)和科(B)水平的菌群分布情况(按分娩方式分层)
婴儿粪便样本菌群在科水平上的分布情况显示,前8种菌科共占比76.2%,分别为:肠杆菌科(Enterobacteriaceae)、双歧杆菌科(Bifidobacteriaceae)、肠球菌科(Enterococcaceae)、链球菌科(Streptococcaceae)、乳杆菌科(Lactobacillaceae)、葡萄球菌科(Staphylococcaceae)、疣微菌科(Ruminococcaceae)、拟杆菌科(Bacteroidaceae)。产时抗菌药物预防暴露组与非暴露组婴儿3日龄内细菌科水平差异无统计学意义(P>0.05),见图2B、表1。
按分娩方式分层后,Proteobacteria是顺产婴儿的主要菌门(暴露组:48.3%;非暴露组:46.6%),而Firmicutes在剖宫产婴儿样本中占主要地位(暴露组:38.8%;非暴露组:36.7%),Firmicutes的丰度在顺产且产时抗菌药物预防暴露组和剖宫产且产时抗菌药物预防暴露组间差异有统计学意义(P=0.006)。从科水平来看,Enterobacteriaceae丰度在顺产婴儿样本中所占比例较大(暴露组:46.5%;非暴露组:48.0%),顺产且产时抗菌药物预防暴露组和剖宫产且产时抗菌药物预防暴露组间差异有统计学意义(P=0.003)。另外,剖宫产婴儿样本的科种类较多,其他主要菌科在各组间并未见差异有统计学意义(P>0.05)。
2.2.3微生物群落中的差异物种分析
经分娩方式分层后,结果显示:顺产婴儿中,从科水平来看,Eggerthellaceae(beta=-0.82)、Leuconostocaceae(beta=-0.36)、Pasteurellaceae(beta=-0.28)、Xanthobacteraceae(beta=-0.25)、Lachnospiraceae(beta=-0.08)、Atopobiaceae(beta=-0.05)在产时抗菌药物预防暴露组中丰度更高;而Acidaminococcaceae(beta=0.63)、Family_XI(beta=0.58)、Caulobacteraceae(beta=0.44)则在产时抗菌药物预防非暴露组更高。剖宫产婴儿中,产时抗菌药物预防暴露组丰度显著增加的差异菌科为Lactobacillaceae(beta=-3.34)、Carnobacteriaceae(beta=-0.43)、Family_XI(beta=-0.38)、Eggerthellaceae(beta=-0.38)、Moraxellaceae(beta=-0.26)、Propionibacteriaceae(beta=-0.26),而Tannerellaceae(beta=1.43)、Desulfovibrionaceae(beta=1.16)、Eubacteriaceae(beta=1.1)等差异菌科在产时抗菌药物预防非暴露组中丰度明显更高,见图3。

注:采用ANCOM-BC模型绘制瀑布图来表示组间具有差异的科水平菌群,图中表示出生后顺产(A图)和剖宫产(B图)分别接受IAP和未接受IAP的样本beta值(对数折叠变化表示)。
2.3产时抗菌药物预防暴露与非暴露婴儿在2月龄和6月龄的菌群差异
2.3.1物种多样性差异
由表2可知,调整喂养、出生后抗生素和益生菌暴露等因素的影响后,未观察到产时抗菌药物预防对2月龄婴儿样本Alpha多样性的影响,但剖宫产且产时抗菌药物预防非暴露组的Simpson指数与参照组差异有统计学意义(P=0.026),即分娩方式在2月龄时对婴儿肠道菌群可能仍存在影响。此外,喂养因素也会影响婴儿菌群的Chao1指数(P=0.020)。
在6月龄时,未观察到产时抗菌药物预防对Alpha多样性3个指数的影响。但益生菌补充会对婴儿6月龄时肠道菌群多样性造成影响(Chao1指数:P=0.006;Shannon指数:P=0.008;Simpson指数:P=0.035)。
采用Bray-Curtis距离来评估2月龄和6月龄时婴儿肠道菌群的Beta多样性,在调整了喂养情况、抗生素、益生菌等因素后,未观察到产时抗菌药物预防对Beta多样性的影响。
2.3.2肠道菌群丰度及组成差异
2月龄时,各组样本的优势菌门均为Actinoba-cteria。按分娩方式分层后,顺产婴儿Proteobacteria的相对丰度在产时抗菌药物预防非暴露组更高(P=0.017)。此外,产时抗菌药物预防非暴露组中顺产婴儿Pr0oteobacteria相对丰度更高(P=0.001)。在科水平上,按分娩方式分层后,顺产婴儿中,产时抗菌药物预防非暴露组的Enterobacteriaceae相对丰度更高(P=0.015)。此外,产时抗菌药物预防非暴露组中顺产婴儿Enterobacteriaceae的相对丰度更高(P=0.001)。在6月龄时,各组肠道菌群的优势菌门依然为Actinobacteria,各组间在门水平、科水平上的相对丰度差异逐渐变小,未观察到各组间菌群相对丰度的显著性差异,见表2。

3讨论
婴儿肠道菌群在生命早期表现出高度的个性化和时间特异性,并持续受到外界因素的影响[15]。我们在这项前瞻性母婴队列研究中发现,经分娩方式分层后,产时抗菌药物预防对婴儿生命早期肠道菌群多样性影响不明显,但会影响菌群组成,随着菌群定植和演化,其影响逐渐减小。
3.1产时抗菌药物预防对婴儿肠道菌群多样性的影响
在临床实践中,产时抗菌药物预防可能会增加婴儿肠道菌群微生态失衡的风险。Chen等人[16]的研究证实母亲接受产时抗菌药物预防会降低婴儿肠道菌群的丰富度,并在顺产且产时抗菌药物预防暴露组观察到婴儿样本Alpha多样性更低。另外,Sugino等[17]人的研究表明,分娩方式和产时抗菌药物预防可能会影响婴儿肠道菌群的Beta多样性,且在婴儿3月龄时,产时抗菌药物预防暴露的顺产婴儿与非暴露组的Beta多样性存在显著性差异。在本研究中,我们在3日龄内和2月龄婴儿粪便样本中均观察到了顺产且产时抗菌药物预防非暴露组和剖宫产且产时抗菌药物预防非暴露组Simpson指数的显著性差异,提示分娩方式可能是菌群Alpha多样性的主要影响因素,而产时抗菌药物预防对Alpha多样性影响并不明显。此外,我们调整混杂因素后发现产时抗菌药物预防对婴儿3个时间点的Beta多样性影响并不显著。
3.2产时抗菌药物预防对婴儿肠道菌群丰度及组成的影响
既往研究表明,产时抗菌药物预防会降低婴儿菌群中拟杆菌门[9,18-19](Bacteroidetes)的相对丰度,并增加变形菌门[18](Proteobacteria)和厚壁菌门[9](Firmicutes)的相对丰度。在本研究中,经分娩方式分层后,我们并未在婴儿3日龄内粪便样本中观察到主要菌门在产时抗菌药物预防暴露组和非暴露组间的差异,但观察到分娩方式会影响Firmicutes的丰度。在2月龄的顺产婴儿中,Proteobacteria的相对丰度在产时抗菌药物预防暴露组与非暴露组有显著差异,但在6月龄时4种主要菌门在各组间均无显著性差异。在菌科水平,我们观察到2月龄顺产婴儿的Enterobacteriaceae相对丰度在产时抗菌药物预防暴露组较非暴露组更低,这与先前的研究结论略有差异[20]。
对3日龄内样本进行的差异物种分析显示,经分娩方式分层后,产时抗菌药物预防的使用均会增加Eggerthellaceae的丰度,Leuconostocaceae、Lachnospiraceae仅在顺产且产时抗菌药物预防暴露婴儿的样本中增加,而Lactobacillaceae、Carnobacteriaceae和Propionibacteriaceae仅在剖宫产且产时抗菌药物预防暴露婴儿的样本中增加。有研究证实,Eggerthellaceae是一个新兴的菌科,它与胃肠道和泌尿生殖系统疾病有关,该菌科的某些特征使它们能够将病原体传播到血液中[21]。Leuconostocaceae、Lachnospiraceae均与婴儿腹泻相关[22-23],而Carnobacteriaceae和Propionibacteriaceae也与儿童疾病有关[24-25],提示不论分娩方式如何,产时抗菌药物预防通过影响菌科丰度可能增加婴儿的患病风险。本研究的局限性在于只分析了产时抗菌药物预防对婴儿3日龄内、2月龄、6月龄这3个时间点的样本影响,无法连续且准确地描述婴儿肠道菌群的动态演化过程。从描述性结果来看,部分结果与现有的研究报告并不完全一致,可能是由于预期的菌群变化没有在3日龄内快速表现出来或受样本数量限制,但本次分析仍能够提出菌群变化的主要特点。此外,还有报道发现,母乳喂养可以改善因产前抗生素暴露引起的菌群失调[19],但囿于样本数量限制,本研究并未进一步分析。因此未来的研究不仅要扩大样本量,还要结合婴儿肠道菌群发育的特定时间节点进行综合分析,明确产时抗菌药物预防对肠道菌群演化过程的综合影响。
生命早期是婴儿肠道菌群定植和成熟的关键时期,由于其具有高度的敏感性和可变性,母亲产时抗菌药物预防可能会对婴儿菌群的演化过程产生重要影响。本研究发现了产时抗菌药物预防会影响婴儿6月龄内菌群的组成结构,可能产生潜在的健康风险。在未来研究中,可以基于更大样本量,并采用更精确的方法,结合纵向研究特点描绘出早期婴儿肠道菌群的发育轨迹,对促进婴儿肠道菌群健康提供更有力的线索。
