胰岛素调控丝氨酸/苏氨酸蛋白激酶-1信号通路对急性肺损伤小鼠肺水肿的清除作用
2023-07-30邓欣雨罗晓庆童瑾王导新邓旺
邓欣雨,罗晓庆,童瑾,王导新,邓旺
重庆医科大学附属第二医院呼吸内科,重庆400010
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是危及生命的临床危重症,病死率高于40%[1]。近年来的研究表明,改善ALI/ARDS 预后的重要途径之一是清除肺泡腔内过多的水肿液和修复肺上皮组织[2]。前期本课题组初步研究了胰岛素对ALI/ARDS肺水肿液清除的影响,但具体分子机制仍未阐明[3]。本研究通过建立大鼠ALI模型,观察胰岛素减轻肺水肿液的作用,并探讨可能的信号通路。
1 材料与方法
1.1实验动物 32 只SPF 级C3H/HeN 小鼠,雄性,7 ~9周龄,体质量20 ~24 g,购自重庆医科大学动物实验中心,动物生产许可证号:SCXK(渝)2017-0001,在无菌环境下喂养,温度:(22 ± 1)°C ,湿度:(70 ±10)%,动物使用许可证号:SYXK(渝)2017-0023。本实验小鼠均以科研为目的进行养殖和使用,且按照动物伦理相关规定进行(2019-019)。
1.2主要试剂 脂多糖(lipopolysaccharide,LPS,O111∶B4)和戊巴比妥购自美国Sigma 公司;重组人胰岛素购自美国EliLilly 公司;SGK1 小干扰RNA(small interfering RNA,siRNA)由上海Gene Pharma公司设计及合成;蛋白检测试剂盒和蛋白提取试剂盒购自南京凯基生物科技发展有限公司;异硫氰酸荧光素-共轭右旋糖酐4000(FD4)购自美国Sigma 公司;原位细胞死亡检测试剂盒购自美国罗氏公司;兔抗小鼠α1-钠/钾ATP酶(α1-Na+,K+-ATPase)单抗购自美国Millipore公司;兔抗小鼠肺泡上皮钠通道α亚基(α-epithelial sodium channel,α-ENaC)、丝氨酸/苏氨酸蛋白激酶-1(serine/threonine-protein-1,SGK1)、phosphorylated-SGK1(Ser422)单抗及山羊抗兔β-肌动蛋白(β-actin)抗体购自美国Santa Cruz公司。
1.3ALI模型的建立 小鼠予以戊巴比妥50 mg/kg腹腔注射麻醉后,逐层分离暴露右侧颈静脉,置管后按5 mg/kg注入LPS,通过血气分析判断ALI模型是否成功建立。
1.4动物分组及给药 将32只C3H/HeN 小鼠随机分为对照组、ALI 组、治疗组和SGK1 siRNA 组,每组8 只。治疗组在建立ALI 模型后,持续经颈静脉泵入胰岛素0.1 U/(kg·h);SGK1 siRNA 组在持续泵入胰岛素0.1 U/(kg·h)的同时,将SGK1 siRNA 通过移液管直接导入小鼠喉咙(75 µg SGK1 siRNA 稀释于100 µL 生理盐水中),立即闭合小鼠气道。对照组、ALI组、治疗组给予等量的空白siRNA。ALI组建模后持续泵入等量的生理盐水,对照组仅泵入等量的生理盐水。8 h后处死小鼠,进行各项检测。
1.5动脉血气及血糖水平的检测 模型建立1 h 后,经小鼠左侧股动脉抽血0.3 mL,进行行血气分析,血糖监测仪检测不同时间点(0、1、4、8 h)血糖的变化。
1.6支气管肺泡灌洗液(bronchoalveolar lavage fluid,
BALF)中蛋白含量的检测 暴露小鼠胸腔,用腰麻导管做气管置管,1 mL生理盐水灌洗右肺,重复3次,回收率达90%以上。回收的灌洗液于4 ℃,13 000×g离心30 min,取上清液,-80 ℃保存。使用蛋白检测试剂盒检测BALF中的总蛋白含量。
1.7肺泡上皮通透性分析 小鼠经颈静脉注射FD4,10 mg/kg,50 min 后给予1 mL 生理盐水灌洗肺组织3 次,收集BALF 和血清,11 000 ×g离心5 min,使用分光光度计测定BALF和血清中FD4的浓度,计算其比值,作为支气管肺泡上皮通透性的指标。
1.8肺水含量分析 取小鼠左肺上叶,称湿重后置于80 ℃烤箱中烘烤48 h,再称干重,计算肺湿重与干重比,作为肺水含量指标。
1.9肺组织病理变化检测 取小鼠左肺下叶组织,置于10%福尔马林溶液中固定24 h,石蜡包埋切片,苏木素-伊红(HE)染色10 min,光学显微镜观察肺组织病理学改变。
1.10肺上皮细胞凋亡检测 小鼠肺组织常规脱水后,石蜡包埋切片,厚5 µm,切片经脱腊水化后,采用原位细胞死亡检测试剂盒检测切片中肺上皮细胞凋亡情况。显微镜下观察,褐色染色为凋亡细胞。观察3 个高倍视野,每个视野计数100 个细胞,计算每个视野中凋亡细胞数。
1.11肺组织中α-ENaC和α1-Na+,K+-ATPase表达及SGK1 磷酸化水平的检测 采用Western blot 法。采用蛋白提取试剂盒提取小鼠肺组织蛋白,经10%SDS-PAGE分离后,转移至硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h;分别加入兔抗小鼠α-ENaC(1∶300 稀释)、α1-Na+,K+-ATPase(1∶500 稀释)、SGK1(1∶500 稀释)、phosphorylated-SGK1(1∶500 稀释)抗体和山羊抗兔β-actin抗体(1∶2 500稀释),4 ℃孵育过夜;用TBST 洗膜3 次,加入HRP 标记的羊抗兔IgG(1∶5 000 稀释),室温孵育1.5 h;ECL 显色。凝胶成像系统扫描,Quantity One 软件分析目的条带吸光度值,以目的条带与β-actin 比值作为目的蛋白的相对表达量。
1.12统计学分析 应用SPSS 16.0 软件处理数据,所有计量数据均以均数± 标准差(± s)表示,组间比较采用单因素方差分析(ANOVA)或Student's-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1不同时间点血糖变化情况及血气分析 泵入胰岛素后0、1、4、8 h,ALI 与治疗组小鼠血糖水平差异均无统计学意义(P均>0.05),见表1。对照、ALI和治疗组小鼠动脉血氧分压分别为(11.548 ± 0.93)、(5.52±0.72)和(8.52±1.21)kPa,与对照组比较,ALI 组显著降低(t=14.5,P<0.000 1);与ALI 组比较,治疗组得到改善(t=6.026,P<0.000 1)。
表1 两组小鼠不同时间点血糖变化情况(mmol/L,± s,n=8)Tab.1 Plasma glucose level changes at different time points of mice in two groups(mmol/L,x±s,n=8)

表1 两组小鼠不同时间点血糖变化情况(mmol/L,± s,n=8)Tab.1 Plasma glucose level changes at different time points of mice in two groups(mmol/L,x±s,n=8)
?
2.2BALF中蛋白含量变化 与对照组比较,ALI组小鼠BALF中蛋白含量显著增加(t=16.8,P<0.000 1);与ALI 组比较,治疗组蛋白含量显著降低(t=7.39,P<0.000 1);与治疗组比较,SGK1 siRNA 组蛋白含量显著升高(t=5.694,P=0.000 2)。见表2。

表2 各组小鼠BALF中蛋白含量、肺泡上皮通透性及肺水含量(x±s,n=8)Tab.2 Protein content in BALF,alveolar epithelial permeability and lung water content in mice of each group(x±s,n=8)
2.3肺泡上皮通透性 与对照组比较,ALI组小鼠肺泡上皮通透性显著增加(t=11.93,P<0.000 1);与ALI 组比较,治疗组肺泡上皮通透性显著降低(t=5.286,P=0.000 4);与治疗组比较,SGK1 siRNA 组肺泡上皮通透性显著升高(t=3.449,P=0.006 2)。见表2。
2.4肺水含量 与对照组比较,ALI 组小鼠肺水含量显著增加(t=11.31,P<0.000 1);与ALI组比较,治疗组肺水含量显著降低(t=5.651,P=0.000 2);与治疗组比较,SGK1 siRNA 组肺水含量显著升高(t=3.148,P=0.010 4)。见表2。
2.5肺组织病理学变化 对照组小鼠肺组织肺泡结构完整,肺组织未见明显炎症细胞浸润,肺泡及间质未见明显水肿及透明膜形成;与对照组比较,ALI 组可见肺泡及间质水肿,炎症细胞浸润,肺泡塌陷,透明膜形成;与ALI组比较,治疗组肺泡及间质水肿减轻,炎症细胞浸润减少,未见透明膜,肺损伤明显减轻;与治疗组比较,SGK1 siRNA 干预阻断了胰岛素减轻肺水肿的作用,肺泡及间质水肿明显,炎症性细胞浸润增加,肺泡结构破坏加重,透明膜形成。见图1。

图1 各组小鼠肺组织病理学观察(HE染色,×100)Fig.1 Lunghistopathologyofmiceineachgroup(HEstaining,×100)
2.6肺上皮细胞凋亡情况与对照组比较,ALI组小鼠肺上皮细胞凋亡数显著增加(t=5.748,P<0.000 2);与ALI组比较,治疗组肺上皮细胞凋亡数显著降低(t=3.312,P=0.007 8);与治疗组比较,SGK1 siRNA 组肺上皮细胞凋亡数显著增加(t=3.520,P=0.016 9)。见图2和图3。

图2 各组小鼠肺上皮细胞凋亡观察(×400)Fig.2 Apoptosis of lung epithelial cells of mice in each group(×400)

图3 各组小鼠肺上皮细胞凋亡数Fig.3 Apoptosis number of lung epithelial cells of mice in each group
2.7肺组织α-ENaC 和α1-Na+,K+-ATPase的表达 与对照组比较,ALI 组小鼠肺组织中α-ENaC 和α1-Na+,K+-ATPase的表达显著降低(t分别为6.041和2.226,P分别为<0.000 1和0.043);与ALI组比较,治疗组α-ENaC 和α1-Na+,K+-ATPase 的表达显著增加(t分别为26和18.67,P均<0.000 1);与治疗组比较,SGK1 siRNA 组α-ENaC 和α1-Na+,K+-ATPase 的表达显著降低(t分别为13 和9.874,P均<0.000 1)。见图4 和图5。
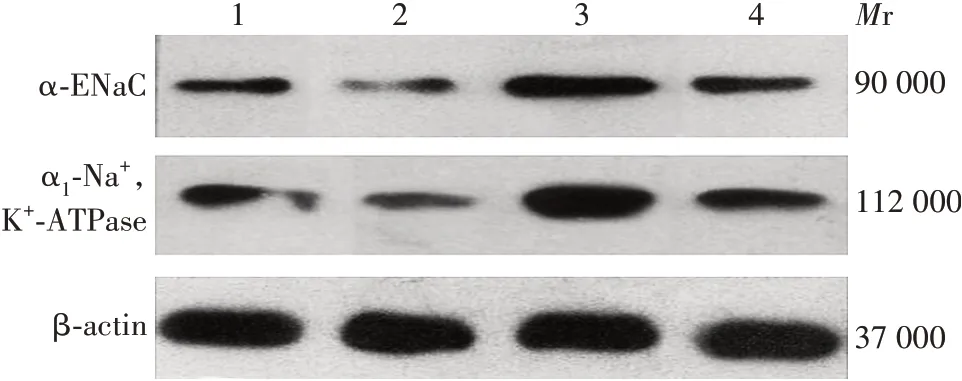
图4 Western blot 法检测小鼠肺组织肺泡上皮钠通道(ENaC)的表达Fig.4 Detection of expression of alveolar epithelial sodium channel(ENaC)in mice by Western blot

图5 各组小鼠肺组织肺泡上皮钠通道(ENaC)的表达Fig.5 Expression of alveolar epithelial sodium channel(ENaC)in mice of each group
2.8肺组织SGK1 磷酸化水平 与对照组比较,ALI组小鼠肺组织SGK1磷酸化水平显著降低(t=1.666,P=0.023 7);与ALI 组比较,治疗组SGK1 磷酸化水平显著增加(t=8.547,P=0.000 1);与治疗组比较,SGK1 siRNA组SGK1磷酸化水平显著降低(t=7.741,P=0.001 5)。见图6和图7。

图6 Western blot法检测小鼠肺组织SGK1磷酸化水平Fig.6 Detection of SGK1 phosphorylation level in lung tissue of mice by Western blot

图7 各组小鼠肺组织SGK1磷酸化水平Fig.7 SGK1 phosphorylation level in lung tissue of mice in each group
3 讨论
ALI/ARDS重要的病理生理特征是肺泡上皮细胞损伤及过多的富含蛋白的水肿液聚集在肺泡腔内导致严重的低氧血症和急性呼吸衰竭[4]。有效清除ALI/ARDS 肺泡腔内过多的水肿液,维持肺泡腔相对干燥,是治疗和决定疾病预后的关键[5-6]。在ICU的重症患者中,强化胰岛素治疗能够有效保护患者心脏、肺、脑部等重要器官,显著降低ICU住院时间及病死率[7-8]。本研究在建立小鼠ALI 模型的同时,持续泵入的胰岛素剂量未引起血糖的显著变化,这是由于高血糖会进一步促进炎症反应,加重肺损伤,而维持正常血糖情况下的胰岛素治疗能有效减轻肺损伤[9]。
LPS 诱导的Toll 样受体4(Toll-like receptor 4,TLR4)活化导致TLR4 单体二聚化,产生NF-κB 转录因子。大量的促炎症因子如肿瘤坏死因子和白细胞介素-6 等均具有NF-κB 效应的启动位点,导致LPS通过TLR4和NF-κB 通路激活释放炎症介质,使肺泡毛细血管屏障渗漏,引起间质及肺泡水肿,与ALI/ARDS表现相似[10-11]。本研究中ALI组小鼠动脉血氧分压显著下降,肺泡及间质水肿,肺上皮细胞凋亡,炎症细胞浸润,肺泡结构破坏,透明膜形成,符合ALI/ARDS病理改变。给予胰岛素后,小鼠动脉氧合显著改善,肺上皮细胞凋亡较少,肺损伤减轻。
肺上皮细胞是维持肺泡腔内气体交换和限制肺泡内液体渗出的重要屏障。其中,肺上皮细胞凋亡也被认为是ALI 病理生理发展过程中的重要机制之一[13]。
肺上皮细胞的加速凋亡会进一步促进肺泡上皮屏障的损伤,肺泡腔内过多富含蛋白的水肿液聚集和肺泡液体清除能力的下降[14]。本研究ALI组BALF中蛋白含量、肺水含量及肺泡上皮通透性均显著增加,肺上皮细胞凋亡明显,提示ALI 小鼠模型肺泡上皮屏障损伤,肺血管通透性增加,肺水肿明显。同时,胰岛素治疗后,肺泡上皮屏障损伤及肺水肿显著减轻,而经SGK1 siRNA干预后,明显抑制了胰岛素引起的肺保护效应,提示胰岛素可能通过SGK1减轻了LPS诱导的肺损伤,有效保护了肺组织。
肺泡腔内液体清除是由位于肺泡上皮细胞顶膜的ENaC 和位于细胞底膜的Na+,K+-ATPase共同完成钠水转运过程,其中,α-ENaC和α1-Na+,K+-ATPase是发挥肺水肿液清除的关键通道蛋白[4,15]。SGK1是一种丝氨酸/苏氨酸蛋白激酶,被认为是上皮细胞中钠水转运的关键调节因子[16]。本研究ALI组α-ENaC和α1-Na+,K+-ATPase表达显著降低;给予胰岛素治疗后,α-ENaC和α1-Na+,K+-ATPase表达显著增加;经SGK1 siRNA 干预后,胰岛素效应受到抑制。同时,胰岛素显著提高了SGK1磷酸化水平,而经SGK1 siRNA干预后,SGK1 磷酸化水平降低,进一步证明胰岛素减轻ALI 肺水肿的机制是通过SGK1 上调α-ENaC 和α1-Na+,K+-ATPase的表达实现的,有助于肺泡腔内水肿液减轻,改善氧合,是在前期研究基础上的补充和深入。
综上所述,ALI 小鼠经外源性胰岛素治疗后,能有效减轻肺水肿,其机制可能是通过SGK1上调α-ENaC和α1-Na+,K+-ATPase 的表达实现的。该信号通路的作用有待于体外实验进一步验证。
