DIO1 抑制喉鳞状细胞癌侵袭转移的机制研究
2023-07-30刘金婧徐海铭刘明波
任 楠 刘金婧 徐海铭 赵 凯 刘明波
1.解放军总医院耳鼻咽喉头颈外科医学部,北京 100853;2.解放军总医院海南医院耳鼻咽喉头颈外科,海南三亚 572013
喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是喉部最常见的恶性肿瘤[1],位于头颈部恶性肿瘤的第三位[2]。LSCC 的局部复发和转移[3-4],使多数患者的预后较差[5]。因此,在分子水平上探索调控LSCC 侵袭转移中的关键因子,对LSCC 的早期诊断及治疗起着重要作用。课题组前期工作中,应用TCGA 数据库构建了LSCC 的ceRNA 网络,通过生存分析发现2 个与预后相关的mRNA [碘甲原氨酸脱碘酶Ⅰ(deiodinase iodothyronine type Ⅰ,DIO1)和STC2][6]。DIO1 属于脱碘酶硒蛋白家族[7-8],其可调节活化甲状腺激素的生物利用度[9-12],控制细胞增殖、分化和代谢[13-15]。本研究探讨TU686 细胞系中DIO1 的表达,及对LSCC 增殖、迁移、侵袭的作用。
1 材料与方法
1.1 细胞
人喉鳞状细胞癌TU686 细胞系由解放军总医院海南医院耳鼻咽喉头颈外科课题组传代培养。
1.2 实验试剂和仪器
转染试剂LipofectamineTM2000(Invitrogen,批号:15596026);PCDNA3.1 质粒表达载体(上海吉凯基因医学科技股份有限公司,批号:GOSA0355591-1);CCK-8试剂盒(Beyotime,货号:C0040);E-cadherin、N-cadherin、Vimentin、S6K1、4EBP1、Akt 抗体(Abcam,货号:ab227639、ab207608、ab137321、ab131440、ab2606、ab18785)。低温离心机(Sigma,型号:3-18K);实时荧光定量PCR 仪(Applied Biosystems,型号:StepOne)。
1.3 实验方法
1.3.1 细胞培养、转染及分组 将细胞接种至含有10%胎牛血清和青-链霉素双抗的DMEM 培养基中培养,细胞密度达到80%~90%时进行传代或后续实验。TU686 细胞接种至培养皿中,密度达到80%时进行转染。使用培养基稀释DIO1 质粒、转染试剂混合,后将复合物加入培养皿中,轻轻混匀。转染1 d 后细胞传代进行后续实验。将正常TU686 细胞设为对照组,转染后的TU686 细胞为DIO1 过表达组,根据过表达量继续分为DIO1-1 μg 组、DIO1-2 μg 组。
1.3.2 RT-qPCR 验证DIO1 的表达 提取各组细胞总RNA,RT-qPCR 将DIO1 逆转录为cDNA 并扩增,设置3 个复孔(GAPDH 为内参)。反应条件:95℃预变性1 min,共1 个循环;变性95℃20 s,退火60℃20 s,延伸72℃30 s,共40 个循环。反应体系共20 μl:cDNA 2 μl,master mix 10 μl,正向引物1 μl,反向引物1 μl,ddH2O 6 μl。反应完成后,采用2-△△Ct法计算DIO1 的表达量。引物序列见表1。
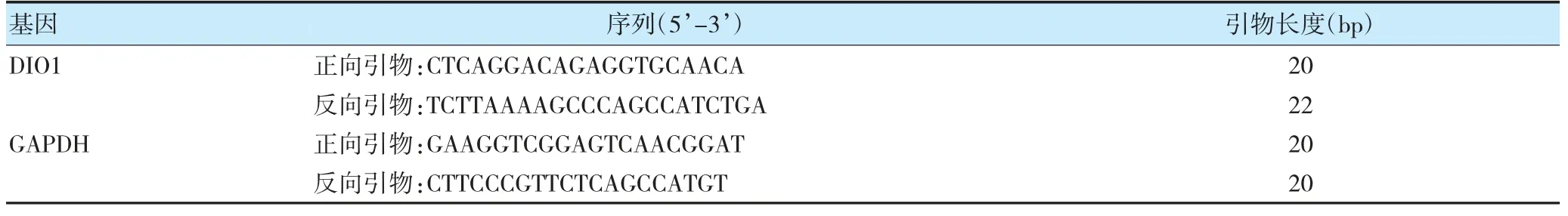
表1 引物序列
1.3.3 Western blot 检测DIO1、E-cadherin、Ncadherin、Vimentin、p-S6K1、S6K1、p-4EBP1、4EBP1、p-Akt、Akt 的表达 收集各组细胞,每组均设3 个复孔,裂解细胞提取蛋白;SDS-PAGE 法分离蛋白质、转膜,封闭洗膜。一抗浓度为1∶1 000,4℃孵育过夜;二抗浓度为1∶2 000,室温孵育;ECL 法显色(GAPDH 为内参)。
1.3.4 CCK-8 实验检测细胞增殖能力 将各组细胞接种于96 孔板中,每组均设3 个复孔,贴壁后加入CCK-8溶液。酶标仪测定第24、48、72 h 的450 nm 波长的光密度(optical density,OD)值,绘制细胞生长曲线。
1.3.5 PI/DAPI 染色检测细胞凋亡情况 将各组细胞培养皿用PBS 漂洗,每组均设3 个复孔,DAPI/PI 液室温染色,封片剂封片,进行荧光显微镜观察。
1.3.6 划痕实验检测细胞迁移能力 将各组细胞接种至6 孔板中,每组均设3 个复孔,待细胞密度达到80%以上时,用枪头在孔中划出直线,间隔24 h 后观察细胞分布并拍照。
1.3.7 Transwell 实验检测细胞迁移及侵袭能力 将各组细胞接种至Transwell 上室,每组均设3 个复孔,培养后使用甲醛固定,Giemsa 染色,擦去上室中的细胞,显微镜观察下室层面的细胞,拍照,计数。侵袭能力:小室经基质胶预处理,其他方法同上。
1.3.8 基因富集情况 分析DIO1-1 μg 组、DIO1-2 μg组上皮间质转化(epithelial-mesenchymal transition,EMT)及mTORC1 信号通路相关基因的差异表达情况,得到受DIO1 表达影响的相关基因,并进行基因探针富集分析,检测相关基因集的富集情况。
1.4 统计学方法
采用R 14.2.1 统计学软件进行数据分析。计量资料用均数±标准差()表示,组间比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 转染后TU686 细胞的DIO1 表达
DIO1 过表达组DIO1 mRNA、蛋白水平高于对照组(P<0.01)。见图1。
2.2 转染后TU686 细胞的生存能力
24、48、72 h,DIO1 过表达组OD 值低于对照组(P<0.01);DIO1 过表达组PI 染色阳性比例高于对照组(P<0.01)。见图2。
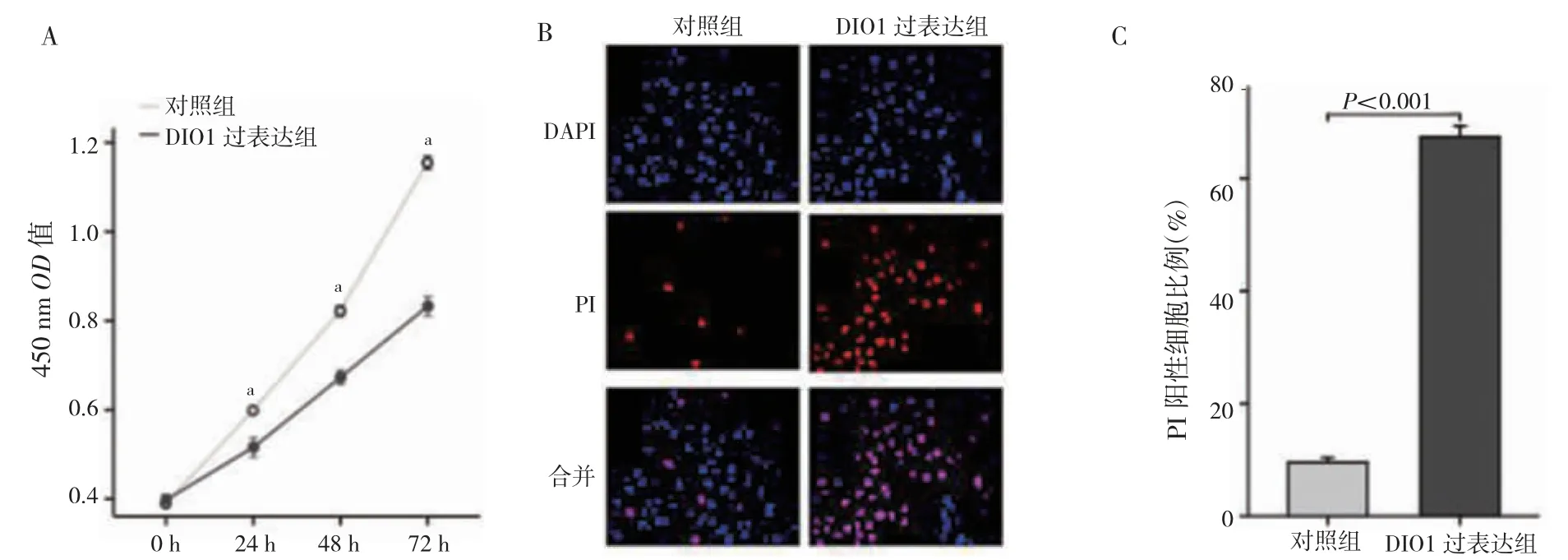
图2 转染后TU686 细胞的生存能力
2.3 转染后TU686 细胞的迁移能力
DIO1 过表达组相对迁移距离短于对照组(P<0.01)。见图3。

图3 转染后TU686 细胞的迁移能力
2.4 转染后TU686 细胞的迁移及侵袭能力
DIO1 过表达组迁移及侵袭能力低于对照组(P<0.01)。见图4。

图4 转染后TU686 细胞的迁移及侵袭能力
2.5 转染后TU686 细胞EMT 进程的变化
NES<0 即DIO1 的表达与EMT 相关基因集的表达呈负相关。DIO1-1 μg 组、DIO1-2 μg 组E-cadherin高于对照组,N-cadherin、Vimentin 低于对照组(P<0.01)。见图5。
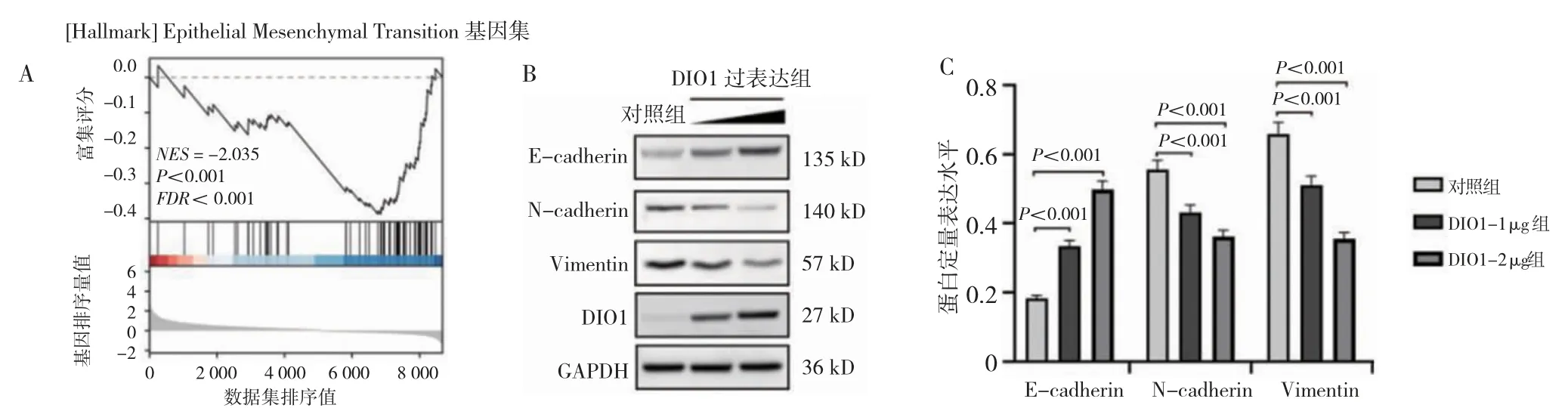
图5 转染后TU686 细胞EMT 进程的变化
2.6 转染后TU686 细胞mTORC1 信号通路的变化
NES<0 即DIO1 的表达与mTORC1 信号通路相关基因集的表达呈负相关。DIO1-1 μg 组、DIO1-2 μg 组p-S6K1 和p-4EBP1 低于对照组(P<0.01)。DIO1-1 μg组、DIO1-2 μg 组与对照组p-Akt 比较,差异无统计学意义(P>0.05)。见图6。
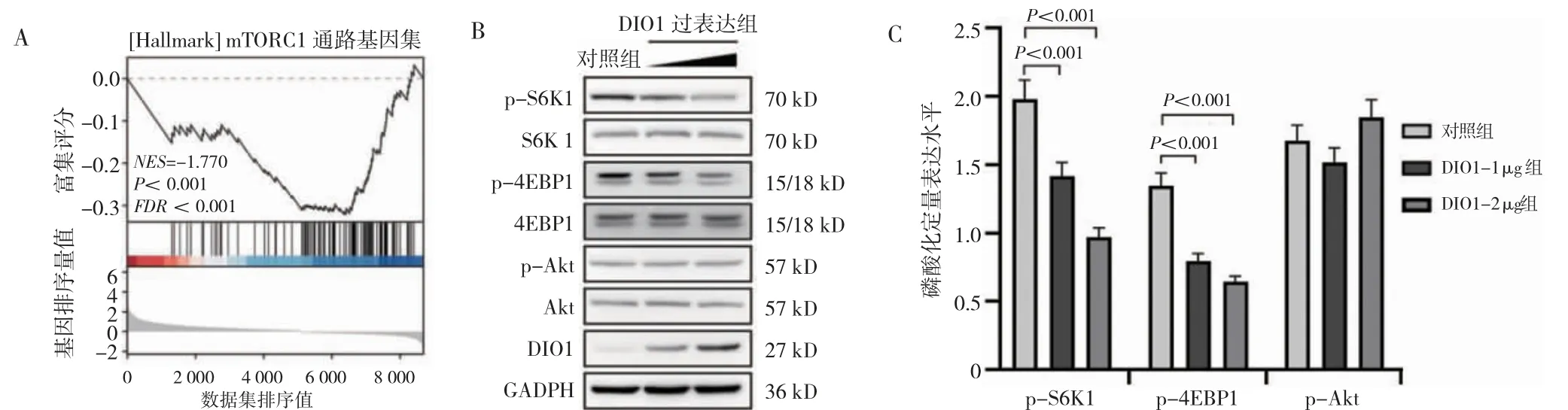
图6 转染后TU686 细胞mTORC1 信号通路的变化
3 讨论
目前,虽然手术是LSCC 的主要治疗方式[16-18],但是发现新靶点及预后分子对LSCC 的研究至关重要[19-23]。本研究构建稳定过表达DIO1 的TU686 细胞系发现,DIO1 可以抑制肿瘤细胞的生存、迁移及侵袭能力及EMT。GESA 分析发现,mTORC1 信号通路与DIO1 呈负相关,且mTORC1 底物在转染后细胞呈现低表达,且mTORC1 信号通路可以调控EMT 的进程[24-25],提示在LSCC 中,DIO1 可能是通过mTORC1 信号通路调节EMT 的进程。
综上所述,DIO1 可以抑制LSCC 的增殖、侵袭及转移,作为抑癌基因在LSCC 侵袭转移过程中起着关键作用,为LSCC 发生发展中的机制提供了新方向。
