异源三倍体榆树叶片形态及光合特性
2023-07-25闫晓丽王书柔丁新宇刘兴菊梁海永
闫晓丽 王书柔 丁新宇 刘兴菊 梁海永
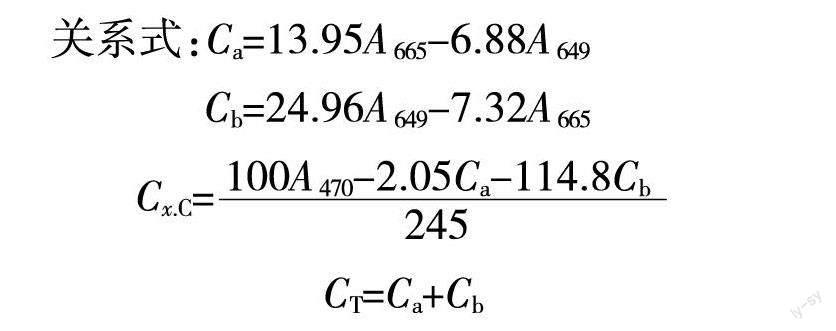

摘要: 杂交与多倍化是物种进化与多样化的主要途径。本研究以二倍体大果榆与四倍体白榆杂交获得的榆树异源三倍体后代及其亲本为材料,比较榆树异源三倍体在表型性状与亲本之间的差异,并对其光合特性进行分析。结果表明,榆树异源三倍体叶面积小于母本二倍体大果榆,与父本四倍体白榆不存在明显差异,而其综合叶片形态特征遗传特性更为偏向于母本;榆树异源三倍体气孔大小显著高于母本二倍体大果榆,与父本四倍体白榆无显著差异;叶片厚度榆树异源三倍体较父母本薄。叶绿素含量与叶绿素a/b比值与父本四倍体白榆无显著差异,但显著高于母本二倍体大果榆。叶片净光合速率显著高于母本二倍体大果榆,与父本四倍体白榆无显著差异。
关键词: 榆树; 异源三倍体; 表型性状
中图分类号: S 722. 3 + 4 文献标识码: B 文章编号:1001 - 9499(2023)04 - 0001 - 05
Leaf Morphology and Photosynthetic Characteristics of Allotriploid Elm
YAN Xiaoli1 WANG Shurou1 DING Xinyu1LIU Xingju1 LIANG Haiyong1 , 2**
(1. College of Forestry, Hebei Agricultural University, Hebei Baoding 071000; 2. Key Laboratory of Germplasm Resources and Forest Conservation, Hebei Province, Hebei Baoding 071000)
Abstract Hybridization and polyploidization are the main ways of species evolution and diversity. In this study, the allotriploid progeny of elm and its parent obtained from the cross between Ulmus macrocarpa and tetraploid Ulmus pumila were used as materials to compare the differences between phenotypic traits and parents of the allotriploid elm, and analyse its photosynthetic properties. The results showed that the leaf area of allotriploid elm was smaller than that of diploid U. pumila, and there was no significant difference between allotriploid elm and tetraploid U. pumila, but the genetic characteristics of its comprehensive leaf morphological characteristics were more inclined to the female parent; The stomatal size of allotriploid of elm was significantly higher than that of diploid U. macrocarpa of female parent, but there was no significant difference between allotriploid and tetraploid U. pumila of male parent; The leaf thickness of elm allotriploid is thinner than that of its parent. Chlorophyll content and chlorophyll a/b ratio were not significantly different from those of the male parent tetraploid U. pumila, but were significantly higher than those of the female parent U. pumila. The net photosynthetic rate of leaves was significantly higher than that of the female parent U. macrocarpa, and there was no significant difference between it and the male parent tetraploid U. pumila.
Key words elm; heterologous triploids; phenotypic traits
榆樹(Ulmus pumila)为榆科(Ulmaceae)榆属(Ulmus)植物。广泛分布于我国华北、西北、东北等地区,是重要的乡土树种之一,具有耐盐碱、耐旱、耐瘠薄等特性,经济以及生态价值较高,是难能可贵的优质木材。大果榆广泛分布于我国山地海拔700~1 800 m地带,具有耐干旱、抗严寒,能适应碱性土壤的特性。目前,因其缺少遗传性状优良的品种,榆树除少量应用于园林绿化上,在其他方面应用较少,大多数地区基本处于自然的状态,在林业上基本不用其营造用材林[ 1 ],因此,选育出适应性强、抗性强以及遗传品质优的良种成为榆树育种工作中亟待解决的关键性问题。
基因组加倍形成多倍体是植物进化与多样化的主要机制之一[ 17 ],几乎所有植物都经历过至少一次基因组加倍,在被子植物中约30%~35%的植物都经历过多倍化[ 2 ]。染色体作为植物基因的主要载体[ 3 ],因而染色体倍数的变化会导致基因组加倍,植物便会产生较大的遗传变异以及性状的改变产生多倍体。由同一物种种内染色体加倍产生同源多倍体,如二倍体染色体加倍可产生同源四倍体[ 18 ]。另一种,因不同物种种间杂交从而产生异源多倍体,其涉及到不同亲本亚基因组重新配对杂合度增加,可产生杂种优势或过优势的现象[ 19 ]。目前有研究表明,异源多倍体因具有较高的杂合性,存在杂种优势,与亲本相比,在表型上存在差异,具体表现在叶片形态、气孔大小以及叶片厚度的变异[ 4 ]。如杨树异源三倍体与二倍体相比叶面积大,叶绿体老化速度慢以及叶绿素含量高等优势[ 20 ];Kang Du等研究表明枇杷杂种三倍体后代与其亲本之间的叶片厚度存在显著差异[ 21 ];通过对青杨异源三倍体不同部位叶片进行研究,表明叶片中碳水化合物合成以及光合能力,明显高于亲本二倍体[ 5 ]。
本研究以二倍体大果榆与四倍体白榆杂交获得的榆树异源三倍体及亲本为材料,比较榆树异源三倍体在表型性状与亲本之间的差异,并对榆树异源三倍体及亲本的光合特性进行分析,其目的是探究二倍体大果榆与四倍体白榆杂交后代的遗传特性,为选育出适应性强、抗性强以及遗传品质优的榆树新种质提供理论依据。
1 材料与方法
1. 1 试验材料
选取二倍体大果榆×四倍体白榆杂交获得的榆树异源三倍体嫁接苗为材料,以同期嫁接的父母本苗木为对照。所有试验材料均来自河北农业大学林学院苗圃,并且父本及后代倍性均经过流式细胞仪鉴定。
1. 2 试验方法
1. 2. 1 叶片形态观测
于2022年7月份,从榆树异源三倍体及亲本枝条上,随机选取生长健壮枝条中上部相同节位的功能叶,采集20片叶作为重复,叶片采集后立即放入冰盒内带回实验室进行叶片形态指标观察与测定,叶片通过扫描仪扫描获得图像,之后采用Lamina 1.0.2叶形分析软件进行分析,测得叶长、叶宽、叶周长、叶面积、叶片指数以及锯齿数量等叶片形态指标[ 6 , 7 ],叶片形态观察则参照榆属研究描述规范对叶片形态进行目测描述[ 8 , 9 ]。
1. 2. 2 气孔大小观测
从榆树异源三倍体及亲本枝条上选取从上到下相对同一部位第4~7片功能性叶片,带回实验室,用蒸馏水清洗掉叶片表面尘土,擦净水分,采用手撕切片的方法[ 10 ],将透明胶带粘在叶片背面,避开主叶脉,反复粘贴叶片,直至撕下叶片下表皮,之后把粘有下表皮的胶带剪成5 cm×5 cm的矩形方块,并将其粘在滴有蒸馏水的载玻片上压片镜检,在目镜为10×、物镜为40×的Olympus BX 53光学显微镜下随机选取6个视野进行拍照,图像由uv-vis Analyst软件进行分析,统计每视野中观测到的单位面积气孔个数,随机选取6个气孔,观测保卫细胞长度、宽度等数据,取其平均值进行比较分析 [ 11 , 12 ]。
1. 2. 3 叶片厚度测定
在榆树异源三倍体及亲本生长健壮,且长势相对一致的枝条上摘取完全展开的叶片,枝条上相对同一部位摘取6片叶为重复,带回实验室用清水冲洗,采用徒手切片的方法[ 13 ],将其制成临时装片,在Olympus BX 53光学显微镜下观察并拍照,每一切片观察6个视野,之后采用uv-vis Analyst分析软件对叶片上表皮、栅栏组织以及海绵组织等叶片厚度指标进行测量。
1. 2. 4 葉绿素含量测定
叶绿素含量测定采用95%乙醇浸提法,选取健壮正常生长的叶片,擦净组织表面污物,剪碎(粗大的叶脉去除)后放入干净的培养皿中,称取0.05 g,共重复3次,分别置于25 ml的刻度试管中,随后加入95%乙醇10 ml,于黑暗中24 h浸提,定时摇匀,至叶片组织完全变白,取上清液。将所得到的叶绿素提取液取4 ml加入光径1 cm的比色杯内,以95%乙醇为空白对照组,在分光光度计波长为665、649 nm以及470 nm下测定吸光度值(OD)。分别计算叶绿素a、b、类胡萝卜素以及叶绿素总浓度(ml/L),公试参照李合生法[ 14 ]。
关系式:Ca=13.95A665-6.88A649
Cb=24.96A649-7.32A665
Cx.C=
CT=Ca+Cb
1. 2. 5 光合参数测定
于6月中旬,在榆树异源三倍体及亲本植株中,分别选择3株长势优良的植株,于晴天上午10~11点,采用LI-6800便携式光合仪,测定每株植株从顶部往下第5~6片成熟且完全展开的叶片,每株选取3片叶作为重复,测量指标包括净光合速率、气孔导度、胞间 CO2 浓度以及蒸腾速率等指标[ 15 ]。
2 结果与分析
2. 1 叶片形态特征
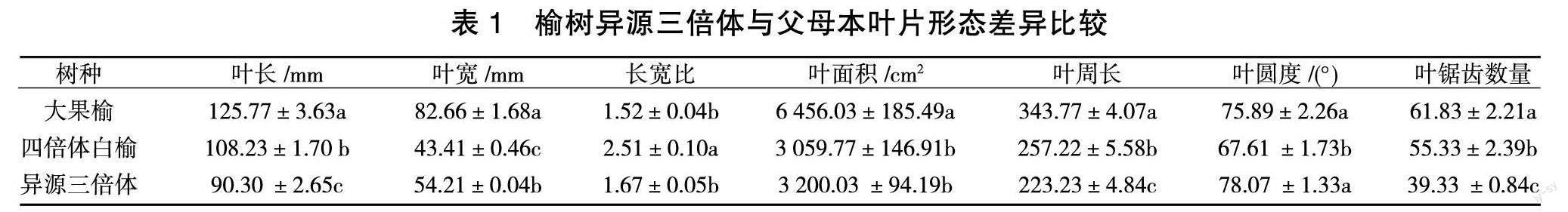
叶片的形态特征是最能直观的显示父母本与后代之间最大差异的特征。由图1可知,表观上榆树异源三倍体叶呈宽卵形,叶尖渐尖,叶基圆钝,叶片边缘圆锯齿,而其母本二倍体大果榆叶呈倒卵形,叶尖短尾尖,叶基宽楔形,叶片边缘重锯齿。父本四倍体白榆叶则呈卵状披针形,叶尖长渐尖,叶基偏斜形,叶片边缘单锯齿或重锯齿。异源三倍体叶片在叶片形状、叶片质地更倾向于其母本二倍体大果榆;但叶边缘锯齿、叶片基部形状以及次生叶脉与主叶脉之间角度较大,介于两亲本中间。
由表1可知,榆树异源三倍体叶长为(90.30±2.65)mm,小于其亲本长度,而其叶宽大于父本四倍体白榆,小于母本二倍体大果榆,宽度为(54.21±0.04)mm,并且在叶长、叶宽、叶片周长以及锯齿数量上与亲本相比均存在显著差异。但其叶片长宽比与母本相似,不存在显著差异;但与父本存在显著差异;而叶片面积则小于母本二倍体大果榆,但与父本差异不显著。
由表2可知,二倍体大果榆与四倍体白榆杂交后代榆树异源三倍体9个叶片形态性状的中亲优势率的范围为-32.86%~15.79%,其中叶圆度、叶锯齿平均宽以及叶锯齿平均深度表现为正向中亲优势,且遗传力大于100%,最大中亲优势为叶片圆度,而叶长、叶宽以及叶片面积等6个性状表现均为负向中亲优势。9个叶片形态性状的变异系数为2.10%~7.21%,平均变异系数为7.18,其中叶宽的变异系数最小,为2.10%,而叶面积的变异系数最大,为7.21%。
2. 2 气孔大小特征
气孔是进行染色体倍性鉴定的重要器官,由表3可以看出,榆树异源三倍体在气孔密度、大小与母本二倍体大果榆相比均存在显著差异。其中,其气孔密度显著小于母本,而大于父本;气孔长度为(21.74±0.30)μm,大于母本的气孔长度。但在气孔长度以及保卫细胞长等方面,榆树异源三倍体均小于父本四倍体白榆,存在显著差异;而可见,由于倍性增加,榆树异源三倍体气孔大小比母本二倍体大果榆显著增大,但与父本四倍体白榆相差不大。
2. 3 叶片厚度特征
叶片解剖结构特征可以较好的反应植物对不良环境的抵抗能力,而染色体加倍后会引起植物叶片厚度的变化。如图2观察到榆树异源三倍体叶片厚度明显不同于亲本。由表4可知榆树异源三倍体与其亲本叶片解剖结构存在显著差异。榆树异源三倍体叶片厚度(147.28±1.74)μm,而亲本二倍体大果榆与四倍体白榆叶片厚度分别为(225.82± 4.66)μm、(233.30±3.89)μm,其叶片厚度小于亲本;且栅栏组织以及海绵组织均小于亲本,分别为(69.80±1.37)μm、(46.46±2.38)μm。可见榆树异源三倍体叶片厚度与亲本相比明显变薄。
2. 4 叶绿素含量测定
叶绿素是植物光合作用中必不可少的活性物质,其含量测定被认为是衡量植物生长状况以及对外界环境适应能力的重要指标。榆树异源三倍体与其亲本叶绿素含量存在差异较小。榆树异源三倍体叶绿素a含量、叶绿素b含量以及叶绿素总量分别为(2.06±0.02)mg/g、(0.60±0.03)mg/g以及(2.66± 0.05)mg/g。与亲本相比,均大于母本二倍体大果榆,存在显著差异,但与其父本四倍体白榆不存在显著差异,且叶绿素a/b、类胡萝卜素/叶绿素总量也不存在差异。可见,榆树异源三倍体杂交倍性增加,叶绿素含量较母本二倍体大果榆有所增加,但与父本四倍体白榆相差较小。
2. 5 叶片光合特性
光合作用是植物进行物质能量积累以及生理代谢的基本途径,叶片光合特性可有效揭示植物对外界生存环境的适应能力。由表6可知,榆树异源三倍体叶片光合特性与其亲本间存在显著差异,其中异源三倍体的净光合速率为(25.27±1.10)μmol/m2·s,明显高于母本二倍体大果榆,存在显著差异,而与父本四倍体白榆不存在显著差异;但在蒸腾速率、胞间二氧化碳浓度以及气孔导度等均大于其父本四倍体白榆,存在显著差异,而与母本二倍体相比差异不明显。说明由于倍性增加,榆树异源三倍体光合速率明显高于母本二倍体大果榆,但在光合其他特性上大于父本四倍体白榆,可能与树种本身特性有关。
3 讨论与结论
杂交与多倍化促使物种进化以及多样化,其是异源多倍体的起源[ 22 , 23 ],因异源多倍体植物受基因组加倍产生多倍体以及不同亲本杂交基因型重组存在杂合性的双重影响,与二倍体相比存在明显的生长优势且表现出新的表型性状[ 24 , 25 ]。郑赟等[ 16 ]通过远缘杂交与人工诱导染色体加倍获得陆地棉异源四倍体和异源六倍体,对其形态性状及生理指标进行测定,研究发现陆地棉异源四倍体表型性状继承了亲本性状,也出现了与亲本不同的新的性状,同时异源六倍体叶面积、叶绿素含量以及气孔大小显著高于其亲本;王溢等[ 5 ]研究表明青杨异源三倍体的叶片面积、净光合速率以及叶绿素含量均高于二倍体,以上研究除叶面积外与本研究结果一致。本研究发现榆树异源三倍体叶面积明显小于母本二倍体大果榆,但与父本四倍体白榆相差不大;且叶片厚度较亲本二倍体大果榆与四倍体白榆明显薄。
本研究通过对榆树异源三倍体及父母本叶片表型性状以及光合特性进行测定,研究发现二倍体大果榆与四倍体白榆杂交产生榆树异源三倍体表型性状以及光合能力方面与亲本存在显著差异。榆树异源三倍体叶面积小于母本二倍体大果榆,与父本四倍体白榆无显著差异;叶片形态特征遗传特性更为偏向于母本;榆树异源三倍体气孔大小明显大于母本二倍体大果榆,且叶绿素含量、净光合速率也显著高于母本;但叶片厚度榆树异源三倍体较父母本薄。
参考文献
[1] 李朝晖, 王丽敏. 我国榆树良种选育研究进展[J]. 防护林科技, 2017, 1(9): 113 - 114.
[2] 康向阳. 林木多倍体育种研究进展[J]. 北京林业大学学报, 2003, 1(4): 70 - 74.
[3] 鲁文英. 浅谈植物多倍体鉴定方法[J]. 科技视界, 2016, 1(16): 188 - 210.
[4] 刘勇波. 多倍体植物混合倍性种群的建立机制研究进展[J].生物多样性, 2021, 29(8): 1128 - 1133.
[5] 王溢. 青杨异源三倍体营养生长优势形成的蛋白质组学研究[D]. 北京: 北京林业大学, 2018.
[6] 许易梅, 刘红昌, 徐松, 等. 白木通4份種质叶片形态差异及叶面积反演模型研究[J]. 西部林业科学, 2022, 51(4): 116 - 124.
[7] 龐丁玮, 王军, 原阳晨, 等. “冀洪1号”黑枣与普通黑枣叶形性状差异研究[J]. 林业与生态科学, 2021, 36(2): 132 - 137.
[8] 傅立国. 中国榆属的研究[J]. 东北林学院学报, 1980, 1(3): 1 - 40.
[9] 史亚朋, 左力辉, 张文林, 等. 榆树叶形性状遗传变异与SSR标记关联分析[J]. 分子植物育种, 2017, 15(5): 1822 - 1830.
[10] 陈佰鸿, 李新生, 曹孜义, 等. 一种用透明胶带粘取叶片表皮观察气孔的方法[J]. 植物生理学通讯, 2004,1(2): 215 - 218.
[11] 庄东红, 宋娟娟. 木槿属植物染色体倍性与花粉粒、叶片气孔器性状的关系[J]. 热带亚热带植物学报, 2005, 1(1):4 9 - 52.
[12] 巢阳, 周燕. 通过测量叶片气孔鉴定月季染色体倍性的研究[J]. 北京农学院学报, 2015, 30(3): 79 - 85.
[13] 张书敏, 刘红云, 程金金, 等. 快速徒手切片法观察谷子和水稻叶片显微结构[J]. 基因组学与应用生物学, 2015, 34(7): 1527 - 1530.
[14] 盛璐, 黄媛媛, 张茜茹, 等. 不同提取液对铁线莲“亲爱的”叶绿素含量测定的影响[J]. 赤峰学院学报(自然科学版), 2020, 36(8): 13 - 16.
[15] 唐军荣, 李斌, 朱丽娜, 等. 滇杨多倍体苗期叶片形态及光合生理比较分析[J]. 林业科学研究, 2016, 29(1): 103 - 109.
[16] 郑赟. 棉属人工异源多倍体的鉴定与转录组分析[D]. 山西农业大学, 2020.
[17] Arrigo N, Barker M S. Rarely successful polyploids and their legacy in plant genomes[J]. Current Opinion in Plant Biology, 2012, 15(2): 1 - 7.
[18] Chen Z J. Molecular mechanisms of polyploidy and hybrid vigor[J]. Trends in Plant Science, 2009, 15(2): 57 - 71.
[19] Luca C. The advantages and disadvantages of being polyploid[J].Nature reviews. Genetics, 2005, 6(11): 836 - 846.
[20] Du K, Liao T, Ren Y, et al. Molecular Mechanism of Vegetative Growth Advantage in Allotriploid Populus[J]. International Journal of Molecular Sciences, 2020, 21(2): 440 - 441.
[21] Yanjuan S, Jiangbo D, Weiwei C, et al. An allotriploid hybrid developed from a female 2n gamete was obtained from Eriobotrya japonica (Thunb.) Lindl×E. deflexa (Hemsl.) Nakai[J]. Euphytica, 2020, 216(12): 1 - 10.
[22] Guo W, Jiangbo D, Zhongyi X, et al. Molecular karyotypes of loquat( Eriobotrya japonica )aneuploids can be detected by using SSR markers combined with quantitative PCR irrespective of heterozygosity[J]. Plant methods, 2020, 16(1): 18 - 27.
[23] Hegarty M J, Hiscock S J. Hybrid speciation in plants: new insights from molecular studies[J]. The New phytologist, 2005, 165(2): 9 - 13.
[24] Liao, Ting,Cheng,et al .Effects of triploid status on growth, photosynthesis, and leaf area in Populus[J]. Structure and Function,2016, 30(4): 3 - 13.
[25] Soltis P S, Soltis D E. The Role of Hybridization in Plant Spe- ciation[J]. Annual Review of Plant Biology, 2009, 60(1): 2 - 28.
