直肠磁共振成像联合腔内超声检测在直肠癌新辅助化疗后完全缓解诊断中的应用效果
2023-07-24张晨雪李晓宇武雪亮陈文婷王立坤
张晨雪 孙 宇 闫 骥 李晓宇 武雪亮 刘 博 陈文婷 王立坤▲
1.河北省张家口市第一医院超声医学科,河北张家口 075000;2.河北北方学院附属第一医院超声医学科,河北张家口 075000;3.河北北方学院附属第一医院普通外科,河北张家口 075000;4.河北北方学院附属第一医院病理科,河北张家口 075000;5.河北北方学院附属第一医院内镜科,河北张家口 075000
直肠癌是临床较为常见的一种恶性消化系统肿瘤,危险性较高,且多受到饮食习惯等因素影响,近年其发病年龄有年轻化趋势。目前临床中可切除新辅助化疗方案的应用逐渐增加,该方案可加强保肛率,并减少局部复发,是当前进展期中低位直肠癌患者的主要治疗方案。有超过20%左右患者可达到完全缓解(complete response,CR),若手术前对CR 患者进行采取“观察等待”策略,可为患者避免后续根治手术造成的损伤,加强生存质量[1]。以往对新辅助化疗CR 患者的筛查多是通过肛门指检及结肠镜,并未大面积使用磁共振成像(magnetic resonance imaging,MRI)及超声技术,近些年临床逐渐提出MRI 及超声技术在CR 患者筛查中具有一定价值[2]。本研究主要针对直肠MRI和腔内超声(endorectal ultrasound,ERUS)检查对直肠癌新辅助化疗后CR 的临床诊断价值进行探讨。
1 资料与方法
1.1 一般资料
选取2019 年1 月至2021 年12 月河北北方学院附属第一医院(以下简称“我院”)接受新辅助化疗及根治性手术的直肠癌患者66 例,其中男40 例,女26例;年龄51~66 岁,平均(57.82±4.12)岁;病程1~5 年,平均(3.05±1.26)年;肿瘤分期:Ⅲ期45 例,Ⅳ期21例。患者均采用新辅助化疗:奥沙利铂静脉滴注,剂量采取体表面积130 mg/m2标准,与5%葡萄糖注射液250 ml 混合使用;首次治疗中使用卡培他滨片,剂量采取体表面积1 g/m2,口服使用,持续用药6 周。收集患者基础资料,本研究已获得我院医学伦理委员会审批(K2021147)。
1.2 入选标准
1.2.1 纳入标准 ①符合直肠癌临床诊断标准[2];②具有完整MRI、ERUS 资料;③肿瘤与肛缘距离<12 cm;④中低位直肠癌;⑤均顺利接受新辅助治疗;⑥接受根治手术。
1.2.2 排除标准 ①结直肠多原发癌;②有放疗史;③资料缺失;④配合意向较低;⑥深度昏迷。
1.3 研究方法
直肠MRI 检查:选择Philips Ingenia 型核磁仪(荷兰皇家飞利浦公司)进行,直肠MRI 出示序列包括矢状位、冠状位及轴位T2W2相及轴位T1W1相和DWI相,以及局部高分辨T2W1和DWI 相,层厚为4 mm,薄层动态扫描采用三维快速扰相梯度回波序列,增强动态扫描每期30 s,剂量为15 ml。直肠ERUS 检查:由佳能(中国)有限公司提供的佳能Aplio i800 型及i900 型超声诊断仪完成,超声探头为直肠腔内探头,频率为3~12 MHz,观察角度为360°。所有检测均由河北北方学院附属第一医院高年资超声科医师审核,独立阅片后综合讨论确定检查结果。术后病理学分期:手术后由外科医师对病理学标本选择墨汁进行环周切缘标记,10%福尔马林固定,送至我院病理科检查。
1.4 观察指标
①金标准:以病理学结果为金标准,对术中发现肿瘤有显著退缩患者要注意边缘的切割,并将病变处全部取材作为标本,参照美国癌症联合会病理学分期[3]评估患者新辅助化疗后是否CR,即在直肠壁及系膜中未发现肿瘤残留为CR。②于患者新辅助治疗前及治疗后第7 周进行直肠MRI、ERUS 检查,比较肿瘤影像学变化,采取肿瘤退缩程度分级概念中DWORAK分级[4],肿瘤无消退为0 级;肿瘤细胞团明显,可见纤维化成分或血管改变为1 级;纤维化为主,病灶内有少量肿瘤细胞或细胞团(较容易发现)为2 级;纤维化为主的肿瘤内有少量肿瘤细胞(不易发现或镜下发现),可有黏液存在3 级;肿瘤完全消退,纤维化组织中无肿瘤细胞残存为4 级,其中4 级为CR。MRI 及ERUS 诊断均判断为CR 记为联合诊断为CR。
1.5 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,比较采用t 检验。计数资料采用例数表示,采用Kappa 系数评价一致性。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同检测方式诊断直肠癌患者新辅助化疗后CR的结果
病理学结果显示,66 例直肠癌患者新辅助化疗后完全缓解22 例。MRI、ERUS 诊断直肠癌患者新辅助化疗后完全缓解与金标准的一致性无统计学意义(Kappa=0.037、0.094,P=0.720、0.373),MRI 联合ERUS诊断与金标准具有一致性(Kappa=0.400,P=0.001)。见表1~3。典型患者(男,56 岁)MRI 显示,直肠左前壁局限性增厚,DWI 呈明显高信号,未见肿物突破浆膜层,MRI 分期为T2期;ERUS 超声提示,低回声肿物环周1/3,侵及肌层,但未突破浆膜层,无淋巴转移。见图1~2。
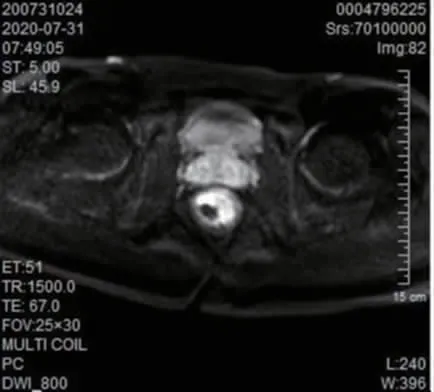
图1 典型患者新辅助化疗后直肠磁共振成像
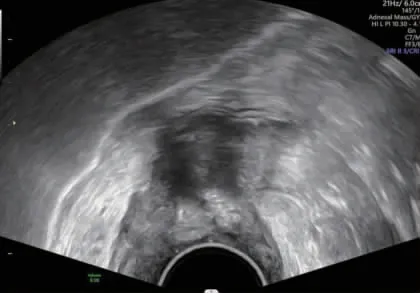
图2 典型患者新辅助化疗后直肠腔内超声
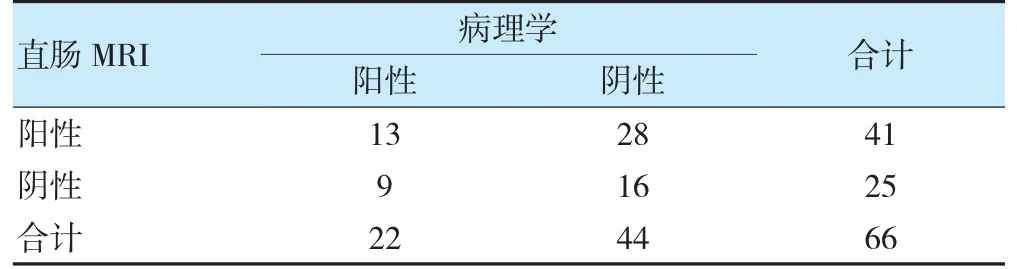
表1 直肠MRI 及病理学诊断直肠癌患者新辅助化疗后CR 比较(例)
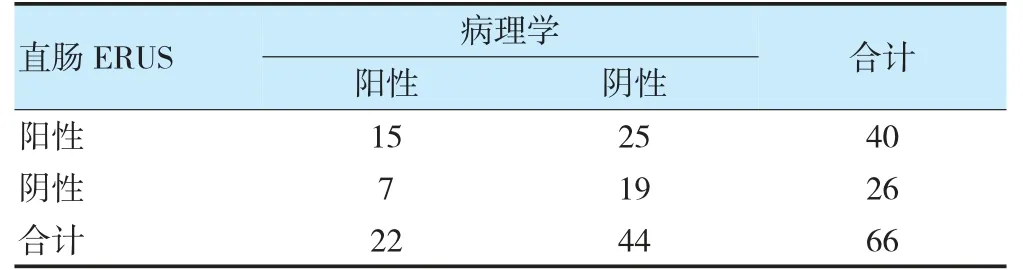
表2 直肠ERUS 及病理学诊断直肠癌患者新辅助化疗后CR 比较(例)
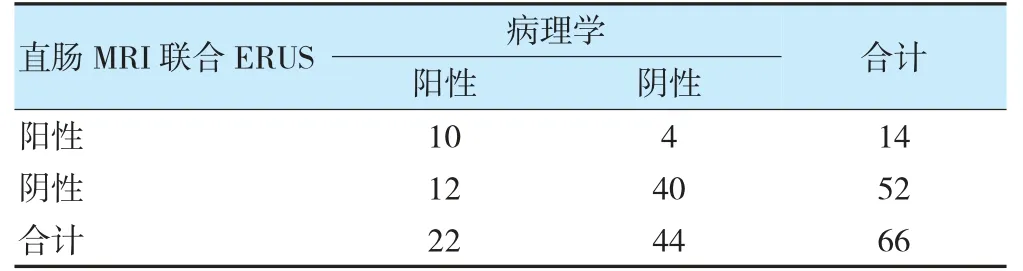
表3 直肠MRI 联合ERUS 及病理学诊断直肠癌患者新辅助化疗后CR 比较(例)
2.2 不同检测方式诊断直肠癌患者新辅助化疗后CR的价值
直肠MRI 联合ERUS 诊断灵敏度为45.45%,特异度为90.91%,准确率为75.76%。见表4。
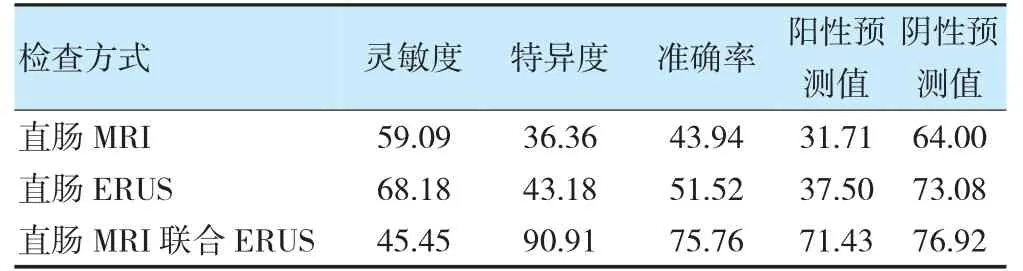
表4 不同检测方式诊断直肠癌患者新辅助化疗后CR 的价值(%)
3 讨论
直肠癌近些年临床上较为常见,目前治疗方案主要为根治手术,随着新辅助化疗的应用,可一定程度上控制肿瘤细胞发展,减少患者手术切除概率及复发可能性,提高保肛率[5-8]。新辅助化疗后部分患者可达到CR,加强术前对CR 患者的筛查,结合后续“观察等待”方案,可在确保患者治疗效果的同时,避免根治手术造成损伤可能性[9-12]。以往多采取石蜡病理检查、肛门指检与结肠镜等方式,前者操作复杂,存在一定机体损伤,后者检测效果并不理想。部分研究显示其灵敏低于20%,当前直肠癌新辅助化疗CR 患者筛查中,对直肠MRI、直肠超声的应用并不多见,但鉴于其操作简便、患者接受度高等优势,部分研究开始针对其进行深入分析[13-17]。
本研究中,MRI、ERUS 检查结果与金标准的一致性无统计学意义(P>0.05),MRI 联合ERUS 检查中判定为CR 的患者占21.21%(14/66),与金标准具有一致性。提示在直肠癌患者新辅助化疗后CR 情况的筛查中,单纯直肠MRI、直肠超声应用价值不高,与金标准比较并不相应[18-19]。其中MRI 准确率较低,可能是因为新辅助化疗后,患者局部组织出现纤维化、黏液变化,降低了其检测准确率[20-22];同时当前MRI 诊断标准尚未确定,为避免误诊率,医师诊断中易出现漏诊率;当前诊断中心多依赖于传统检测技术,以及手工进行测量,均导致其准确率出现下降。而ERUS 在应用中容易因患者肠腔狭窄而导致探头无法深入,因而临床多建议与MRI 联用[23-26]。
本研究显示,MRI 联合ERUS 诊断准确率为75.76%,特异度为90.91%,灵敏度为45.45%,MRI、ERUS 联用所具特异度较高,对非CR 患者出现误诊可能性较低,所具应用价值也较高[27-28]。MRI、ERUS 联合检测结果也提示,对任何一种检测结果为非CR 患者,临床应建议患者接受根治性手术,此时过度手术所具风险性较低;同时MRI、ERUS 联合检测所具灵敏度较低,指出其可能导致较多无肿瘤细胞残余的患者出现误诊情况,临床需加强注意[29-31]。
综上所述,在直肠癌新辅助化疗后,MRI、ERUS对CR 诊断准确率并不高,联合诊断特异度高,灵敏度较低;针对检测中非CR 患者仍建议采取根治性手术,CR 患者则建议结合结肠镜、指诊进行检查,谨慎实施后续治疗。
