5-氮杂-2’-脱氧胞苷对苯并[a]芘致海马神经元毒性的保护作用
2023-07-24魏智超冯婧宇聂继盛魏建宏
魏智超 冯婧宇 聂继盛 魏建宏
1.山西医科大学公共卫生学院,山西太原 030000;2.山西医科大学汾阳学院,山西汾阳 032200
表观遗传学是指当核苷酸序列不变时,基因表型改变的一门学科。DNA 甲基化是最重要的基因修饰途径,是人类生命过程中的重要组成部分[1-2],它可以调节神经元发育中的重要过程[3-5]。哺乳动物细胞中DNMT1、DNMT3A 和DNMT3B 3 种酶具有DNA 甲基转移酶(DNA methyltransferase,DNMT)活性[4]。
苯并[a]芘(benzo[a]pyrene,B[a]P)是多环芳烃的主要代表,在香烟烟雾、柴油废气及工业废物中可以检测到高浓度的B[a]P[6]。B[a]P 具有遗传毒性、致畸性和神经毒性等特点。由于其亲脂性,B[a]P 能轻易通过血脑屏障,可导致认知功能障碍、神经功能损伤[7-9]。B[a]P 暴露后DNA 甲基化的变化可影响肺癌发展[10]。B[a]P 可引起精子DNA 异常甲基化,与胚胎、生殖系统发育和许多遗传疾病有关[11],还可影响小鼠血液和肝脏中的DNA 甲基化水平[12]。但是,目前关于DNA 甲基化在B[a]P 致神经毒性中的作用研究较少。
5-氮杂-2’-脱氧胞苷(5-Aza-2’-deoxycytidine,5-Aza-cdR)为DNA 甲基转移酶抑制剂[13]。研究发现5-Aza-cdR 可以通过氧化应激来调节百草枯对PC12 细胞的毒性作用[14]。目前,5-Aza-cdR 对B[a]P所致的神经毒性作用尚未见报道。本研究旨在构建B[a]P 的体外染毒模型,利用5-Aza-cdR 进行干预,探讨5-Aza-cdR 对B[a]P 神经毒性的保护作用,为深入探索B[a]P 的发病机制提供新思路。
1 材料与方法
1.1 实验动物
3 月龄SPF 级SD 大鼠20 只[山西医科大学实验动物中心提供,许可证号:SCXK(晋)2019-0004),合格证号:SYXK(晋)2019-0007]。体重250~300 g,雌雄比例2∶1 合笼交配。饲养条件:温度(24±2)℃,湿度(55±5)%。本研究经山西医科大学汾阳学院动物伦理委员会审批通过(2018-021)。
1.2 实验材料
B[a]P(B1760,sigma);5-Aza-cdR(D9010,索莱宝);无血清培养基(21103049,Thermo);β-tubulinⅢ抗体(AB0043,abways);兔抗DNMT1 抗体(YN2950,Immunoway);兔抗DNMT3A 抗体(20954-1-AP,武汉三鹰生物技术有限公司);兔抗 DNMT3B 抗体(26971-1-AP,武汉三鹰生物技术有限公司);实时荧光定量试剂盒[FP215,天根生化科技(北京)有限公司];凝胶成像分析仪(731BR03 442,Bio-Rad);定量反转录PCR 仪(CFX96,Bio-Rad)。
1.3 实验方法
1.3.1 细胞培养 雌鼠妊娠21 d 后,取24 h 内新生SD大鼠10 只,断头,收集海马组织于15 ml 离心管,添加DMEM 培养基,2 mg/ml 的木瓜酶37℃消化30 min,添加胎牛血清终止消化,去上清,加入10 μl DNA 酶,枪头吹打10 次,移液枪吸取上清于新离心管,200 目筛过滤细胞悬液,重复3 次。离心机1 500 r/min 离心5 min(离心半径9 cm),去上清,加入培养基重悬,进行细胞计数。以7×105个/ml 的接种密度均匀铺板,每孔体积2 ml,37℃培养箱培养。6 h 后更换无血清培养基,每隔2 d 半量换液。光镜观察细胞形态。
1.3.2 免疫荧光法鉴定海马神经元 海马神经元培养至第5 天,4%多聚甲醛固定1 h。加入0.1%TritonX-100 室温孵育30 min,5%BSA 封闭30 min。添加β-tubulinⅢ抗体4℃过夜。荧光二抗避光孵育1 h。DAPI 染色15 min,以DAPI 和的β-tubulinⅢ阳性细胞数占总细胞数的百分比作为神经元阳性率(阳性率>95%为标准)。
1.3.3 细胞分组及处理 将海马神经元分为3 组,分别为对照组、B[a]P 组(20 μmol/L B[a]P)、B[a]P+5-Azacd R 组(20 μmol/L B[a]P+10 μmol/L 5-Aza-cdR)。待细胞生长至第5 天,海马神经元用5-Aza-cdR 处理24h,暴露于B[a]P 24 h。镜下观察细胞形态。
1.3.4 CCK8 检测细胞活力 细胞分组干预,每组设置4个复孔。每孔加入10 μl CCK8 检测液,37℃孵育2 h。酶标仪测定吸光度值。细胞活力(%)=[(实验孔-空白孔)/(对照孔-空白孔)]×100%
1.3.5 免疫印迹法检测DNMTs 蛋白表达 各组细胞加入80 μl 裂解液,收集蛋白裂解液,BCA 法测定蛋白浓度。电泳、电转、封闭,孵育一抗DNMT1(1∶1 000)、DNMT3A(1∶4 000)、DNMT3B(1∶3 000)和β-actin(1∶10000)。4℃孵育过夜,加入二抗(1∶5000)室温孵育2h。以目的蛋白与内参蛋白的条带灰度值比值作为目的蛋白的相对表达量。
1.3.6 定量反转录PCR 测定DNMTs 基因表达 Trizol提取细胞RNA,根据反转录试剂盒说明书合成cD-NA,-20℃保存,取少量cDNA 进行PCR 扩增,反应体系共20μl:MasterMix10 μl,cDNA 1 μl,正向引物0.6 μl,反向引物0.6μl,ddH2O7.8μl。实验重复3 次,采用2-△△Ct法计算基因的相对表达量。

表1 DNMTs 引物序列
1.3.7 5-mC 免疫荧光法检测总甲基化水平 多聚甲醛固定,山羊血清封闭。每孔加入50 μl 5-mC 抗体4℃过夜。加入荧光二抗,荧光显微镜下观察。平均荧光强度=荧光强度总和/总面积。
1.3.8 细胞凋亡检测 多聚甲醛固定20 min,滴加50 μl Hoechst33342 工作液,荧光显微镜下进行观察。细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.4 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,组间比较釆用LSD-t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 海马神经元的形态学观察和鉴定结果
刚接种的海马神经元呈圆形或多角形,透光性好,分布较均匀。1 d 后细胞突起生长快,数目增加。4~5 d后神经元突起增长,相互连接成神经纤维网状结构,见图1。神经元阳性率>95%,见图2。

图1 海马神经元形态
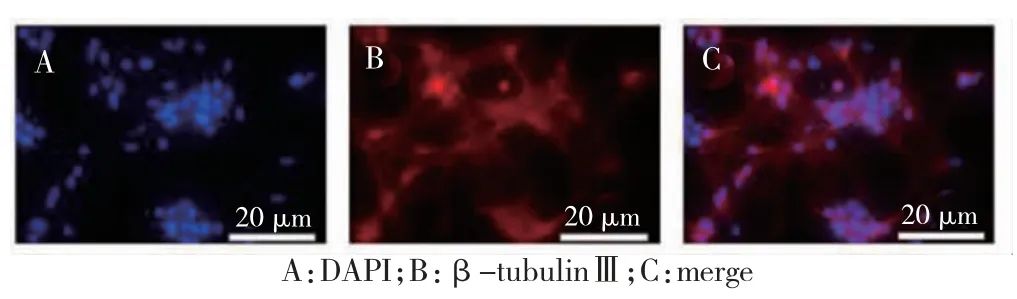
图2 神经元鉴定结果
2.2 各组细胞形态和活力的变化
对照组神经元形态正常,结构完整。B[a]P 组可见细胞数量较少,突起皱缩,突起间连接断裂;B[a]P+5-Aza-cdR 组可见少量萎缩细胞。与对照组比较,B[a]P组细胞活力降低(P<0.05)。与B[a]P 组比较,细胞活力在B[a]P+5-Aza-cdR 组升高(P<0.05)。见图3。

图3 海马神经元形态和活力变化
2.3 各组细胞DNMTs 蛋白表达结果
与对照组比较,B[a]P 组DNMT3A、DNMT3B 蛋白的表达增高(P<0.05),DNMT1 表达水平比较,差异无统计学意义(P>0.05)。与B[a]P 组比较,B[a]P+5-AzacdR 组DNMTs 的蛋白表达水平表达降低(P<0.05)。见图4。

图4 各组细胞DNMTs 蛋白表达
2.4 各组细胞DNMTs 基因表达结果
与对照组比较,B[a]P 组DNMT1、DNMT3A 基因表达水平升高(P<0.05)。DNMT3B 表达水平无明显变化,差异无统计学意义(P>0.05)。与B[a]P 组比较,B[a]P+5-Aza-cdR 组DNMTs 基因表达水平降低(P<0.05)。见图5。

图5 各组细胞DNMTs 基因表达
2.5 各组细胞总甲基化水平表达结果
与对照组比较,B[a]P 组的荧光信度变强,总甲基化水平升高(P<0.05)。与B[a]P 组比较,B[a]P+5-Aza-cdR组总甲基化水平降低(P<0.01)。见图6。
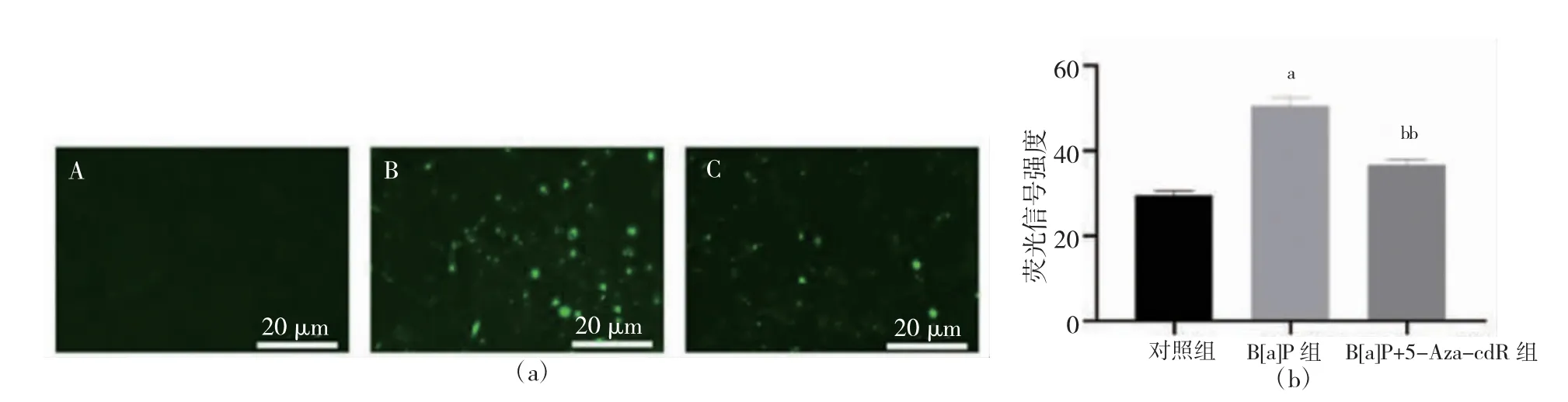
图6 各组细胞总甲基化水平表达结果
2.6 各组细胞凋亡结果
与对照组比较,B[a]P 组可以观察到核浓染,核破碎现象,凋亡细胞增多,凋亡率升高(P<0.05)。与B[a]P 组比较,B[a]P+5-Aza-cdR 组可以观察到少量凋亡细胞,海马神经元的凋亡率明显降低(P<0.01)。见图7。

图7 各组细胞凋亡结果
3 讨论
B[a]P 神经毒性的作用机制主要有以下4 种:一是改变神经递质及相关受体诱发神经毒性;二是干扰基因的表达诱发神经毒性;三是改变氧化应激而引起神经毒性[15-17];四是从表观遗传学方面引起神经毒性[18]。研究表明,细胞内锌缺乏可能会改变甲基化相关蛋白及基因的表达,并进一步诱导神经元损伤[19]。随着B[a]P染毒剂量的增加,DNMTs 表达量显著增加,提示DNMTs 在B[a]P 诱导的小鼠学习和记忆功能损害中起着重要作用[20]。5-Aza-cdR 对小鼠海马PP1γ 的表达具有抑制作用,与小鼠学习记忆和突触可塑性有关[21-22]。研究发现5-Aza-cdR 能抑制DNMTs 等基因的表达,从而影响细胞的生长和凋亡[23],还可以显著降低DNA甲基化水平,同时大鼠的学习能力也明显提升[24]。5-Aza-cdR 可抑制DNA 甲基化而改善七氟醚诱导的记忆基因表达下降[25]。
本研究结果显示,5-Aza-cdR 对B[a]P 诱导的海马神经元毒性有保护作用。可能的机制是5-Aza-cdR可降低DNMTs 基因和蛋白的表达水平,降低细胞的总甲基化水平。在后续的实验中,将进一步从表观遗传学方面深入探讨5-Aza-cdR 对B[a]P 诱导海马神经元毒性的作用,为B[a]P 神经毒性的防治提供了一定的作用靶点。
