2016—2020年宁波市某医院血培养病原菌分布与耐药性研究
2023-07-22詹琳郭飞谷海瀛
詹琳,郭飞,谷海瀛,3
·论 著·
2016—2020年宁波市某医院血培养病原菌分布与耐药性研究
詹琳1,郭飞2,谷海瀛1,3
1.宁波大学医学部,浙江宁波 315211;2.宁波市第一医院检验科,浙江宁波 315010;3.宁波大学医学院附属医院消化病实验室,浙江宁波 315020
分析2016—2020年宁波市某医院血培养中的病原菌分布和耐药情况,为临床合理使用抗菌药物提供参考。采用WHONET 5.6软件对2016—2020年血培养分离的主要病原菌及其耐药性进行统计分析。共检出细菌3400株,其中G–杆菌1545株(45.4%),G+球菌1510株(44.4%),真菌111株(3.3%)。G-杆菌以大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和洋葱伯克霍尔德菌为主,分别占总株数的21.0%、9.6%、2.7%、2.2%、1.3%。肺炎克雷伯菌分离率呈上升趋势。G+球菌中以凝固酶阴性葡萄球菌为主,共867株,占25.5%。耐甲氧西林金黄色葡萄球菌检出率为37.3%,未出现对万古霉素、替考拉宁和利奈唑胺耐药的菌株。宁波市某医院血流感染病原菌中G-杆菌和G+球菌比例相当。临床医生应重视并规范早期血培养,严格控制抗生素的使用,减少耐药细菌的感染与播散。
血流感染;血培养;病原菌;耐药性
菌血症、败血症等全身性血流感染给患者生命造成极大的威胁,也给临床治疗带来很大的挑战[1]。近年来,由于抗菌药物的滥用和有创操作的开展,血流感染的问题日益严峻[2]。血液培养出病原菌是诊断的金标准,但由于周期长,不能及时为临床初期治疗提供最有效的证据。随着血流感染病原菌的不断变化,其耐药性亦逐渐增加[3]。不同地区引起血流感染的病原菌菌种和耐药性具有一定差异,定期对血培养阳性的病原菌及耐药性进行统计分析,有助于临床血流感染患者的诊断、治疗[4-6]。本研究通过对宁波市某医院2016—2020年血培养分离出的病原菌种类和耐药性进行回顾性分析,探讨病原菌的分布特点及其耐药性,为临床早期治疗提供帮助,从而提高治疗效果,现报道如下。
1 资料与方法
1.1 标本及菌株来源
2016—2020年宁波市某医院住院及门/急诊患者血培养分离所得的3400株细菌,排除同一患者的重复菌株及芽孢杆菌等的潜在的皮肤污染菌。本研究属于回顾性研究,所用资料是从临床既往病例中获得,免除知情同意,已通过宁波市第一医院伦理委员会审批通过(伦理审批号:2023R013RS)。
1.2 菌株培养与鉴定
血培养采用美国BD BACTEC9240和FX全自动养仪,菌株的鉴定和常规药敏试验采用法国生物梅里埃公司VITEK2 Compact全自动细菌鉴定仪。补充药敏试验采用KB法,按照美国临床实验室标准化协会指南进行判读。质控菌株为大肠埃希菌ATCC25922、金黄色葡萄球菌AECC25923及铜绿假单胞菌ATCC27853。
1.3 统计学方法
采用WHONET 5.6软件和Excel 2013对数据进行描述性分析。
2 结果
2.1 病原菌分布及构成
2016—2020年血培养共分离到3400株不同细菌,见表1。其中G–杆菌1545株(45.4%),G+球菌1510株(44.4%),真菌111株(3.3%)。G–杆菌以大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌和洋葱伯克霍尔德菌为主,分别占总株数的21.0%、9.6%、2.7%、2.2%、1.3%。其中,G–杆菌占比相对稍多,主要G–杆菌分离率的年度变化趋势,见图1。
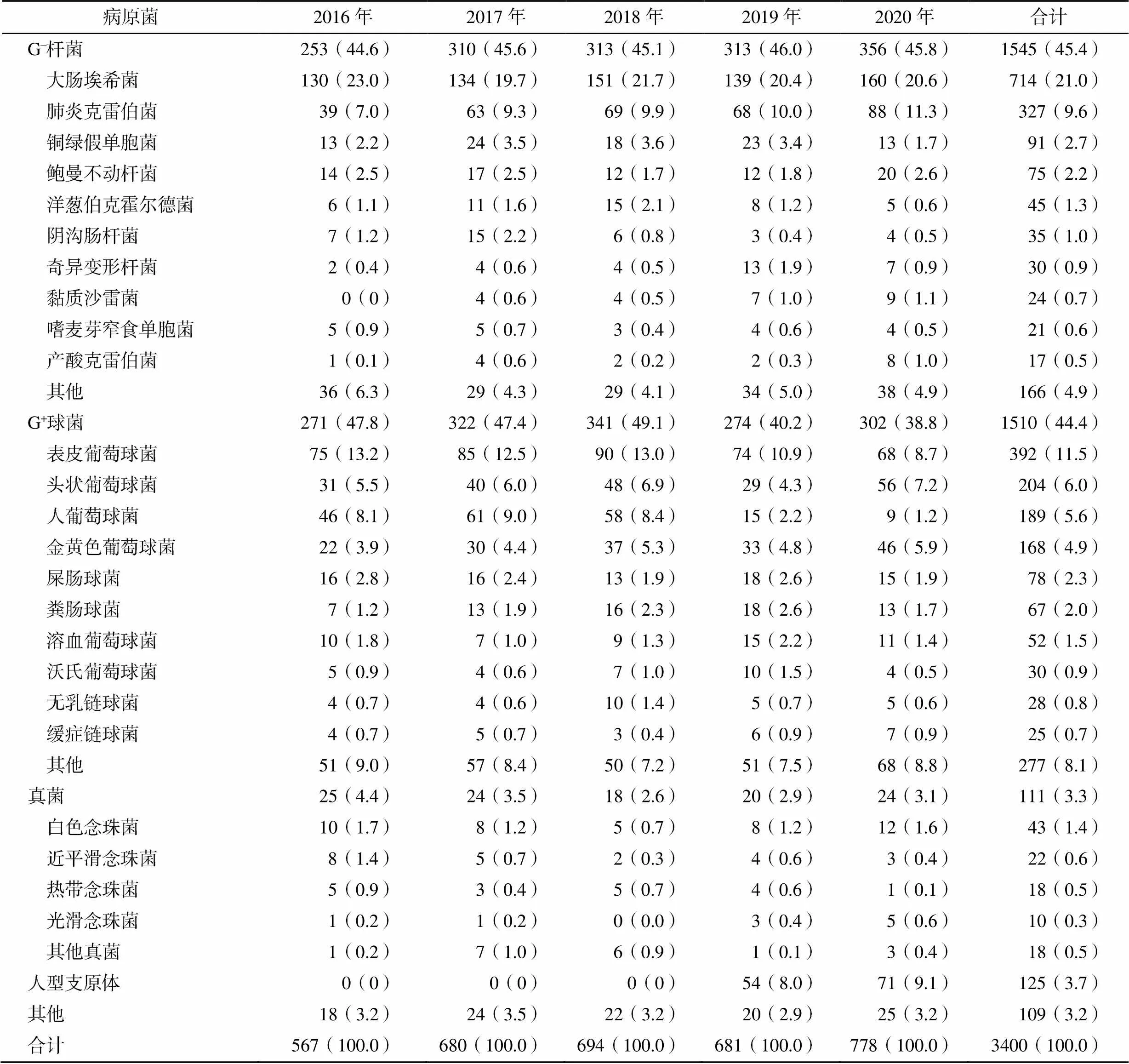
表1 2016—2020年血培养病原菌分布[株(%)]

图1 2016—2020年主要G-杆菌分离率的变化趋势
2.2 主要G-杆菌的耐药性
大肠埃希菌对环丙沙星、头孢曲松、复方新诺明的耐药率超过50%,对碳青霉烯类、阿米卡星、哌拉西林/他唑巴坦和头孢哌酮/舒巴坦较敏感,耐药率<6%。肺炎克雷伯菌对氨苄西林的耐药率高达89.3%;对其他常用抗生素敏感性几乎>65%;耐碳青霉烯类肺炎克雷伯菌占23.4%。肺炎克雷伯菌对头孢类、碳青霉烯类药物的耐药率高于大肠埃希菌。铜绿假单胞菌对头孢曲松、头孢西丁、阿莫西林/克拉维酸、氨苄西林的耐药率分别为97.2%、99.0%、96.5%和98.9%;对庆大霉素、妥布霉素、阿米卡星的耐药率<10%。鲍曼不动杆菌对常用抗生素(复方新诺明除外)的耐药率>40%,见表2。
2.3 主要G+球菌的耐药性
金黄色葡萄球菌对青霉素G耐药率较高,对利福平、喹诺酮类药物敏感性尚好,对其他抗生素的耐药率<53.6%。耐甲氧西林金黄色葡萄球菌检出率为37.3%。肠球菌总体耐药率较高,屎肠球菌对常用抗生素耐药率>79.8%(除四环素和奎奴普丁/达福普汀外),而粪肠球菌对常用抗生素的耐药率<60.6%。未检出耐万古霉素和利奈唑胺的肠球菌,见表3。
3 讨论
正常人体的血液是无菌环境,病原菌或其毒素进入血液后可引起血流感染,如菌血症、败血症、脓毒血症,临床上表现为急性起病,突发寒战、高热、神志改变等,重者可出现急性呼吸窘迫综合征、肝肾功能衰竭、休克、弥散性血管内凝血,甚至死亡[7]。血培养是血流感染诊断的金标准,及时准确地分析血培养结果及药敏试验报告,对临床诊断和治疗至关重要[8]。
本研究结果显示,2016—2020年宁波市某医院住院及门/急诊患者共收集3400株病原菌,其中G-杆菌占45.4%,G+球菌占44.4%,以大肠埃希菌、表皮葡萄球菌、肺炎克雷伯菌、头状葡萄球菌为主,与国内报道基本一致[9]。凝固酶阴性葡萄球菌检出率为27%,高于徐慧等[10]、白书媛等[11]报道的21%和23%,可能与样本送检量、培养条件和地区差异有关。
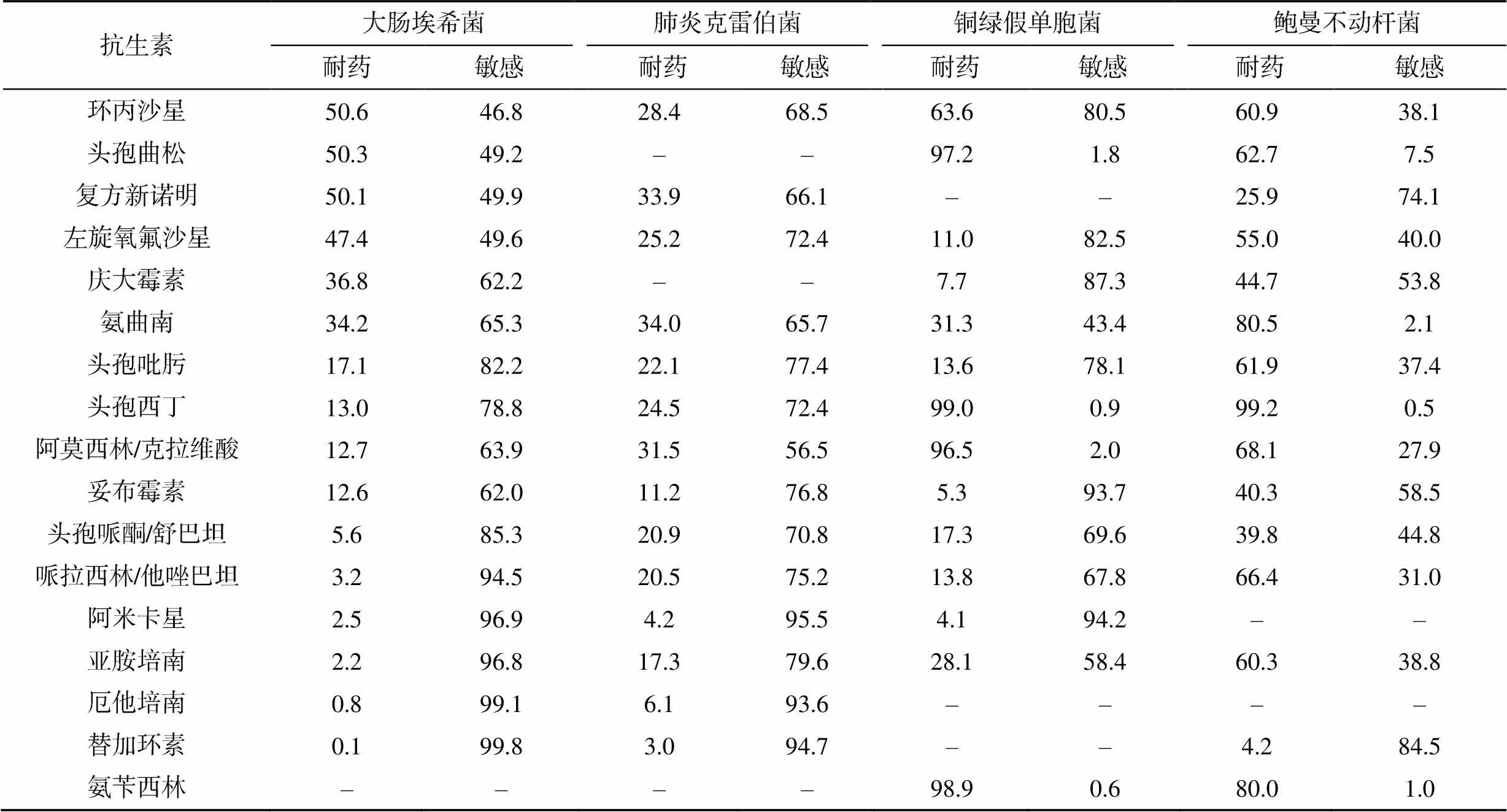
表2 主要G–杆菌对抗菌药物的耐药率(%)
注:–表示未做药敏或天然耐药

表3 主要G+球菌对抗菌药物的耐药率(%)
注:–未做药敏试验或天然耐药
排除可能污染外,G–杆菌引起的血流感染的比重较大且逐年升高,因此,归纳分析以上数据对临床治疗具有重大意义。肺炎克雷伯菌的菌株数及构成比均有增长的趋势。大肠埃希菌对碳青霉烯类、阿米卡星、替加环素和β内酰胺类酶抑制剂有较高的敏感性,这些药物可优先使用,肺炎克雷伯菌对头孢类抗生素及β内酰胺类酶抑制剂的耐药性高于大肠埃希菌,耐碳青霉烯类肺炎克雷伯菌占23.4%,较国内报道稍低,可能与医院严格执行抗生素阶梯治疗有关[12]。对氨基糖苷类抗生素的耐药率相对较低,这些均可优先使用。这两种菌的耐药机制之一是产超广谱β-内酰胺酶以水解头孢类和单环β-内酰胺类抗生素,碳青霉烯类药物对产超广谱β内酰胺酶高度稳定,是针对产ESBLs菌引起严重感染的主要治疗药物。但是,医生应合理选择抗生素,不应直接升级使用碳青霉烯类,以减少耐碳青霉烯类杆菌的出现[13-14]。
非发酵菌是指不能以发酵形式利用糖类的需氧或兼性厌氧的G–杆菌。G–菌血症有1/4是由非发酵菌引起,且该菌易出现耐药现象,应引起临床重视[15]。其中,铜绿假单胞菌和鲍曼不动杆菌引起血流感染的比例最高,对常用抗生素的耐药性相对较高,有严重的多重耐药和泛耐药现象。铜绿假单胞菌对头孢西丁、头孢曲松、阿莫西林/克拉维酸的耐药率为95%,而对其他常用抗生素的敏感性高。其耐药机制包括产生活性酶、抗菌药物作用靶位的改变、细胞膜通透性的下降、形成生物被膜、外排泵的表达[13]。鲍曼不动杆菌对多数抗菌药物的耐药性普遍较高,仅对替加环素有较高的敏感性,而替加环素由于其血药浓度分布低和严重的不良反应而限制其应用。其耐药主要基于以下3种:①抗菌酶的失活;②抗菌靶位的改变或细胞功能的诱变;③保护细菌靶位免受抗菌因子的影响[16]。碳青霉烯类耐药的鲍曼不动杆菌已被世界卫生组织列为具有最大威胁性的耐药菌株之一[17]。本研究中鲍曼不动杆菌对亚胺培南的耐药率>60%,可以进行联合用药,亚胺培南或米诺环素+多黏菌素两种药物组合对鲍曼不动杆菌具有较好的抑菌效果[18]。
G+球菌以凝固酶阴性葡萄球菌(coagulase negative staphylococci,CNS)为主,其次为金黄色葡萄球菌、屎肠球菌和粪肠球菌。耐甲氧西林金黄色葡萄球菌检出率为37.3%,稍高于2020年中国细菌耐药监测网报道的31.0%[19]。CNS既是常见病原菌,也是常见的血培养污染菌[20]。它存在于人体表面,若采血操作不规范,极易造成假阳性。所以,应加强消毒措施和规范操作。CNS占比较高,可能是由于操作不规范造成污染。研究显示,血培养阳性报警时间联合未成熟粒细胞百分比和C反应蛋白对鉴别CNS血流感染和污染有一定价值[21]。因此,该类细菌引起的感染应结合患者临床表现和其他指标综合判断,避免抗菌药物的滥用。
真菌是引起血流感染的第三大因子,占血流感染的3.3%,其中白色念珠菌比例最高,为38.7%(43/111)。研究显示,真菌性血流感染导致休克的概率达70%,深部真菌感染引起的病死率达50%[22]。对于有真菌感染高危因素的患者,在其出现发热等症状且经抗菌药物治疗无效时,应考虑真菌感染[2]。
综上所述,宁波市某医院血流感染病原菌中G–杆菌和G+球菌比例相当,其中大肠埃希菌和肺炎克雷伯菌占比较高,但其耐药率稍低于国内的报道,可能与医院严格控制抗生素的使用有关。CNS在所有病原菌中所占比例最高,可能与医院抽血取样操作不规范,造成较高的污染率有关。微生物人员除及时报告结果外,也应该在临床科室加强宣传,规范操作。动态监测本地区血培养病原菌构成及耐药,可为临床合理应用抗菌药物提供依据。
[1] KERN W V, RIEG S. Burden of bacterial bloodstream infection-a brief update on epidemiology and significance of multidrug-resistant pathogens[J]. Clin Microbiol Infect, 2020, 26(2): 151–157.
[2] CHAMBLEE T B, PATTON L J, YOUNG V B, et al. Reducing central line-associated bloodstream infection in contaminated central venous catheters: Case studies of a pediatric contamination guideline[J]. Br J Nurs, 2021, 30(19): S24–S29.
[3] DE ANGELIS G, FIORI B, MENCHINELLI G, et al. Incidence and antimicrobial resistance trends in bloodstream infections caused by ESKAPE and Escherichia coli at a large teaching hospital in Rome, a 9-year analysis (2007-2015)[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(9): 1627–1636.
[4] 张鸿娟, 许云敏, 董小雪, 等. 云南省多中心2017—2021年血流感染病原菌分布及耐药性分析[J]. 中国热带医学, 2022, 22(12): 1135–1141.
[5] 李可可, 邹凤梅, 杨永清, 等. 2009—2019年甘肃省人民医院血流感染病原菌分布及耐药性分析[J]. 中国抗生素杂志, 2022, 47(8): 834–838.
[6] DECOUSSER J W, PINA P, PICOT F, et al. Frequency of isolation and antimicrobial susceptibility of bacterial pathogens isolated from patients with bloodstream infections: A French prospective national survey[J]. J Antimicrob Chemother, 2003, 51(5): 1213–1222.
[7] CARABALLO C, JAIMES F. Organ dysfunction in sepsis: An ominous trajectory from infection to death[J]. Yale J Biol Med, 2019, 92(4): 629–640.
[8] CENDEJAS-BUENO E, ROMERO-GÓMEZ M P, MINGORANCE J. The challenge of molecular diagnosis of bloodstream infections[J]. World J Microbiol Biotechnol, 2019, 35(4): 65.
[9] 陈兴英, 楼永良. 血培养标本中病原菌的分布特征、耐药性变迁和耐药基因分型[J]. 中国微生态学杂志, 2018, 30(7): 810–817.
[10] 徐慧, 徐岷, 刘彩林, 等. 2014~2019年郑州大学第一附属医院血培养分离病原菌临床分布及耐药性分析[J]. 现代检验医学杂志, 2021, 36(1): 136–140.
[11] 白书媛, 闵嵘, 张丽丽, 等. 某三级医院连续4年血培养分离菌构成及耐药性[J]. 中国感染控制杂志, 2014, 13(2): 85–88.
[12] 陈明慧, 孙兰菊, 房杰, 等. 2015—2017年临床常见血培养病原菌的分布特征及耐药性变迁[J]. 中国中西医结合外科杂志, 2019, 25(3): 248–256.
[13] 张淑丽, 许俊红, 马冰. 肺炎患者下呼吸道感染病原菌分布与非发酵菌的耐药性分析[J]. 临床研究, 2022, 30(1): 24–28.
[14] BIENTINESI R, MURRI R, SACCO E. Efficacy and safety of levofloxacin as a treatment for complicated urinary tract infections and pyelonephritis[J]. Expert Opin Pharmacother, 2020, 21(6): 637–644.
[15] GULTEKIN E, UYANIK M H, HANCI H, et al. Antimicrobial susceptibility of nonfermentative gram negative bacteria isolated from blood cultures[J]. ANKEM Dergisi, 2014, 28(3): 79–85.
[16] BAGIŃSKA N, PICHLAK A, GóRSKI A, et al. Specific and selective bacteriophages in the fight against multidrug-resistant acinetobacter baumannii[J]. Virol Sin, 2019, 34(4): 347–357.
[17] BARALDI E, LINDAHL O, SAVIC M, et al. Antibiotic pipeline coordinators[J]. J Law Med Ethics, 2018, 46(1_suppl): 25–31.
[18] 吴忠伟. 耐碳青霉烯鲍曼不动杆菌的耐药机制、流行病学及联合用药方案分析[D]. 呼和浩特: 内蒙古医科大学, 2020.
[19] 胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377–387.
[20] 夏雨, 张兵. 7781例疑似血流感染患者的血培养标本病原菌分布及药敏结果分析[J]. 山东医药, 2020, 60(3): 82–85.
[21] 王淑慧, 刘海英, 林敏纯, 等. 血培养阳性报警时间联合未成熟粒细胞及C反应蛋白鉴别儿童凝固酶阴性葡萄球菌血流感染与污染[J/CD]. 中华实验和临床感染病杂志(电子版), 2021, 15(1): 60–66.
[22] 吕志华, 冯丽娜, 李艳. 2016至2018年某医院真菌血流感染者流行病学特征及耐药性分析[J/CD]. 中华实验和临床感染病杂志(电子版), 2020, 14(5): 429–432.
Study on the distribution and drug resistance of blood culture pathogenic bacteria in certain hospital of Ningbo City from 2016 to 2020
ZHAN Lin, GUO Fei, GU Haiying
1.NUB Health Science Center, Ningbo 315211, Zhejiang, China; 2.Department of Laboratory, Ningbo First Hospital, Ningbo 315010, Zhejiang, China; 3.Laboratory of Gastroenterology, Affiliated Hospital of Ningbo University, Ningbo 315020, Zhejiang, China
To analyze the distribution and antibiotic resistance of pathogenic bacteria in blood culture of Ningbo Certain Hospital from 2016 to 2020, to provide reference and basis for clinical diagnosis and treatment.The isolation data and drug susceptibility results of major pathogens from blood culture-positive isolates from patients with blood infections were analyzed by WHONET5.6 software.A total of 3400 pathogens were isolated from blood culture specimens, included 1545 strains of Gram-negative bacilli strains (45.4%), 1510 Gram-positive cocci (44.4%), and 111 Fungi strains (3.3%). The gram-negative bacilli were mainly Escherichia coli, Klebsiella pneumoniaePseudomonas aeruginosa, Acinetobacter baumanniiand Burkholderia onion, accounted for 21.0%, 9.6%, 2.7%, 2.2% and 1.3% of the total strains, respectively. The isolation rate of Klebsiella pneumoniae was on the rise. The Gram-positive cocci were mainly coagulase-negative staphylococci, with 867 strains accouned for 25.5%. The detection rate of methicillin-resistant Staphylococcus aureus was 37.3%, and no strains were resistant to vancomycin, teicoplanin and linezolid.In Ningbo Certain Hospital, the proportion of Gram-negative bacilli and Gram-positive cocci among the pathogens of bloodstream infections is comparable. Clinicians should attach importance to and standardize early blood culture and strictly control the use of antibiotics to reduce the infection and spread of drug-resistant bacteria.
Bloodstream infection; Blood culture; Pathogenic bacteria; Drug resistance
R378
A
10.3969/j.issn.1673-9701.2023.18.010
(2022–12–25)
(2023–03–08)
谷海瀛,电子信箱:guhaiying@nbu.edu.cn
