叶酸通过改善内皮型一氧化氮合酶解偶联抑制腹主动脉瘤发展研究
2023-07-22金忠调孙静媛梅瑛娜夏敏琪高凌
金忠调,孙静媛,梅瑛娜,夏敏琪,高凌
当腹主动脉横径超过正常横径 50%时可被诊断为腹主动脉瘤(abdominal aortic aneurysm,AAA),AAA的危险系数与动脉横径呈正比,横径越大,破裂风险越高。既往认为AAA仅仅是由于动脉中膜的缺陷所导致,动脉细胞外基质降解、平滑肌细胞凋亡、氧化应激和炎性反应导致主动脉壁受损[1]。但近年来研究发现血管内皮也直接或者间接参与了AAA病变[2]。本课题组早期研究发现叶酸(folic acid,FA)对内皮细胞功能不全的AAA 模型小鼠(hph1小鼠是GTP环水解酶1缺乏的小鼠,因BH4 缺乏导致内皮细胞功能不全)有治疗作用[3],但是对其他AAA模型小鼠的治疗作用以及机制不明。延胡索酸-3-氨基丙腈 (β-aminopropionitrile monofumarate,BAPN)是一种不可逆赖氨酸氧化酶(lysyl oxidase,LOX)抑制剂,可防止赖氨酸衍生醛的形成。LOX交联弹性蛋白和胶原纤维,在维持弹性层的稳态中起着关键作用。有研究证明通过 NADPH 氧化酶 (NADPH oxidase,NOX) 的瞬时激活和随之而来的过氧化氢依赖性、内皮特异性四氢生物喋啉(Tetrahydrobiopterin,BH4)补救酶二氢叶酸还原酶(dihydrofolate reductase,DHFR)缺乏来解偶联内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)[4]。故以血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)联合BAPN建造另一种AAA小鼠模型,探究FA对其他模型的AAA是否有改善作用,报道如下。
1 材料与方法
1.1 材料 (1)实验动物:8周龄C57BL/6雄性小鼠30只,SPF(specific pathogen free)级,由武汉大学人民医院动物实验中心提供。小鼠饲养在SPF级屏障环境中,正常昼夜周期,自由饮水,室温控制在(22.0±0.1)℃,湿度(60±10)%。(2)试剂与仪器:Ang Ⅱ(A9290)、叶酸(F8090)、HE染色试剂盒(G1120)、Weigert间苯二酚品红染色试剂盒(G0032)购自武汉索莱宝生物科技有限公司,BAPN购自sigma公司,DHE荧光探针试剂(KFS377)购自北京百奥莱博科技有限公司, eNOS(GB11086)、MMP-2(GB11130)、MMP-9(GB12132)抗体购自武汉市赛维尔生物科技有限公司,DHFR(A9299)抗体购自爱博泰克生物科技有限公司。Altzet微量渗透泵购自上海玉研科学仪器有限公司,高精度电子游标卡尺购自德国苏测,正置显微镜 (型号BX51,日本奥林巴斯),冰冻切片机 (型号 HM550,德国美康),酶标仪 (EnSight 美国Perkin Elmer),化学发光仪 (ChemiDocTM Touch 美国BIO-RAD)。
1.2 实验方法
1.2.1 AAA造模:于2022年7—10月在武汉大学人民医院中心实验室进行实验[伦理号:WDRM动(福)第20210904号]。小鼠30只称体质量,依照随机数字表法分为3组,正常对照组(n=10):实验全程用普通饲料喂养,自由进水;AAA组(n=10):参照孙静媛等[5]造模方法诱导腹主动脉瘤,小鼠皮下植入微量渗透泵持续泵入 Ang Ⅱ (1 μg·kg-1·min-1) 28 d,同时用含0.25% BAPN 饲料饲喂 28 d; AAA+FA组(n=10):小鼠皮下植入微量渗透泵持续泵入 Ang Ⅱ (1 μg·kg-1·min-1)28 d,同时用含0.25% BAPN饲料饲喂28 d,叶酸(15 mg·kg-1·d-1)灌胃28 d。
1.2.2 样品采集及处理:于实验第29天眼眶取血0.8 ml,4℃离心留取上清-80℃保存。取一部分新鲜腹主动脉组织多聚甲醛中固定,行石蜡包埋;另一部分腹主动脉组织液氨冻存,待用。
1.3 观测指标与方法
1.3.1 腹主动脉瘤直径测量:所有小鼠开胸腹并暴露心脏、主动脉及双侧肾脏,用生理盐水冲洗心脏和主动脉,将主动脉与周围组织分离,生理盐水经心脏灌入主动脉中,使主动脉保持正常形状,使用高精度电子游标卡尺测量主动脉直径,最宽处直径大于正常值的50%时,即认定为发生腹主动脉瘤。
1.3.2 腹主动脉壁中弹性纤维变化观测:于实验第29天处死小鼠,剖开腹部暴露并分离腹主动脉,剪切腹主动脉用4%多聚甲醛保存。(1)腹主动脉弹性纤维染色:主动脉标本从多聚甲醛中取出,行石蜡包埋,切片(横切,片厚4 μm),切片脱蜡至水,置入Weigert间苯二酚品红染色液的染缸,浸染3 h,冲洗,乙醇去除细胞浆背景着色,冲洗,常规脱水,透明,封片。置于正置显微镜下观察并摄片。(2)腹主动脉Masson染色:石蜡切片脱蜡至水,重铬酸钾染液滴染,铁苏木素液A与铁苏木素液B混合滴染;盐酸酒精分化后丽春红酸性品红染液滴染,磷钼酸分化液分化后苯胺蓝染液滴染;乙醇脱水,二甲苯透明后,中性树胶封片。采用40×放大倍数显微镜镜检,图像采集分析。
1.3.3 ROS含量检测: 采用二氢乙啶 (dihydroethidium,DHE) 荧光对腹主动脉壁染色。小鼠新鲜腹主动脉组织用冰冻切片包埋剂 (OCT) 包埋,用冰冻切片机垂直于血管纵轴切片;滴加DHE荧光染料,37℃避光孵育30 min,PBS洗3次,抗荧光淬灭剂封片,正置荧光显微镜镜检。
1.3.4 Western blot检测蛋白表达:取瘤样病变血管组织46 mg,加入蛋白裂解液和蛋白酶抑制剂冰浴匀浆,离心取上清,BSA法测定总蛋白浓度。取蛋白样品加5×电泳缓冲液,加热至变性,后凝胶电泳,转膜,BSA封闭液封闭,一抗采用兔抗eNOS、MMP-2、MMP-9、DHFR抗体4℃孵育过夜,HRP标记羊抗兔二抗孵育,洗脱、发光,曝光显色。采用Image J软件进行光密度扫描进行半定量分析。
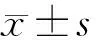
2 结 果
2.1 腹主动脉瘤的发生率及腹主动脉直径比较 AAA组发生腹主动脉瘤8只(其中实验第21天腹主动脉瘤破裂死亡1只),AAA+FA组发生腹主动脉瘤4只,与AAA组比较,AAA+FA组小鼠腹主动脉瘤发生率降低(40.0% vs. 80.0%,χ2/P=1.667/0.170)。虽然腹主动脉瘤发生率降低无显著差异,但与正常对照组比较,AAA组腹主动脉直径明显增大[(0.99±0.07)mm vs.(2.08±0.50 )mm,t/P=6.417/<0.001],并且明显大于AAA+FA组(1.44±0.19)mm,差异具有统计学意义(t/P=3.598/0.005)。见图1。
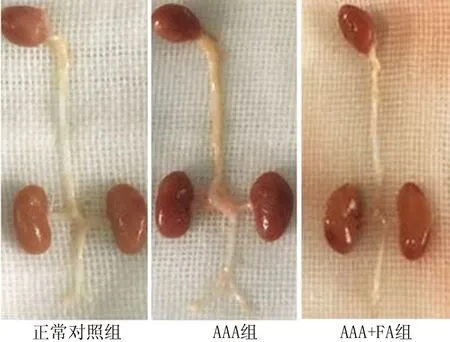
图1 3组小鼠腹主动脉大体标本比较Fig.1 Comparison of gross specimens of abdominal aorta in three groups of mice
2.2 3组小鼠腹主动脉壁中弹性纤维变化比较 腹主动脉Masson、Weigert间苯二酚碱性品红染色显示,与正常对照组比较,AAA组小鼠腹主动脉瘤部位主动脉壁弹力纤维排列紊乱,并且有断裂及溶解,失去正常波浪状结构;与AAA组比较,AAA+FA组小鼠腹主动脉壁弹力纤维结构完整平滑,走形规则连续呈波浪状结构,见图2。
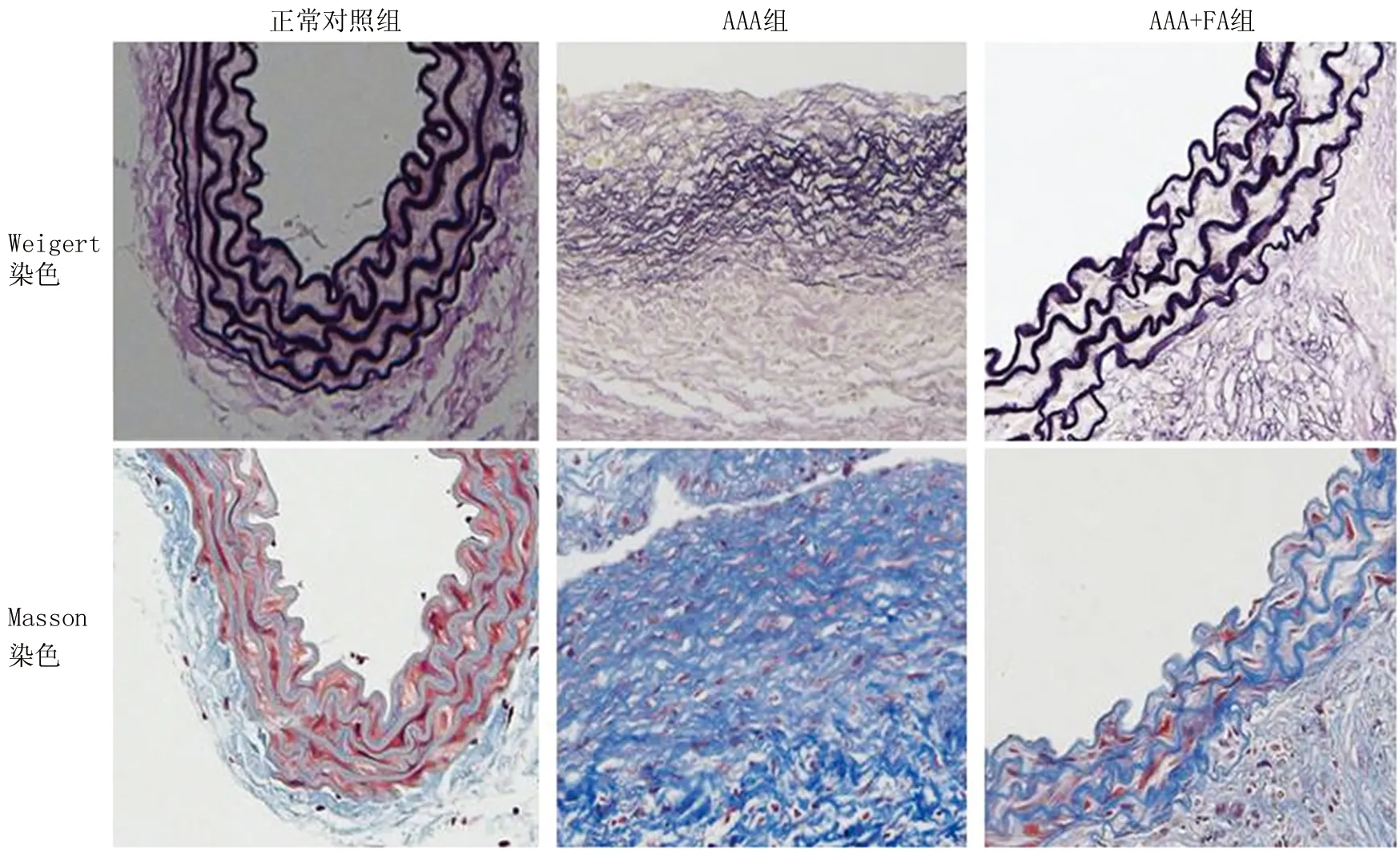
图2 3组小鼠腹主动脉壁中弹性纤维变化比较(×40)Fig.2 Comparison of changes in elastic fibers in the abdominal aortic wall of three groups of mice (×40)
2.3 3组小鼠腹主动脉壁中ROS含量表达比较 腹主动脉DHE染色结果显示,与正常对照组比较,AAA组红色荧光明显增强,表明AAA小鼠腹主动脉ROS表达增多;与AAA组比较, AAA+FA组小鼠腹主动脉组织中红色荧光强度明显减弱,表明 ROS 含量减少,见图3。
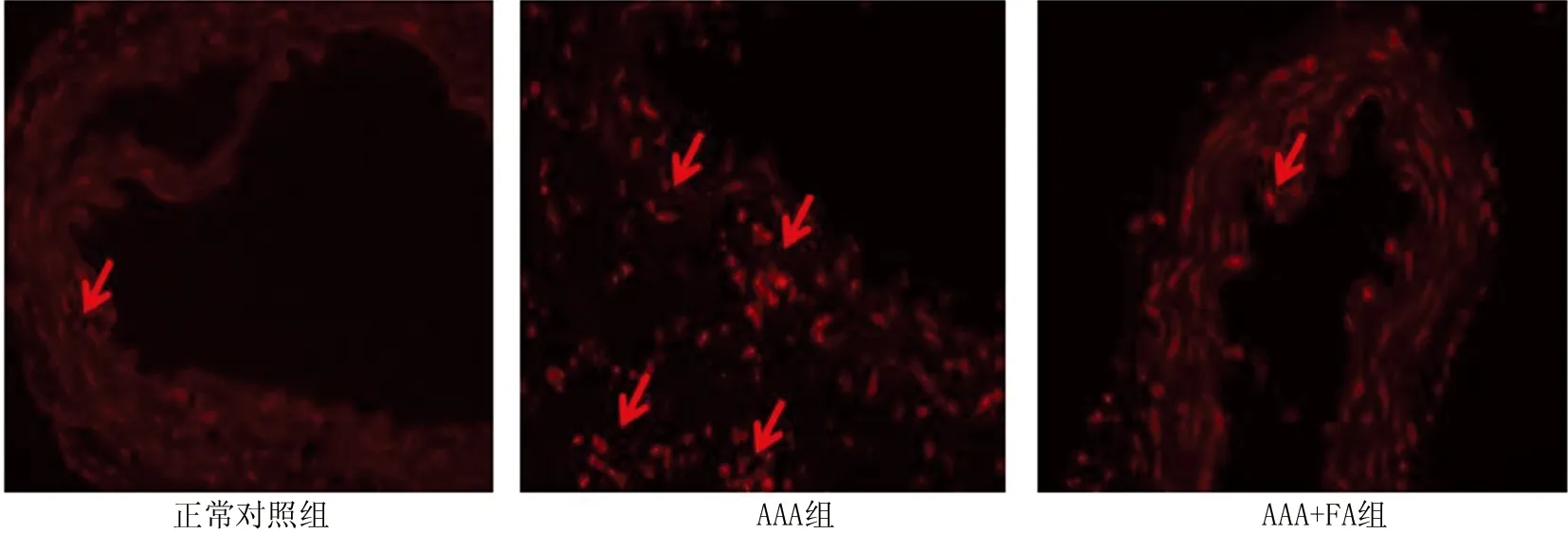
图3 3组小鼠腹主动脉活性氧表达比较(二氢乙啶染色,×40)Fig.3 Expression of reactive oxygen species in the abdominal aorta of three groups of mice (stained with dihydroethylidine, ×40)
2.4 3组小鼠eNOS、DHFR、MMP-2、MMP-9蛋白表达差异比较 与正常对照组比较,AAA组腹主动脉eNOS、DHFR蛋白表达明显下降,AAA+FA组上述2种蛋白表达高于AAA组(t/P=4.511/0.011,2.914/0.044)。MMP参与AAA的细胞外基质(ECM)破坏和主动脉壁重构[6];通过Western blot检测主动脉组织中MMP的表达, MMP-2和MMP-9蛋白水平AAA组小鼠显著高于正常对照组,而AAA+FA组小鼠主动脉MMP-2和MMP-9蛋白水平显著下降(t/P=4.206/0.048,5.267/0.011),见图4。
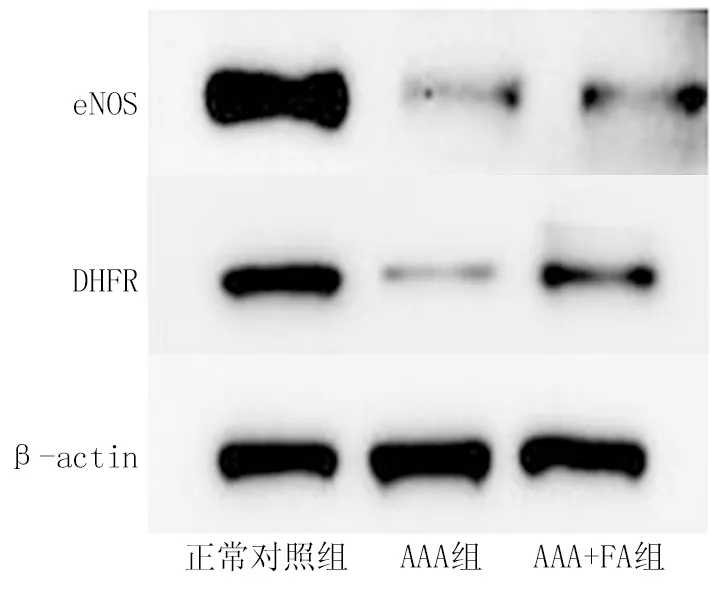
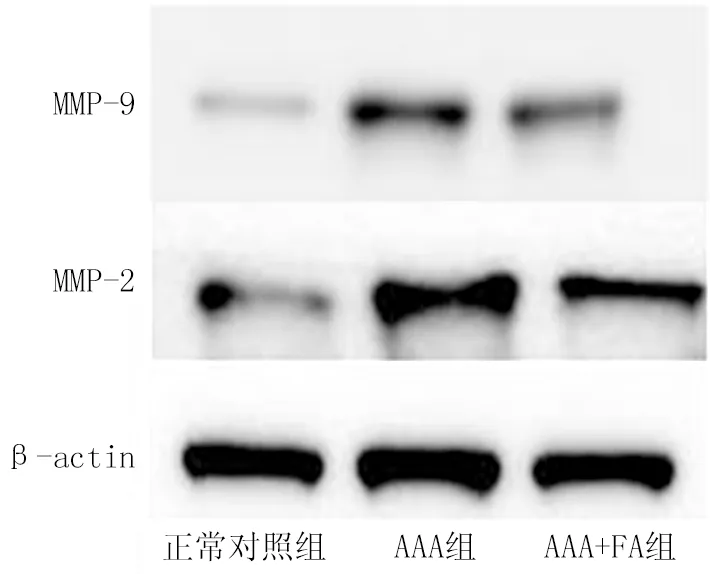
图4 3组小鼠腹主动脉各蛋白表达比较Fig.4 Comparison of protein expression in abdominal aorta of three groups of mice
3 讨 论
腹主动脉瘤是多因素影响的具有潜在破裂风险的主动脉病理扩张性疾病。目前的治疗方案主要是开放手术和介入治疗,缺乏有效的药物控制AAA的发展。本研究采用AngⅡ联合BAPN诱导小鼠AAA模型进行研究,采用口服给药的方式给予叶酸干预。虽然结果显示AAA组与AAA+FA组的AAA发生率无显著差异,这可能是由于样本数量少的原因。但是口服叶酸可以显著抑制AngⅡ联合BAPN诱导的小鼠腹主动脉直径扩张,并且防止主动脉弹性纤维破坏。
AAA的发病机制是多因素的,包括中性粒细胞、巨噬细胞和肥大细胞对外膜和中膜的浸润;平滑肌细胞的增殖转化和丧失;动脉瘤组织中氧化应激水平的升高;细胞外基质的降解[7]。目前认为,AAA的发病机制还涉及动脉粥样硬化和血流动力学紊乱,其中内皮细胞发挥了重要作用[8]。有研究已经证明eNOS解偶联与BH4缺乏的因果作用,以及eNOS再偶联在AAA形成中的治疗潜力[9]。eNOS解偶联导致一氧化氮(nitric oxide,NO)生物利用度下降,氮氧化合物累积从而引起内皮氧化应激。BH4作为eNOS偶联的辅助因子,当BH4的从头合成及补救合成限速酶DHFR缺乏时,同样会导致内皮功能障碍[10-11]。有研究已经证明,叶酸通过恢复 DHFR 以恢复 eNOS 功能来预防AngⅡ输注apoE缺失小鼠AAA 模型[12]。本研究中使用AngⅡ联合BAPN诱导的AAA模型中的结果与之相符。
除此之外,内皮是刺激或抑制底层平滑肌细胞增殖的分子来源。在正常的血管壁中,平滑肌细胞是静止的,但当内皮受损时则会增殖[13]。内皮细胞和平滑肌细胞之间的相互作用是多种心血管病过程的基础,如动脉生成、动脉粥样硬化和动脉重塑[14]。叶酸通过恢复内皮功能进一步维持动脉肌层稳态,抑制BAPN联合AngⅡ诱导的中膜平滑肌细胞紊乱和炎性反应。
MMP在AAA形成过程中起着重要作用[15]。在正常主动脉中,内皮细胞、平滑肌细胞(SMC)和外膜成纤维细胞负责MMP的产生。在AAA的情况下,炎性细胞充当MMP的额外来源[16]。MMP是与细胞外基质(ECMs)降解机制关联最紧密的一类酶,可降解腹主动脉壁组织中胶原和弹力蛋白成分。AAA形成过程中起主要作用的种类为MMP-2、MMP-9。MMP-9和活化的MMP-2在异种移植动脉瘤变性过程中上调,这些酶的进一步增加与破裂有关[17]。MMP-2、MMP-9由成纤维细胞和SMC产生,并在AAA形成期间通过浸润外膜巨噬细胞产生[18-19]。据报道,FA治疗降低了糖尿病大鼠及高同型半胱氨酸(homocysteine,Hcy)血症小鼠诱导的MMP-2、MMP-9分泌及活性[20-21]。有研究证明,FA通过诱导5-亚甲基四氢叶酸还原酶(5-methylene tetrahydrofolate reductase,5-MTHFR)将Hcy重新甲基化为甲硫氨酸来降低同型半胱氨酸水平,并诱导了金属蛋白酶组织抑制剂,共同降低金属蛋白酶[22]。本研究结果也进一步表明,AAA中MMP-2、MMP-9上调明显,叶酸口服治疗后上述2种基质金属蛋白酶明显下降。
综上,口服叶酸可能成为预防或治疗AAA的一种选择。
利益冲突:所有作者声明无利益冲突
作者贡献声明
金忠调:设计研究方案,实施研究过程,论文撰写;孙静媛、梅瑛娜、夏敏琪:实施研究过程,数据收集;高凌:提出研究方案、研究思路,论文审核
